新人教版化学高中选修四2.4:化学反应进行的方向(共29张PPT)
文档属性
| 名称 | 新人教版化学高中选修四2.4:化学反应进行的方向(共29张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-23 16:16:32 | ||
图片预览








文档简介
(共29张PPT)
自然界中有许多能自然而然发生的现象,
请同学们联系生活知识,
列举一些能自发进行的例子?
生活中的自发过程
高山流水
电流
生活中的自发过程
高山流水
高能状态
低能状态
利用水泵可将水从低处流向高处
生活中的自发过程
高电势状态
低电势状态
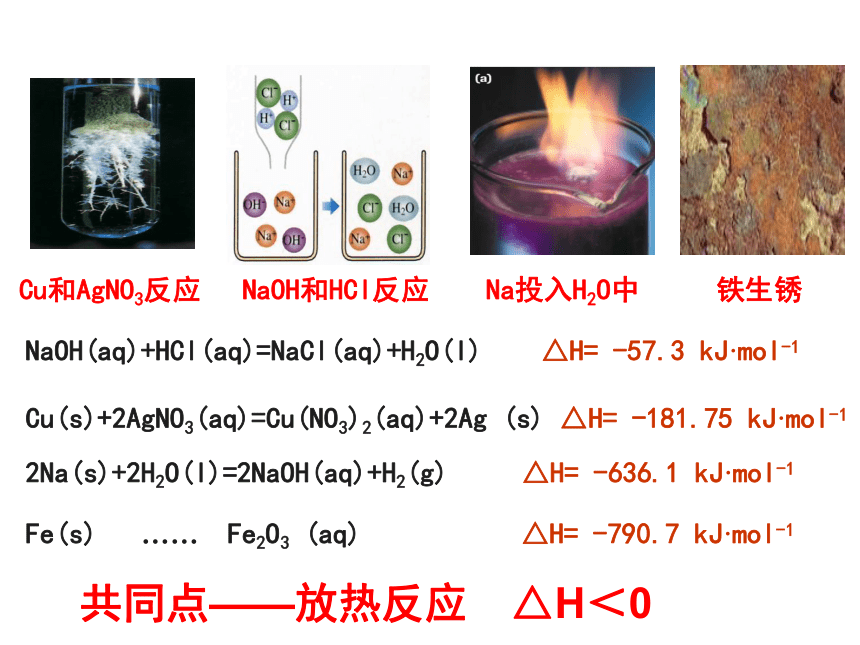
Na投入H2O中
铁生锈
生活中的自发反应
Cu和AgNO3反应
NaOH和HCl反应
生活中的自发反应
自发过程:
在一定条件下,不借助外部力量就能自动进行的过程
在给定的一组条件下,一个反应可以自发地进行到显著程度,就称为自发反应。
如何判断一个过程,一个反应能否自发进行?
自发反应:
非自发过程:
在一定条件下,需要持续外力作用才能维持进行的过程。
寻找反应能否自发进行的判据
第四节
化学反应进行的方向
Cu和AgNO3反应
NaOH和HCl反应
Na投入H2O中
铁生锈
Cu(s)+2AgNO3(aq)=Cu(NO3)2(aq)+2Ag
(s)
△H=
-181.75
kJ·mol-1
NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
△H=
-57.3
kJ·mol-1
2Na(s)+2H2O(l)=2NaOH(aq)+H2(g)
△H=
-636.1
kJ·mol-1
Fe(s)
……
Fe2O3
(aq)
△H=
-790.7
kJ·mol-1
自发反应
共同点——放热反应 △H<0
二、化学反应进行方向的判据
1、能量判据(焓判据)
能量判据(焓判据)∶
自发过程的体系趋向于从高能状态转变为低能状态(△H
﹤0)。
即△H<0的反应有自发进行的倾向。
多数能自发进行的化学反应是放热反应
反应物的总能量高
生成物的总能量低
放热反应
△H<0
焓判据是判断化学反应进行方向的判据之一。
注意:
(1)焓判据只能用于判断过程的方向,能否实现要看具体条件;
(2)焓判据只判断一定条件化学反应能否自发进行,与化学反应速率无关。
(3)反应焓变是反应能否自发进行的一个因素,但不是唯一因素
2N2O5(g)
=4NO2(g)+O2(g)
△H=+56.7kJ/mol
(NH4)2CO3(s)=NH4HCO3(s)+NH3(g)
△H=+74.9
kJ/mol
NH4HCO3(s)+CH3COOH(aq)=CO2(g)+CH3COONH4(aq)+H2O(l);
△H(298K)=+37.3KJ/mol
结论:△H
<
O有利于反应自发进行
但自发反应不一定要△H
<
O
焓变是反应能否自发进行的一个因素,但不是唯一因素。
自发反应一定要△H
<
O
?
冰块融化
品红在水中扩散
你能解释蒸汽扩散和火柴混乱的真正原因吗?
蒸汽扩散
火柴散落
有序排列的火柴散落时自发地成为无序排列
——趋向于体系混乱度增大
有序
混乱
火柴散落
克劳修斯
(德国)
熵
S
定义:描述体系混乱度的物理量
符号:S
单位:J·mol-1·K-1
体系混乱度越大,熵值越大;
体系混乱度越小,熵值越小。
熵增原理(又称为熵判据).
体系有自发向混乱度增加的方向变化的倾向。(即熵增△S>0)
△S=S生成物总熵-S反应物总熵
△S越大,越有利于反应自发进行
标准状况下:1
mol不同物质的熵S(J
mol-1K-1)
知识介绍
CH4
O2
CO2
186.15
205.03
214
H2O(l)
HNO3(l)
Br2(l)
69.9
156
152
NaCl
Fe
金刚石
72.1
27.3
2.4
熵值最大
熵值最小
(1)物质的混乱度:体系混乱度越大,熵值越大;
(2)同一条件:不同物质的熵值不同;
(3)物质的存在状态:S(g)
>
S(l)
>
S(s)。
2N2O5(g)
=4NO2(g)+O2(g)
△H=+56.7kJ/mol
(NH4
)2CO3(s)=NH4HCO3(s)+NH3(g)
△H=+74.9
kJ/mol
思考:
两个反应都是混乱度增大的反应。
熵增,△S>0,有利于自发反应
这两个反应都是吸热反应,但却能自发进行,为什么?
1、同一物质状态改变:
2、固体的溶解过程、墨水扩散过程和气体扩散过程。
3、反应过程中气体物质的量增多的反应。
4.
生成气体的反应。
导致熵增(△S>0)的一些因素
固态
液态
气态
熵增
熵增
自发反应一定是熵增加的反应吗?
2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)
△S=-39.35J?mol-1?K-1
结论:△S
>
O,有利于反应自发进行,
自发反应不一定要△S
>
O。
熵变是反应能否自发进行一个因素,但不是唯一因素。
铝热反应(
△S<0)也能自发反应。
CaCO3(s)=CaO(s)+CO2(g)这个反应能否自发进行?
已知:
△H(298K)=+178.2KJ?mol-1,
△S(298K)=+169.6J?mol-1?K-1
思考
总结:自发过程的变化趋势
1.能量趋于降低
2.混乱度趋于增加
美国物理化学家吉布斯
自由能
研究表明:在温度、压强一定的条件下,化学反应自发进行方向的判据是
△G
=
△H
-
T△S
(
G
~吉布斯自由能
T
~绝对温度+)
△G
=
△H
-
T△S
<
0
反应能自发进行
△G
=
△H
-
T△S
>0
反应不能自发进行
△G
=
△H
-
T△S
=0
反应达到平衡状态
反应进行方向的判断方法:
2、物质的混乱度趋于增加
1、物质具有的能量趋于降低
?H(焓变)
?S(熵变)>0
放热反应
自发进行
不自发进行
不能定性判断
不能定性判断
?H<0
?H<0
?H>0
?H>0
?S>0
?S>0
?S<0
?S<0
熵增原理
<0
三、复合判据
焓变
熵变
化学反应能否自发进行
?H>0
?S>0
高温下
反应自发进行
?H>0
?S<0
所有温度下
反应不能自发进行
?H<0
?S>0
所有温度下
反应自发进行
?H<0
?S<0
低温下
反应自发进行
放热
熵增
吸热
熵减
放热
熵减
吸热
熵增
2)TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)
△H=+161.9kJ·mol-1
3)NH3(g)+HCl(g)=NH4Cl(s)
△H=
-176.9kJ·mol-1
△S=
-38.4J·mol-1·K-1
△S=
-284.3J·mol-1·K-1
△S=+169.6J·mol-1·K-1
4)CaCO3(s)=CaO(s)+CO2(g
)
应用判据解决问题
根据你已有的知识和经验,分析下列过程的焓变、熵变与是能否自发进行
△H=+178.2kJ·mol-1
△H=
-
57.3kJ·mol-1
1)H+(aq)+OH-(aq)=H2O
(l)
△S=+80.7J·mol-1·K-1
从“熵”的角度看世界
薛定谔所著《生命是什么?》
“热力学第二定律是一个最深刻、最普遍的定律。它有着自身忧郁的美,象所有重要定律一样,引起人们的崇敬之情。”
—
英国作家
C.P.Snow
正如“能”的观点被人们普遍接受一样,“熵”的观点也越来越多地被人们用来解释物理、化学、生命、信息、生活中的诸多行为与现象。
熵与环境
在环境学家看来熵增就是污染……
熵在其他领域的应用
衰老是生命系统的熵的一种长期的缓慢的增加,
也就是说随着生命的衰老,生命系统的混乱度
增大,当熵值达极大值时即死亡,
这是一个不可抗拒的自然规律。
熵与生命:
熵在其他领域的应用
自然界中有许多能自然而然发生的现象,
请同学们联系生活知识,
列举一些能自发进行的例子?
生活中的自发过程
高山流水
电流
生活中的自发过程
高山流水
高能状态
低能状态
利用水泵可将水从低处流向高处
生活中的自发过程
高电势状态
低电势状态
Na投入H2O中
铁生锈
生活中的自发反应
Cu和AgNO3反应
NaOH和HCl反应
生活中的自发反应
自发过程:
在一定条件下,不借助外部力量就能自动进行的过程
在给定的一组条件下,一个反应可以自发地进行到显著程度,就称为自发反应。
如何判断一个过程,一个反应能否自发进行?
自发反应:
非自发过程:
在一定条件下,需要持续外力作用才能维持进行的过程。
寻找反应能否自发进行的判据
第四节
化学反应进行的方向
Cu和AgNO3反应
NaOH和HCl反应
Na投入H2O中
铁生锈
Cu(s)+2AgNO3(aq)=Cu(NO3)2(aq)+2Ag
(s)
△H=
-181.75
kJ·mol-1
NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
△H=
-57.3
kJ·mol-1
2Na(s)+2H2O(l)=2NaOH(aq)+H2(g)
△H=
-636.1
kJ·mol-1
Fe(s)
……
Fe2O3
(aq)
△H=
-790.7
kJ·mol-1
自发反应
共同点——放热反应 △H<0
二、化学反应进行方向的判据
1、能量判据(焓判据)
能量判据(焓判据)∶
自发过程的体系趋向于从高能状态转变为低能状态(△H
﹤0)。
即△H<0的反应有自发进行的倾向。
多数能自发进行的化学反应是放热反应
反应物的总能量高
生成物的总能量低
放热反应
△H<0
焓判据是判断化学反应进行方向的判据之一。
注意:
(1)焓判据只能用于判断过程的方向,能否实现要看具体条件;
(2)焓判据只判断一定条件化学反应能否自发进行,与化学反应速率无关。
(3)反应焓变是反应能否自发进行的一个因素,但不是唯一因素
2N2O5(g)
=4NO2(g)+O2(g)
△H=+56.7kJ/mol
(NH4)2CO3(s)=NH4HCO3(s)+NH3(g)
△H=+74.9
kJ/mol
NH4HCO3(s)+CH3COOH(aq)=CO2(g)+CH3COONH4(aq)+H2O(l);
△H(298K)=+37.3KJ/mol
结论:△H
<
O有利于反应自发进行
但自发反应不一定要△H
<
O
焓变是反应能否自发进行的一个因素,但不是唯一因素。
自发反应一定要△H
<
O
?
冰块融化
品红在水中扩散
你能解释蒸汽扩散和火柴混乱的真正原因吗?
蒸汽扩散
火柴散落
有序排列的火柴散落时自发地成为无序排列
——趋向于体系混乱度增大
有序
混乱
火柴散落
克劳修斯
(德国)
熵
S
定义:描述体系混乱度的物理量
符号:S
单位:J·mol-1·K-1
体系混乱度越大,熵值越大;
体系混乱度越小,熵值越小。
熵增原理(又称为熵判据).
体系有自发向混乱度增加的方向变化的倾向。(即熵增△S>0)
△S=S生成物总熵-S反应物总熵
△S越大,越有利于反应自发进行
标准状况下:1
mol不同物质的熵S(J
mol-1K-1)
知识介绍
CH4
O2
CO2
186.15
205.03
214
H2O(l)
HNO3(l)
Br2(l)
69.9
156
152
NaCl
Fe
金刚石
72.1
27.3
2.4
熵值最大
熵值最小
(1)物质的混乱度:体系混乱度越大,熵值越大;
(2)同一条件:不同物质的熵值不同;
(3)物质的存在状态:S(g)
>
S(l)
>
S(s)。
2N2O5(g)
=4NO2(g)+O2(g)
△H=+56.7kJ/mol
(NH4
)2CO3(s)=NH4HCO3(s)+NH3(g)
△H=+74.9
kJ/mol
思考:
两个反应都是混乱度增大的反应。
熵增,△S>0,有利于自发反应
这两个反应都是吸热反应,但却能自发进行,为什么?
1、同一物质状态改变:
2、固体的溶解过程、墨水扩散过程和气体扩散过程。
3、反应过程中气体物质的量增多的反应。
4.
生成气体的反应。
导致熵增(△S>0)的一些因素
固态
液态
气态
熵增
熵增
自发反应一定是熵增加的反应吗?
2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)
△S=-39.35J?mol-1?K-1
结论:△S
>
O,有利于反应自发进行,
自发反应不一定要△S
>
O。
熵变是反应能否自发进行一个因素,但不是唯一因素。
铝热反应(
△S<0)也能自发反应。
CaCO3(s)=CaO(s)+CO2(g)这个反应能否自发进行?
已知:
△H(298K)=+178.2KJ?mol-1,
△S(298K)=+169.6J?mol-1?K-1
思考
总结:自发过程的变化趋势
1.能量趋于降低
2.混乱度趋于增加
美国物理化学家吉布斯
自由能
研究表明:在温度、压强一定的条件下,化学反应自发进行方向的判据是
△G
=
△H
-
T△S
(
G
~吉布斯自由能
T
~绝对温度+)
△G
=
△H
-
T△S
<
0
反应能自发进行
△G
=
△H
-
T△S
>0
反应不能自发进行
△G
=
△H
-
T△S
=0
反应达到平衡状态
反应进行方向的判断方法:
2、物质的混乱度趋于增加
1、物质具有的能量趋于降低
?H(焓变)
?S(熵变)>0
放热反应
自发进行
不自发进行
不能定性判断
不能定性判断
?H<0
?H<0
?H>0
?H>0
?S>0
?S>0
?S<0
?S<0
熵增原理
<0
三、复合判据
焓变
熵变
化学反应能否自发进行
?H>0
?S>0
高温下
反应自发进行
?H>0
?S<0
所有温度下
反应不能自发进行
?H<0
?S>0
所有温度下
反应自发进行
?H<0
?S<0
低温下
反应自发进行
放热
熵增
吸热
熵减
放热
熵减
吸热
熵增
2)TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)
△H=+161.9kJ·mol-1
3)NH3(g)+HCl(g)=NH4Cl(s)
△H=
-176.9kJ·mol-1
△S=
-38.4J·mol-1·K-1
△S=
-284.3J·mol-1·K-1
△S=+169.6J·mol-1·K-1
4)CaCO3(s)=CaO(s)+CO2(g
)
应用判据解决问题
根据你已有的知识和经验,分析下列过程的焓变、熵变与是能否自发进行
△H=+178.2kJ·mol-1
△H=
-
57.3kJ·mol-1
1)H+(aq)+OH-(aq)=H2O
(l)
△S=+80.7J·mol-1·K-1
从“熵”的角度看世界
薛定谔所著《生命是什么?》
“热力学第二定律是一个最深刻、最普遍的定律。它有着自身忧郁的美,象所有重要定律一样,引起人们的崇敬之情。”
—
英国作家
C.P.Snow
正如“能”的观点被人们普遍接受一样,“熵”的观点也越来越多地被人们用来解释物理、化学、生命、信息、生活中的诸多行为与现象。
熵与环境
在环境学家看来熵增就是污染……
熵在其他领域的应用
衰老是生命系统的熵的一种长期的缓慢的增加,
也就是说随着生命的衰老,生命系统的混乱度
增大,当熵值达极大值时即死亡,
这是一个不可抗拒的自然规律。
熵与生命:
熵在其他领域的应用
