九年级化学第四单元自然界的水 4 化学式与化合价 (共69张ppt)
文档属性
| 名称 | 九年级化学第四单元自然界的水 4 化学式与化合价 (共69张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-22 00:00:00 | ||
图片预览









文档简介
(共69张PPT)
课题4
化学式与化合价
(第一课时)
第四单元、自然界的水
本节导学
化
学
式
与
化
合
价
单质化学式及意义
化合物化学式(组成)及意义
元素化合价及根化合价
化合物化学式(下标)
化学式的有关计算
学习目标:
1
知道什么是化学式?怎样书写?
2
掌握化学式所表示的意义
3
能区分化学符号周围各数字的含义
自学指导一:
快速阅读课本P83,3分钟后回答下列问题:
1、元素用________表示;物质用_______表示。
2、什么是化学式?
3、化学式怎样书写?其意义有哪些?
元素符号
化学式
化学式:
用元素符号和数字的组合来表示物质组成的
式子。(只有纯净物才有化学式,且只有一个;
但同一化学式可表示不同物质。)
如:氧气
水
二氧化碳
氯酸钾
白磷
红磷
O2
H2O
CO2
KClO3
P
P
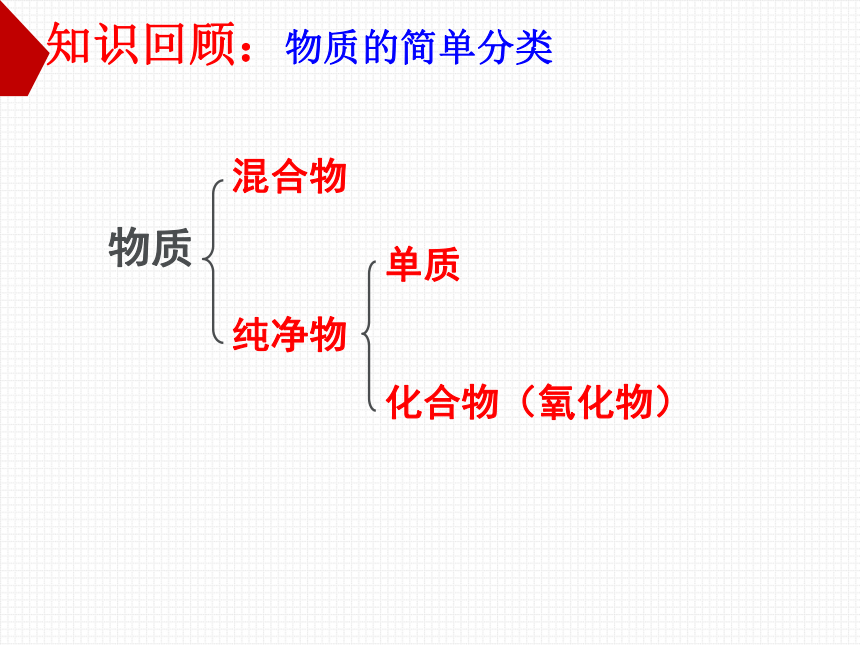
物质
混合物
纯净物
单质
化合物(氧化物)
知识回顾:物质的简单分类
(一)单质化学式的写法、意义,读法:
氟氯溴碘氮氧氢,原子两个要记清。(O3、C60除外)
其他单质化学式,元素符号来表明。
N2
Cu
①氮气
②一个氮分子
③一个氮分子由两
个氮原子构成
①铜
②铜元素
③一个铜原子
F2、Cl2、Br2、I2、N2、O2、H2(由分子构成的单质)
C、P、Si、Fe、Cu、Ne、Ar
…(由原子构成的单质)
书写:
意义:
2N2:____________
2Cu:___________
两个氮分子
两个铜原子
气体-----------某气
固体,液体--某
气液固--------某单质
讨论:(书P83)
符号H、2H、H2、2H2、H+、2H+各具有什么意义?
H
2H
H2
2H2
H+
2H+
①氢元素
②一个氢原子
两个氢原子
①氢气
②一个氢分子
③一个氢分子由两个氢原子构成
两个氢分子
(一个)氢离子
两个氢离子
1
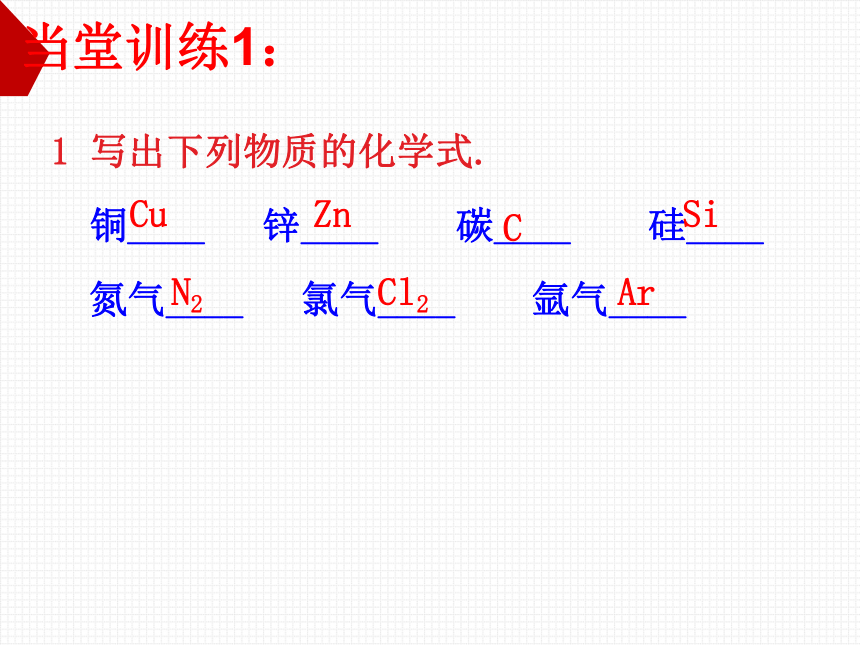
写出下列物质的化学式.
铜____
锌____
碳____
硅____
氮气____
氯气____
氩气____
Cu
Zn
C
Si
N2
Cl2
Ar
当堂训练1:
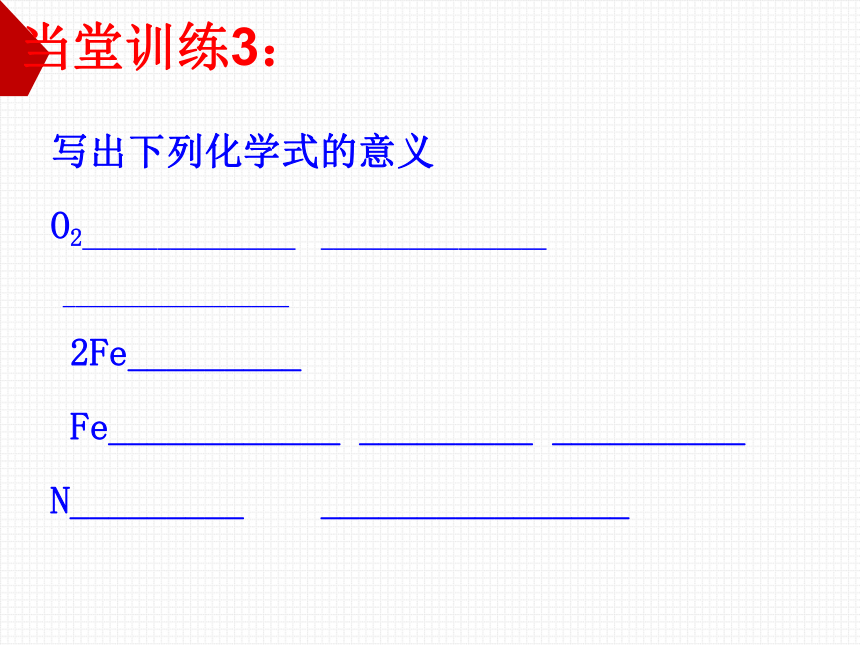
写出下列化学式的意义
O2_________________
__________________
__________________
2Fe_________
Fe____________
_________
__________
N_________
________________
当堂训练3:
当堂训练:
1.下列只表示微观意义的是(
)
A
H2
B
H
C
2H
D
He
2.下列符号中,既能表示一种元素,又能表示一种单质,还能表示一个原子是(
)
A
N2
B
O
C
2N
D Cu
3.用化学用语表示:
氮气
_______
2个氧分子
_______
镁元素_______
氖气
_______
课题4
化学式与化合价
(第二课时)
第四单元、自然界的水
学习目标:
1
初步掌握化合物化学式的写法
2
掌握化合物化学式的意义
3
能根据化合物的名称确定其成分
(二)化合物化学式的写法、意义:
MgO
CO2
SO2
Fe3O4
P2O5
氧在后,另一种元素在前
氧化某、
几氧化几某
读法
写法
氧化物
金属(NH4)元素与非金属
元素(或根)组成的化合物
NaCl
MgCl2
NaOH
KOH
KClO3
KMnO4
CuSO4
Na2SO4
K2CO3
Na2CO3
KNO3
NH4NO3
金前非后
某化某、
某酸某
写法
读法
氢元素与非金属
元素(或根)组成的化合物
HCl
H2CO3
HNO3
H2SO4
H前非后
某化某、
某酸
写法
读法
化学式所表示的意义:
5H2O
5个水分子
二氧化碳
二氧化碳是由碳元素
和氧元素组成的
一个二氧化碳分子
一个二氧化碳分子是
由一个碳原子和两个
氧原子构成的
1
写出下列物质的化学式.
铜____
锌____
碳____
硅____
氮气____
氯气____
氩气____
2
写出下列物质的化学式.
氧化铜______
二氧化锰______
水
__
二氧化氮______
过氧化氢______
二氧化硫___
Cu
Zn
C
Si
N2
Cl2
Ar
CuO
MnO2
H2O
NO2
H2O2
当堂训练1:
1
根据物质的名称指出下列物质所含的成分.
氯化钠
硫化锌
氯酸钾
硫酸铜
碳酸钙
氯化镁
硝酸钾
硝酸铜
氢氧化钙
氢氧化铁
碳酸氢钠
硫酸铵
氯化铵
高锰酸钾
当堂训练2:
写出下列化学式的意义
O2_________________
__________________
__________________
__________________
SO2_______________
____________________
____________________
______________________
5SO2_____________________________
2Fe_________
Fe____________
_________
__________
N_________
________________
当堂训练3:
当堂训练:
1.下列只表示微观意义的是(
)
A
H2
B
H
C
2H
D
He
2.下列符号中,既能表示一种元素,又能表示一种单质,还能表示一个原子是(
)
A
N2
B
O
C
2N
D Cu
3.用化学用语表示:
氮气
_______
2个氧分子
_______
镁元素_______
5个五氧化二磷分子
_______
氖气
_______
课题4
化学式与化合价
(第三课时)
第四单元、自然界的水
1.了解化合价的意义和有关规定,并识记常见
元素和原子团的化合价。
2.学会区分化合价和离子符号的不同表示方法。
3.掌握元素化合价、离子符号与原子的最外电
子的关系。
学习目标:
1.化合物中,化合价有正负之分:
1)氧元素通常显____价,氢元素通常显____价。
2)金属元素跟非金属元素化合时,
金属元素一般显____价,非金属元素显____价。
3)一些元素在不同物质中可显不同的化合价。
4)原子团中,元素正、负化合价代数和不等于____,
等于根价。
2.化合物中,正负化合价的代数和为____。
3.单质中,元素的化合价为____。
自学指导1:快速阅读课本P84-85,填空
-2
+1
正
负
0
0
0
二、化合价:
1、定义:
化学上用“化合价”来表示原子之间相互化
合的数目。
物质
HCl
H2O
CaCl2
P2O5
原子个数比
1∶1
2
∶
1
1
∶
2
2∶
5
2.化合价的表示方法:
H2
H2O
CO
ZnO
AlCl3
0
+1
-2
+2
+3
化合价标在元素符号的正上方,“+、-”
号写在数字的前面
3、化合价与离子符号表示方法的比较:
+1
-1
-2
+3
-2
Na
Cl
O
Al
SO4
Na+
Cl-
O2-
Al3+
SO42-
记忆方法:____________________
头顶化合价;肩扛电荷数
Cl-
元素的化合价由元素原子的最外层电子数决定
4.原子结构示意图、离子、元素化合价
的关系:
+2
Mg
Mg2+
Cl
-1
元素
元素符号
常见化合价
元素
元素符号
常见化合价
钾
K
+1
氢
H
+1
钠
Na
+1
氟
F
-1
银
Ag
+1
氯
Cl
-1、+1、+5、+7
钙
Ca
+2
溴
Br
-1
镁
Mg
+2
氧
O
-2
钡
Ba
+2
硫
S
-2、+4、+6
铜
Cu
+1、
+2
碳
C
+2、+4
铁
Fe
+2
、
+3
硅
Si
+4
铝
Al
+3
氮
N
-3、+2、+4、+5
锰
Mn
+2、+4、+6、+7
磷
P
-3、+3、+5
锌
Zn
+2
元素化合价记忆口诀
一价钾钠氯氢银
二价氧钙钡镁锌
三铝四硅五价磷
二三铁,二四碳
二四六硫都齐全
铜汞二价最常见
遇到亚字价降一
氯有变价一五七
+1
+1
-1
+1
+1
K
Na
Cl
H
Ag
-2
+2
+2
+2
+2
O
Ca
Ba
Mg
Zn
+3
+4
+5
Al
Si
P
+2
+3
+2
+4
Fe
Fe
C
C
-2
+4
+6
S
S
S
+2
+2
Cu
Hg
+2
Fe(亚铁)
-1
+1
+5
+7
Cl
Cl
Cl
Cl
如:
CaCO3;
Mg(OH)2;
NH4Cl
氢氧根
碳酸根
5.原子团:作为一个整体参加反应的原子
集团,叫做原子团,也叫做根。
铵根
概念理解:
①.原子团不是一种物质,它不能独立存在。
②.原子团中各元素的化合价的代数和不等于零,
等于原子团的化合价(根价)。
6.常见的原子团;原子团离子;原子团化合价:
SO42-
CO32-
NO3-
OH-
NH4+
MnO42-
MnO4-
ClO3-
PO43-
HCO3-
-2
SO4
-2
CO3
-1
NO3
-1
OH
+1
NH4
-3
PO4
-2
MnO4
-1
MnO4
-1
ClO3
-1
HCO3
原子团
原子团符号
原子团离子符号
原子团化合价
硫酸根
碳酸根
硝酸根
氢氧根
铵
根
磷酸根
锰酸根
高锰酸根
碳酸氢根
氯酸根
SO4
CO3
NO3
OH
NH4
PO4
MnO4
MnO4
ClO3
HCO3
常见原子团的化合价记忆口诀
负一硝酸、氢氧根
负二硫酸、碳酸根
负三记住磷酸根
只有正一是铵根
-1
-1
NO3
OH
-2
-2
SO4
CO3
-3
PO4
+1
NH4
当堂训练1
1、标出下列物质中各元素的化合价:
氮气
氯化锌
氢氧化钠
N2
ZnCl2
NaOH
+2
-1
+1
-2
+1
原则:单质中元素化合价为0
化合物中元素化合价代数和等于0
0
2、试确定氯酸钾中氯元素的化合价
【思路】
先写出化学式
KClO3
设未知数
解:设KClO3中Cl的化合价为X
列等式(正负价代数和为0)
+1+X+(-2)×3=0
解
X=
+5
+
5
4.确定下列物质中氯元素的化合价且按规律确定
X的化学式:
HCl
X
HClO
ClO2
HClO3
HClO4
3.下列物质中,氮元素的化合价最低的是(
)
A
N2
B
HNO3
C
NO2
D
NH4Cl
X
=
_____
Cl2
D
作业:
1.背诵元素化合价和原子团化合价记忆口诀:
2.默写原子团离子符号:
课题4
化学式与化合价
(第四课时)
第四单元、自然界的水
学习目标:
1.正确掌握根据化学式确定元素的化合价。
2.正确掌握根据原子团的化合价确定其中
元素的化合价。
3.正确掌握根据已知元素的化合价,确定
物质的化学式。
自学指导1:
快速阅读课本P86:
思考
根据已知化合价,怎样写化合物的化学式。
写出碳酸钠
,硫酸铜的化学式
(一)根据元素的化合价确定化学式:
例:写出+4价碳元素的氧化物的化学式:
C
O
C
O
+4
-2
+2
-1
1
2
CO2
正价先、负价后
先约简、后交叉
(1省略不写)
氧化钾______
氧化亚铁______
氧化铁______
氯化钠_______
氯化铝______
氢氧化钾______
氢氧化钙______
氢氧化铁______
碳酸钠_______
硝酸镁_______
硫酸铝_______
氯化铵______
硝酸铵_______
硫酸铵________硫酸_______
2.元素A的原子最外层有1个电子,元素B的最外层电子数
为6个。元素A、B形成化合物的化学式为________。
3.现有
H、Mg、Cl、O
四种元素,两两组合形成的化
合物的化学式为_____________________________。
K2O
AlCl3
NaCl
FeO
Fe2O3
练习1.写出下列物质的化学式:
KOH
Ca(OH)2
Fe(OH)3
Na2CO3
Mg(NO3)2
Al2(SO4)3
NH4Cl
NH4NO3
(NH4)2SO4
+1
+2
-1
-2
A2B
HCl、H2O、MgCl2、MgO
堂堂清:
1.已知元素R的化合价为+3价,下列化学式正确
的是(
)
A
RO
B
RO2
C
R2O3
D
RO3
2.写出下列物质的化学式:
铜:________
碳酸钙:_________
氩气:________
硫酸钠:_________
氮气:
_________
硝酸镁:
_________
氢氧化钡:
_______
硫酸铵:________
3.地壳中含量最多的元素与最多的金属元素组成
的化合物的化学式为___________。
D
Cu
Ar
N2
CaCO3
Na2SO4
Mg(NO3)2
(NH4)2SO4
Ba(OH)2
Al2O3
课题4
化学式与化合价
(第五课时)
第四单元、自然界的水
学习目标:
1.掌握计算物质的相对分子质量;
2.掌握计算物质组成元素的质量比,
3.掌握计算物质中某元素的质量分数。
4.掌握计算物质原子的个数比。
自学指导1:
快速阅读课本P87,8分钟后掌握下列问题:
学会计算:
1.物质的相对分子质量
2.组成物质的各元素的质量比
3.物质中某元素的质量分数
4.一定质量化合物中求某元素质量
根据化学式计算:
1.求相对分子质量(Mr)
例:计算下列相对分子质量:
N2
、
H2SO4、
Cu(OH)2、
CuSO4·5H2O
挑战自我:
3O2
的相对分子质量为_____________
解:Mr(N2)=
Mr(H2SO4)=
Mr[Cu(OH)2]
=
Mr(CuSO4·5H2O)=
14×2
=
28
1×2+32+16×4
=
98
64+(16+1)×2
=
98
64+32+16×4+5×(1×2+16)
=
250
3×16×2=96
2、计算组成元素的质量比
:
计算:
NH4NO3中氮、氢、氧元素质量比为多少?
例:计算二氧化碳(CO2)中各元素的质量比
解:m(C):m(O)
=
12:(16×2)
=
3:8
我会做:
解:m(N):m(H):m(O)=(14×2):(1×4):(16×3)
=
7:1:12
3、计算某元素的质量分数:
若测得某种NH4HCO3样品中的含氮量为16%,判断
该物质是否纯净?
例:求氮肥NH4NO3中氮元素的质量分数
解:ω(N)=
14+1×4+14+16×3
×100%
我会做:
解:ω(N)=
=
35%
14+1×4+1+12+16×3
×100%
≈17.7%
>16%
∴该样品不是纯净的
4.掌握计算物质原子的个数比
H2O中氢原子与氧原子的个数比为多少?
C2H5OH中氢原子,氧原子,碳原子个数比为
多少?
当堂训练:
根据Fe2O3的化学式.试求:
①
氧化铁的相对分子质量?
②
铁元素与氧元素的质量比?
③
铁元素的质量分数?
④
200克氧化铁中含多少克铁元素?
课题4
化学式与化合价
(第六课时)
第四单元、自然界的水
学习目标:
1、一定质量化合物中求某元素质量
2、能看懂商品标签或说明书上所示的成分和含量
3、掌握化学式的一些变形方式的计算
计算一定质量物质中某元素的质量:
例:求60千克NH4NO3中含氮元素多少千克?
14×2
×100%
解:m(N)=
60Kg
×
元素质量
=
物质质量
×
元素质量分数
14+1×4+14+16×3
=
21Kg
答:氮元素的质量为21千克。
我会做:
1.一定质量的氧化铁(Fe2O3)中含有112克铁元素。
则氧化铁的质量为多少?
解:m(Fe2O3)=
112g÷
×100%
=160g
答:氧化铁的质量为160克。
2.多少千克的尿素[CO(NH2)2]与40千克硝酸[NH4NO3]
的含氮量相等?
解:设尿素的质量为x
X
=
40Kg×
答:尿素的质量为30克。
X=30Kg
3、某品牌矿泉水,其外包装上部分文字说明,
请回答下列问题:
(1)中偏硅酸的化学式H2SiO3,
其中硅元素的化合价是
价;
(2)“钙”是指
(填“分子”、
“原子”或“元素”);
主要成分(mg/L)
偏硅酸(H2SiO3)≥68.5
钙(Ca)≤28
钠(Na)≤18
溴(Br)≥0.089
(3)纯净优质的矿泉水属于
(填“纯净
物”
或“混合物”);
(4)此矿泉水每瓶4L,则每瓶矿泉水中含钠元素最多
是
mg
4、钙是维持人体正常功能所必须的元素,如左图所
示,
请你计算:
(1)每片中含碳酸钙的质量为多少?
(2)服用这种钙片每人每天摄入
钙元素的质量为多少?
5、某氮的氧化物中,氮、氧两种元素的质量比
为7:16,则该氧化物的的化学式为
。
6、某金属氧化物中,已知该金属元素的化合价
为+3价,金属元素与氧元素的质量比为9:8,
则该金属元素的相对原子质量为
,该
氧化物的相对分子质量为
。
7.
某铁的氧化物中,铁元素的质量分数为70%,
试确定该铁的氧化物的化学式?
8.质量相同的
SO3与SO2中氧元素的质量比____;
已知SO3与SO2中氧元素的质量相等,
SO3与SO2
的质量比_____。
知识整理:数字表示意义
①
元素符号前的数字:表示原子个数
②
化学式前面的数字:表示分子个数?
③
离子符号前面的数字:表示离子个数
④
元素符号右上角的数字:表示该离子所带的电荷数
⑤
元素符号正上方的数字:表示该元素的化合价数
⑥
化学式中元素符号右下角的数字:表示该分子所含
有的某原子个数
2Cu
:
两个铜原子
2H2O
:
两个水分子
2Na+
:
两个钠离子
Mg2+
:
一个镁离子带两个单位的正电荷
+2
Mg
:
正二价的镁元素
H2O
:
一个水分子中含有两个氢原子
化学符号中数字“2”的含义:
2H2SO4
2个硫酸分子
每个硫酸分子中
含有2个氢原子
-2
氧元素为负2价
2-
硫酸根离子带两
个单位的2电荷
写出反应文字表达式并注明物质化学式:
5.蜡烛燃烧_____________________________________
2.硫燃烧_______________________________________
3.磷燃烧_______________________________________
4.铁丝燃烧_____________________________________
1.木炭燃烧______________________________________
6.过氧化氢制取氧气___________________________________
7.高锰酸钾制取氧气___________________________________
8.氯酸钾制取氧气_____________________________________
9.氢气燃烧______________________________________
10.水电解
______________________________________
填空:
1.元素的种类是由__________________决定的
2.元素的化学性质主要由______________决定的
3.元素的化合价主要由_______________决定的
4.原子的相对原子质量主要由_______________决定的
5.原子的质量主要由__________决定的
质子数(核电荷数)
最外层电子数
最外层电子数
质子数和中子数
原子核
1
写出下列物质的化学式.
铜____
锌____
碳____
硅____
氮气____
氯气____
氩气____
2
写出下列物质的化学式.
氧化铜______
二氧化锰______
氯化钠______
二氧化氮______
硫化锌______
氯酸钾______
Cu
Zn
C
Si
N2
Cl2
Ar
CuO
MnO2
NaCl
NO2
ZnS
KClO3
自学检测:
(1)O2
__________________________
(2)2CO__________________________
(3)2Cu__________________________
(4)Mg2+__________________________
(5)2Al3+________________________________________
一个氧分子中含有2个氧原子
2个一氧化碳分子
2个铜原子
3.下列符号中数字2表示的意义是:
镁离子带2个单位的正电荷
2个铝离子
4、用化学符号表示:
①一个二氧化碳分子
________
②三个硅原子
________
③四个镁离子
________
④二氧化硫
________
⑤锌元素
________
⑥二个氟离子_______
CO2
3Si
4Mg2+
SO2
Zn
2F-
5.下列各图中
表示一个氧原子,
表示一个
氢原子。用化学符号和数字表示各图
A:_______
B:_______
C:_______
D:_______
E:_______
2O
O2
O3
2O2
2H2O
当堂训练:
1.下列只表示微观意义的是(
)
A
H2
B
H
C
2H
D
He
2.下列符号中,既能表示一种元素,又能表示一种单质,还能表示一个原子是(
)
A
N2
B
O
C
2N
D Cu
3.用化学用语表示:
氮气
_______
2个氧分子
_______
镁元素_______
5个五氧化二磷分子
_______
氖气
_______
3个碳酸根离子
_______
6个硅原子
_______
x个铜原子
_______
1个氢分子
_______
铝离子
_______
课题4
化学式与化合价
(第一课时)
第四单元、自然界的水
本节导学
化
学
式
与
化
合
价
单质化学式及意义
化合物化学式(组成)及意义
元素化合价及根化合价
化合物化学式(下标)
化学式的有关计算
学习目标:
1
知道什么是化学式?怎样书写?
2
掌握化学式所表示的意义
3
能区分化学符号周围各数字的含义
自学指导一:
快速阅读课本P83,3分钟后回答下列问题:
1、元素用________表示;物质用_______表示。
2、什么是化学式?
3、化学式怎样书写?其意义有哪些?
元素符号
化学式
化学式:
用元素符号和数字的组合来表示物质组成的
式子。(只有纯净物才有化学式,且只有一个;
但同一化学式可表示不同物质。)
如:氧气
水
二氧化碳
氯酸钾
白磷
红磷
O2
H2O
CO2
KClO3
P
P
物质
混合物
纯净物
单质
化合物(氧化物)
知识回顾:物质的简单分类
(一)单质化学式的写法、意义,读法:
氟氯溴碘氮氧氢,原子两个要记清。(O3、C60除外)
其他单质化学式,元素符号来表明。
N2
Cu
①氮气
②一个氮分子
③一个氮分子由两
个氮原子构成
①铜
②铜元素
③一个铜原子
F2、Cl2、Br2、I2、N2、O2、H2(由分子构成的单质)
C、P、Si、Fe、Cu、Ne、Ar
…(由原子构成的单质)
书写:
意义:
2N2:____________
2Cu:___________
两个氮分子
两个铜原子
气体-----------某气
固体,液体--某
气液固--------某单质
讨论:(书P83)
符号H、2H、H2、2H2、H+、2H+各具有什么意义?
H
2H
H2
2H2
H+
2H+
①氢元素
②一个氢原子
两个氢原子
①氢气
②一个氢分子
③一个氢分子由两个氢原子构成
两个氢分子
(一个)氢离子
两个氢离子
1
写出下列物质的化学式.
铜____
锌____
碳____
硅____
氮气____
氯气____
氩气____
Cu
Zn
C
Si
N2
Cl2
Ar
当堂训练1:
写出下列化学式的意义
O2_________________
__________________
__________________
2Fe_________
Fe____________
_________
__________
N_________
________________
当堂训练3:
当堂训练:
1.下列只表示微观意义的是(
)
A
H2
B
H
C
2H
D
He
2.下列符号中,既能表示一种元素,又能表示一种单质,还能表示一个原子是(
)
A
N2
B
O
C
2N
D Cu
3.用化学用语表示:
氮气
_______
2个氧分子
_______
镁元素_______
氖气
_______
课题4
化学式与化合价
(第二课时)
第四单元、自然界的水
学习目标:
1
初步掌握化合物化学式的写法
2
掌握化合物化学式的意义
3
能根据化合物的名称确定其成分
(二)化合物化学式的写法、意义:
MgO
CO2
SO2
Fe3O4
P2O5
氧在后,另一种元素在前
氧化某、
几氧化几某
读法
写法
氧化物
金属(NH4)元素与非金属
元素(或根)组成的化合物
NaCl
MgCl2
NaOH
KOH
KClO3
KMnO4
CuSO4
Na2SO4
K2CO3
Na2CO3
KNO3
NH4NO3
金前非后
某化某、
某酸某
写法
读法
氢元素与非金属
元素(或根)组成的化合物
HCl
H2CO3
HNO3
H2SO4
H前非后
某化某、
某酸
写法
读法
化学式所表示的意义:
5H2O
5个水分子
二氧化碳
二氧化碳是由碳元素
和氧元素组成的
一个二氧化碳分子
一个二氧化碳分子是
由一个碳原子和两个
氧原子构成的
1
写出下列物质的化学式.
铜____
锌____
碳____
硅____
氮气____
氯气____
氩气____
2
写出下列物质的化学式.
氧化铜______
二氧化锰______
水
__
二氧化氮______
过氧化氢______
二氧化硫___
Cu
Zn
C
Si
N2
Cl2
Ar
CuO
MnO2
H2O
NO2
H2O2
当堂训练1:
1
根据物质的名称指出下列物质所含的成分.
氯化钠
硫化锌
氯酸钾
硫酸铜
碳酸钙
氯化镁
硝酸钾
硝酸铜
氢氧化钙
氢氧化铁
碳酸氢钠
硫酸铵
氯化铵
高锰酸钾
当堂训练2:
写出下列化学式的意义
O2_________________
__________________
__________________
__________________
SO2_______________
____________________
____________________
______________________
5SO2_____________________________
2Fe_________
Fe____________
_________
__________
N_________
________________
当堂训练3:
当堂训练:
1.下列只表示微观意义的是(
)
A
H2
B
H
C
2H
D
He
2.下列符号中,既能表示一种元素,又能表示一种单质,还能表示一个原子是(
)
A
N2
B
O
C
2N
D Cu
3.用化学用语表示:
氮气
_______
2个氧分子
_______
镁元素_______
5个五氧化二磷分子
_______
氖气
_______
课题4
化学式与化合价
(第三课时)
第四单元、自然界的水
1.了解化合价的意义和有关规定,并识记常见
元素和原子团的化合价。
2.学会区分化合价和离子符号的不同表示方法。
3.掌握元素化合价、离子符号与原子的最外电
子的关系。
学习目标:
1.化合物中,化合价有正负之分:
1)氧元素通常显____价,氢元素通常显____价。
2)金属元素跟非金属元素化合时,
金属元素一般显____价,非金属元素显____价。
3)一些元素在不同物质中可显不同的化合价。
4)原子团中,元素正、负化合价代数和不等于____,
等于根价。
2.化合物中,正负化合价的代数和为____。
3.单质中,元素的化合价为____。
自学指导1:快速阅读课本P84-85,填空
-2
+1
正
负
0
0
0
二、化合价:
1、定义:
化学上用“化合价”来表示原子之间相互化
合的数目。
物质
HCl
H2O
CaCl2
P2O5
原子个数比
1∶1
2
∶
1
1
∶
2
2∶
5
2.化合价的表示方法:
H2
H2O
CO
ZnO
AlCl3
0
+1
-2
+2
+3
化合价标在元素符号的正上方,“+、-”
号写在数字的前面
3、化合价与离子符号表示方法的比较:
+1
-1
-2
+3
-2
Na
Cl
O
Al
SO4
Na+
Cl-
O2-
Al3+
SO42-
记忆方法:____________________
头顶化合价;肩扛电荷数
Cl-
元素的化合价由元素原子的最外层电子数决定
4.原子结构示意图、离子、元素化合价
的关系:
+2
Mg
Mg2+
Cl
-1
元素
元素符号
常见化合价
元素
元素符号
常见化合价
钾
K
+1
氢
H
+1
钠
Na
+1
氟
F
-1
银
Ag
+1
氯
Cl
-1、+1、+5、+7
钙
Ca
+2
溴
Br
-1
镁
Mg
+2
氧
O
-2
钡
Ba
+2
硫
S
-2、+4、+6
铜
Cu
+1、
+2
碳
C
+2、+4
铁
Fe
+2
、
+3
硅
Si
+4
铝
Al
+3
氮
N
-3、+2、+4、+5
锰
Mn
+2、+4、+6、+7
磷
P
-3、+3、+5
锌
Zn
+2
元素化合价记忆口诀
一价钾钠氯氢银
二价氧钙钡镁锌
三铝四硅五价磷
二三铁,二四碳
二四六硫都齐全
铜汞二价最常见
遇到亚字价降一
氯有变价一五七
+1
+1
-1
+1
+1
K
Na
Cl
H
Ag
-2
+2
+2
+2
+2
O
Ca
Ba
Mg
Zn
+3
+4
+5
Al
Si
P
+2
+3
+2
+4
Fe
Fe
C
C
-2
+4
+6
S
S
S
+2
+2
Cu
Hg
+2
Fe(亚铁)
-1
+1
+5
+7
Cl
Cl
Cl
Cl
如:
CaCO3;
Mg(OH)2;
NH4Cl
氢氧根
碳酸根
5.原子团:作为一个整体参加反应的原子
集团,叫做原子团,也叫做根。
铵根
概念理解:
①.原子团不是一种物质,它不能独立存在。
②.原子团中各元素的化合价的代数和不等于零,
等于原子团的化合价(根价)。
6.常见的原子团;原子团离子;原子团化合价:
SO42-
CO32-
NO3-
OH-
NH4+
MnO42-
MnO4-
ClO3-
PO43-
HCO3-
-2
SO4
-2
CO3
-1
NO3
-1
OH
+1
NH4
-3
PO4
-2
MnO4
-1
MnO4
-1
ClO3
-1
HCO3
原子团
原子团符号
原子团离子符号
原子团化合价
硫酸根
碳酸根
硝酸根
氢氧根
铵
根
磷酸根
锰酸根
高锰酸根
碳酸氢根
氯酸根
SO4
CO3
NO3
OH
NH4
PO4
MnO4
MnO4
ClO3
HCO3
常见原子团的化合价记忆口诀
负一硝酸、氢氧根
负二硫酸、碳酸根
负三记住磷酸根
只有正一是铵根
-1
-1
NO3
OH
-2
-2
SO4
CO3
-3
PO4
+1
NH4
当堂训练1
1、标出下列物质中各元素的化合价:
氮气
氯化锌
氢氧化钠
N2
ZnCl2
NaOH
+2
-1
+1
-2
+1
原则:单质中元素化合价为0
化合物中元素化合价代数和等于0
0
2、试确定氯酸钾中氯元素的化合价
【思路】
先写出化学式
KClO3
设未知数
解:设KClO3中Cl的化合价为X
列等式(正负价代数和为0)
+1+X+(-2)×3=0
解
X=
+5
+
5
4.确定下列物质中氯元素的化合价且按规律确定
X的化学式:
HCl
X
HClO
ClO2
HClO3
HClO4
3.下列物质中,氮元素的化合价最低的是(
)
A
N2
B
HNO3
C
NO2
D
NH4Cl
X
=
_____
Cl2
D
作业:
1.背诵元素化合价和原子团化合价记忆口诀:
2.默写原子团离子符号:
课题4
化学式与化合价
(第四课时)
第四单元、自然界的水
学习目标:
1.正确掌握根据化学式确定元素的化合价。
2.正确掌握根据原子团的化合价确定其中
元素的化合价。
3.正确掌握根据已知元素的化合价,确定
物质的化学式。
自学指导1:
快速阅读课本P86:
思考
根据已知化合价,怎样写化合物的化学式。
写出碳酸钠
,硫酸铜的化学式
(一)根据元素的化合价确定化学式:
例:写出+4价碳元素的氧化物的化学式:
C
O
C
O
+4
-2
+2
-1
1
2
CO2
正价先、负价后
先约简、后交叉
(1省略不写)
氧化钾______
氧化亚铁______
氧化铁______
氯化钠_______
氯化铝______
氢氧化钾______
氢氧化钙______
氢氧化铁______
碳酸钠_______
硝酸镁_______
硫酸铝_______
氯化铵______
硝酸铵_______
硫酸铵________硫酸_______
2.元素A的原子最外层有1个电子,元素B的最外层电子数
为6个。元素A、B形成化合物的化学式为________。
3.现有
H、Mg、Cl、O
四种元素,两两组合形成的化
合物的化学式为_____________________________。
K2O
AlCl3
NaCl
FeO
Fe2O3
练习1.写出下列物质的化学式:
KOH
Ca(OH)2
Fe(OH)3
Na2CO3
Mg(NO3)2
Al2(SO4)3
NH4Cl
NH4NO3
(NH4)2SO4
+1
+2
-1
-2
A2B
HCl、H2O、MgCl2、MgO
堂堂清:
1.已知元素R的化合价为+3价,下列化学式正确
的是(
)
A
RO
B
RO2
C
R2O3
D
RO3
2.写出下列物质的化学式:
铜:________
碳酸钙:_________
氩气:________
硫酸钠:_________
氮气:
_________
硝酸镁:
_________
氢氧化钡:
_______
硫酸铵:________
3.地壳中含量最多的元素与最多的金属元素组成
的化合物的化学式为___________。
D
Cu
Ar
N2
CaCO3
Na2SO4
Mg(NO3)2
(NH4)2SO4
Ba(OH)2
Al2O3
课题4
化学式与化合价
(第五课时)
第四单元、自然界的水
学习目标:
1.掌握计算物质的相对分子质量;
2.掌握计算物质组成元素的质量比,
3.掌握计算物质中某元素的质量分数。
4.掌握计算物质原子的个数比。
自学指导1:
快速阅读课本P87,8分钟后掌握下列问题:
学会计算:
1.物质的相对分子质量
2.组成物质的各元素的质量比
3.物质中某元素的质量分数
4.一定质量化合物中求某元素质量
根据化学式计算:
1.求相对分子质量(Mr)
例:计算下列相对分子质量:
N2
、
H2SO4、
Cu(OH)2、
CuSO4·5H2O
挑战自我:
3O2
的相对分子质量为_____________
解:Mr(N2)=
Mr(H2SO4)=
Mr[Cu(OH)2]
=
Mr(CuSO4·5H2O)=
14×2
=
28
1×2+32+16×4
=
98
64+(16+1)×2
=
98
64+32+16×4+5×(1×2+16)
=
250
3×16×2=96
2、计算组成元素的质量比
:
计算:
NH4NO3中氮、氢、氧元素质量比为多少?
例:计算二氧化碳(CO2)中各元素的质量比
解:m(C):m(O)
=
12:(16×2)
=
3:8
我会做:
解:m(N):m(H):m(O)=(14×2):(1×4):(16×3)
=
7:1:12
3、计算某元素的质量分数:
若测得某种NH4HCO3样品中的含氮量为16%,判断
该物质是否纯净?
例:求氮肥NH4NO3中氮元素的质量分数
解:ω(N)=
14+1×4+14+16×3
×100%
我会做:
解:ω(N)=
=
35%
14+1×4+1+12+16×3
×100%
≈17.7%
>16%
∴该样品不是纯净的
4.掌握计算物质原子的个数比
H2O中氢原子与氧原子的个数比为多少?
C2H5OH中氢原子,氧原子,碳原子个数比为
多少?
当堂训练:
根据Fe2O3的化学式.试求:
①
氧化铁的相对分子质量?
②
铁元素与氧元素的质量比?
③
铁元素的质量分数?
④
200克氧化铁中含多少克铁元素?
课题4
化学式与化合价
(第六课时)
第四单元、自然界的水
学习目标:
1、一定质量化合物中求某元素质量
2、能看懂商品标签或说明书上所示的成分和含量
3、掌握化学式的一些变形方式的计算
计算一定质量物质中某元素的质量:
例:求60千克NH4NO3中含氮元素多少千克?
14×2
×100%
解:m(N)=
60Kg
×
元素质量
=
物质质量
×
元素质量分数
14+1×4+14+16×3
=
21Kg
答:氮元素的质量为21千克。
我会做:
1.一定质量的氧化铁(Fe2O3)中含有112克铁元素。
则氧化铁的质量为多少?
解:m(Fe2O3)=
112g÷
×100%
=160g
答:氧化铁的质量为160克。
2.多少千克的尿素[CO(NH2)2]与40千克硝酸[NH4NO3]
的含氮量相等?
解:设尿素的质量为x
X
=
40Kg×
答:尿素的质量为30克。
X=30Kg
3、某品牌矿泉水,其外包装上部分文字说明,
请回答下列问题:
(1)中偏硅酸的化学式H2SiO3,
其中硅元素的化合价是
价;
(2)“钙”是指
(填“分子”、
“原子”或“元素”);
主要成分(mg/L)
偏硅酸(H2SiO3)≥68.5
钙(Ca)≤28
钠(Na)≤18
溴(Br)≥0.089
(3)纯净优质的矿泉水属于
(填“纯净
物”
或“混合物”);
(4)此矿泉水每瓶4L,则每瓶矿泉水中含钠元素最多
是
mg
4、钙是维持人体正常功能所必须的元素,如左图所
示,
请你计算:
(1)每片中含碳酸钙的质量为多少?
(2)服用这种钙片每人每天摄入
钙元素的质量为多少?
5、某氮的氧化物中,氮、氧两种元素的质量比
为7:16,则该氧化物的的化学式为
。
6、某金属氧化物中,已知该金属元素的化合价
为+3价,金属元素与氧元素的质量比为9:8,
则该金属元素的相对原子质量为
,该
氧化物的相对分子质量为
。
7.
某铁的氧化物中,铁元素的质量分数为70%,
试确定该铁的氧化物的化学式?
8.质量相同的
SO3与SO2中氧元素的质量比____;
已知SO3与SO2中氧元素的质量相等,
SO3与SO2
的质量比_____。
知识整理:数字表示意义
①
元素符号前的数字:表示原子个数
②
化学式前面的数字:表示分子个数?
③
离子符号前面的数字:表示离子个数
④
元素符号右上角的数字:表示该离子所带的电荷数
⑤
元素符号正上方的数字:表示该元素的化合价数
⑥
化学式中元素符号右下角的数字:表示该分子所含
有的某原子个数
2Cu
:
两个铜原子
2H2O
:
两个水分子
2Na+
:
两个钠离子
Mg2+
:
一个镁离子带两个单位的正电荷
+2
Mg
:
正二价的镁元素
H2O
:
一个水分子中含有两个氢原子
化学符号中数字“2”的含义:
2H2SO4
2个硫酸分子
每个硫酸分子中
含有2个氢原子
-2
氧元素为负2价
2-
硫酸根离子带两
个单位的2电荷
写出反应文字表达式并注明物质化学式:
5.蜡烛燃烧_____________________________________
2.硫燃烧_______________________________________
3.磷燃烧_______________________________________
4.铁丝燃烧_____________________________________
1.木炭燃烧______________________________________
6.过氧化氢制取氧气___________________________________
7.高锰酸钾制取氧气___________________________________
8.氯酸钾制取氧气_____________________________________
9.氢气燃烧______________________________________
10.水电解
______________________________________
填空:
1.元素的种类是由__________________决定的
2.元素的化学性质主要由______________决定的
3.元素的化合价主要由_______________决定的
4.原子的相对原子质量主要由_______________决定的
5.原子的质量主要由__________决定的
质子数(核电荷数)
最外层电子数
最外层电子数
质子数和中子数
原子核
1
写出下列物质的化学式.
铜____
锌____
碳____
硅____
氮气____
氯气____
氩气____
2
写出下列物质的化学式.
氧化铜______
二氧化锰______
氯化钠______
二氧化氮______
硫化锌______
氯酸钾______
Cu
Zn
C
Si
N2
Cl2
Ar
CuO
MnO2
NaCl
NO2
ZnS
KClO3
自学检测:
(1)O2
__________________________
(2)2CO__________________________
(3)2Cu__________________________
(4)Mg2+__________________________
(5)2Al3+________________________________________
一个氧分子中含有2个氧原子
2个一氧化碳分子
2个铜原子
3.下列符号中数字2表示的意义是:
镁离子带2个单位的正电荷
2个铝离子
4、用化学符号表示:
①一个二氧化碳分子
________
②三个硅原子
________
③四个镁离子
________
④二氧化硫
________
⑤锌元素
________
⑥二个氟离子_______
CO2
3Si
4Mg2+
SO2
Zn
2F-
5.下列各图中
表示一个氧原子,
表示一个
氢原子。用化学符号和数字表示各图
A:_______
B:_______
C:_______
D:_______
E:_______
2O
O2
O3
2O2
2H2O
当堂训练:
1.下列只表示微观意义的是(
)
A
H2
B
H
C
2H
D
He
2.下列符号中,既能表示一种元素,又能表示一种单质,还能表示一个原子是(
)
A
N2
B
O
C
2N
D Cu
3.用化学用语表示:
氮气
_______
2个氧分子
_______
镁元素_______
5个五氧化二磷分子
_______
氖气
_______
3个碳酸根离子
_______
6个硅原子
_______
x个铜原子
_______
1个氢分子
_______
铝离子
_______
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
