九年级化学 第五单元化学方程式 课题1 质量守恒定律(共32张ppt)
文档属性
| 名称 | 九年级化学 第五单元化学方程式 课题1 质量守恒定律(共32张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 973.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-22 16:57:24 | ||
图片预览









文档简介
(共32张PPT)
第五单元
化学方程式
课题1
质量守恒定律
(第一课时)
学习目标:
1.通过实验探究质量守恒定律;
2.能用质量守恒定律解释常见化学反
应中的质量关系。
自学指导一:
快速阅读课本92-93页:
记住质量守恒定律的内容
一、质量守恒定律:
在化学反应中,参加反应的各物质的质量总和,等于反应后生成的各物质质量的总和。
1.定义:
1.
6克C与足量的O2完全反应生成22克CO2,其中参加反
应的O2的质量为(
)
A
6g
B
16g
C
22g
D
28g
2.在A+B=C+D中,A和B的混合物1.6克恰好完全反应,
生成C和D的足量比为3:5,则D为(
)
A
0.3g
B
0.6g
C
1.0g
D
1.6g
3.将A、B、C各10克的混合物加热后,完全反应后
B
为8克,
C为18克,
D为4克。则在反应中A和B的
足量比为(
)
A
5:1
B
1:5
C
4:1
D
1:4
自学检测1:
2,判断下列说法是否正确?
⑴水冷却结成冰,总质量没有改变,由此说明:此变化符合质量守恒定律。(
)
⑵化学反应中,反应物的分子数等于生成物的分子数。(
)
⑶二氧化锰在氯酸钾分解反应前后质量不变,是遵循质量守恒定律的。(
)
(4)氯酸钾受热分解后,剩余固体比原反应物轻,这不符合质量守恒定律
。
(
)
×
×
×
×
一、质量守恒定律:
在化学反应中,参加反应的各物质的质量总和,等于反应后生成的各物质质量的总和。
2.注意事项:
①只用于化学变化,物理变化不适用。
②研究的对象是质量,不是体积,分子数目等。
③“参加反应的各物质的质量总和”,应理解为真实参加反应的物质的质量相加。没有反应的多余物质的质量不应计算在内。
1.定义
讨论与交流
已知氢气和氧气反应生成水,且反应的质量比为1:8。现有2克氢气和20克氧气混合反应,生成的水的质量是22克吗?
m1
m2
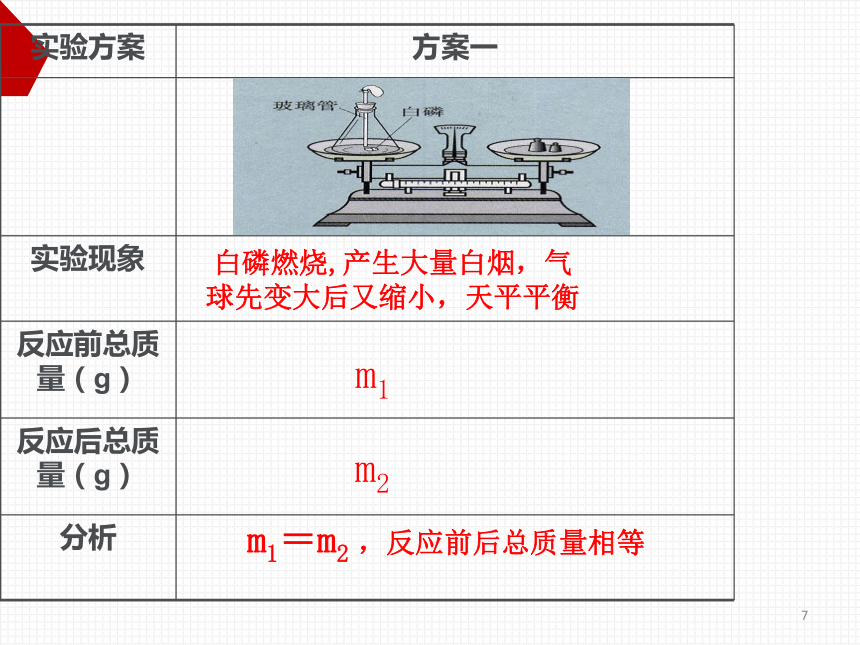
m1=m2
,反应前后总质量相等
白磷燃烧,产生大量白烟,气
球先变大后又缩小,天平平衡
实验方案
方案一
实验现象
反应前总质量(g)
反应后总质量(g)
分析
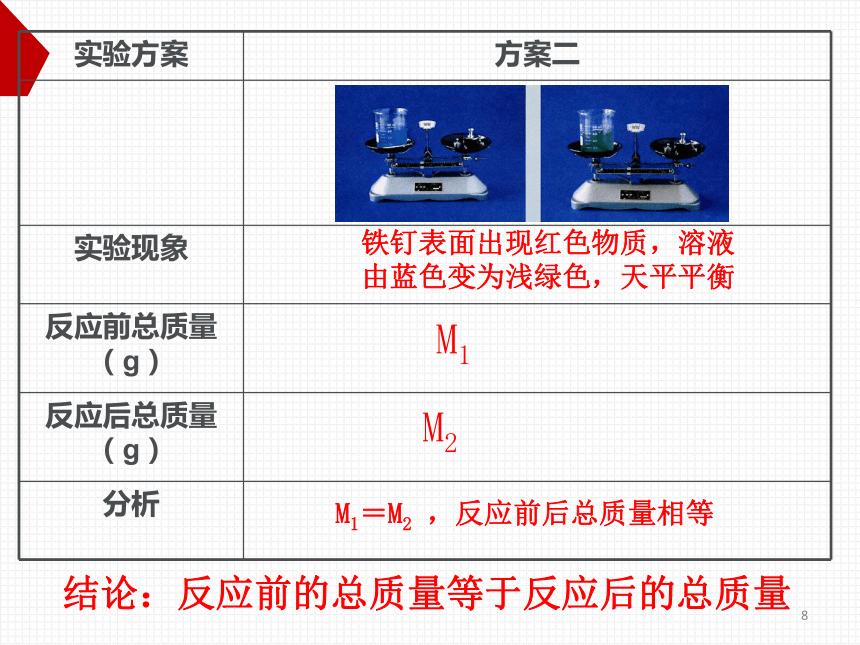
铁钉表面出现红色物质,溶液
由蓝色变为浅绿色,天平平衡
M1
M2
M1=M2
,反应前后总质量相等
结论:反应前的总质量等于反应后的总质量
实验方案
方案二
实验现象
反应前总质量(g)
反应后总质量(g)
分析
思考:
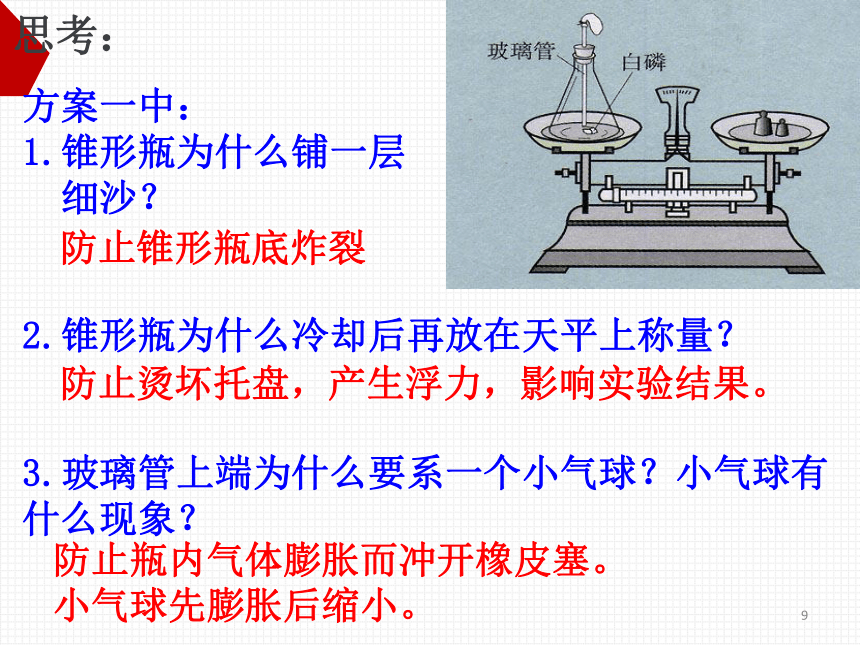
方案一中:
1.锥形瓶为什么铺一层
细沙?
2.锥形瓶为什么冷却后再放在天平上称量?
3.玻璃管上端为什么要系一个小气球?小气球有什么现象?
防止锥形瓶底炸裂
防止烫坏托盘,产生浮力,影响实验结果。
防止瓶内气体膨胀而冲开橡皮塞。
小气球先膨胀后缩小。
2.A+B=C+D,
已知12gA和18gB恰好完全反应生成28gC,
则生成的D的质量是(
)
A、30g
B、58g
C、2g
D、无法确定
C
1.氯酸钾m克和二氧化锰n克共热后完全分解,剩余固体为a克。①
二氧化锰在这个反应中是(
)
A.反应物
B.生成物
C.氧化剂
D.催化剂
②反应后的剩余固体中,氯化钾的质量为(
)
A.(m+n-a)g
B.(a-m)g
C.(m-n)g
D.(a-n)g
③产生氧气的质量为(
)
A.(m+n-a)g
B.(m-a)g
C.(m-n)g
D.(n-a)g
D
D
A
堂堂清:
第五单元
化学方程式
课题1
质量守恒定律
(第二课时)
学习目标:
1.能用微粒的观点说明质量守恒的本
质原因;
2.复习化学变化的微观实质。
阅读课本94-95页:
1,思考化学变化的微观实质。
2,质量守恒的原因是什么?
自学指导一:
+
2H2O
O2
2H2
+
一,化学变化的微观实质:
4个水分子
在通电条件下,
生成
种原子,分别为:
个氢原子、、
个氧原子
;这些原子
,生成
个氢分子
、
个氧分子
。
2
8
4
重新组合
4
2
讨论与交流
在一切化学反应中,有哪些量不变化?哪些量变化?哪些量可能会变化?
①原子种类没有改变
②原子数目没有增减
③原子质量没有变化
⑤元素质量不变
⑥物质总质量不变
④元素种类不变
微观
宏观
化学变化中的“变”与“不变”(6、2、1)
一.
一定不变(6个):
二.
一定变(2个):
①分子种类
②物质种类
三.
可能变(1个):
分子个数
二,质量守恒的原因:
在一切化学反应中:
反应前后的_______没有改变,________没有增减,_______也没有变化。所以一切化学反应都遵循质量守恒定律。
原子数目
原子质量
原子种类
阅读课本94-95页,5分钟后回答:
实验5-1,5-2是否满足质量守恒定律?为什么?
自学指导二:
三,质量守恒定律的应用
2.实验现象:_______________________________
固体粉末溶解,有大量的气泡产生;
生成的气体逸散到了空气中。
1.反应:
天平指针向右偏转(变轻)
__________________________
实验5-1:
m(Na2CO3)+m(HCl)=m(NaCl)+
m(CO2
)+
m(H2O)
2.实验现象:
发出耀眼的白光、放出热量,生成白色固体。
1.反应:
实验5-2:
天平指针向左偏转(变重)
m(Mg)
+
m(O2)=======m(MgO)
氧元素进入了生成物
若用有气体参加或有气体生成的化学反应来验证质量守恒定律,则反应一定要在___________中进行。
密闭容器
当堂训练1:1,用质量守恒定律解释
(1
)细铁丝在氧气中燃烧后,生成物的质量比细铁丝的质量大。
(2)加热氯酸钾与二氧化锰的混合物,剩余的固体质量减少了。
根据质量守恒定律,m(Fe)+m(o2)=m(Fe3O4)
氧元素进入了生成物
根据质量守恒定律,m(KClO3)=m(KCl)+m(O2)
生成的气体逸散到了空气中。
1、下列现象不能用质量守恒定律解释的是(
)
A、蜡烛燃烧时慢慢变短
B、白磷在密闭容器中燃烧质量不变
C、铁钉生锈后质量增加
D、水结冰质量不变
D
2、某物质在氧气中燃烧后生成二氧化碳和水,该化合物中一定含
元素。
3、质量守恒的原因是什么?
碳、氢
化学反应前后,原子的
____、____、____都没有改变
数目
种类
质量
当堂训练2:
4
某化合物3.2g完全燃烧需要氧气,同时生成4.4g二氧化碳和3.6g水,则该化合物中一定含
元素。
第五单元
化学方程式
课题1
质量守恒定律
(第三课时)
1.知道什么是化学方程式;
2.了解从化学方程式能获得的信息;
3.掌握化学方程式的读法。
学习目标:
阅读课本96-97页,完成下列问题:
1.什么是化学方程式?
2.从化学方程式能获得哪些信息?
3.化学方程式的读法
自学指导:
一.化学方程式:
如:磷的燃烧
反应文字表达式:___________________________
组成元素符号:____
_____
________
P
O
P、O
O2
P2O5
P
化学方程式:__________________________
化学式:____
_____
________
1.定义:________________________________
用化学式来表示化学反应的式子。
2.化学方程式的读法(意义):
(1)宏观读法(反应物,生成物,反应条件):
磷和氧气在点燃条件下生成五氧化二磷。
(2)宏观读法(反应物生成物的质量关系)
每124份质量的磷与160份质量的氧气在点燃的条件下生成284份质量的五氧化二磷。
(3)微观读法:
每4个磷原子与5个氧分子在点燃的条件下生成2个五氧化二磷分子。
例如:
⑴.反应物、生成物和反应条件;
(3).各微粒间的个数比;
(2).各物质间的质量比。
碳原子
氧分子
二氧化碳分子按1
:
1
:
1的个数比进行反应
碳
氧气
二氧化碳按12:32:44的质量比进行反应
反应物是碳和氧气,生成物是二氧化碳;
反应条件是点燃
3.从化学方程式获得的信息:
1、碳和氧气在点燃的条件下生成二氧化碳
;
2、每1个碳原子和1个氧分子在点燃的条件下生成1
个二氧化碳分子;
3、每12份质量的碳和32份质量的氧气在点燃的条
件下生成44份质量的二氧化碳。
练一练:读出下列化学方程式
C
+
O2
CO2
12
32
44
练一练:计算相对质量和原子个数
C
+
O2
CO2
12
32
44
小结:左右两边每一种原子的个数相等,反应物的相对质量之和等于生成物的相对质量之和。原因:化学反应遵守质量守恒定律。
1.根据反应方程式:R
+
O2
→
CO2
+
H2O中,R中一定不含有的元素是(
)
A.
O
B.
C
C.
S
D.
H
2.在化学反应
x
+
3O2
=
2CO2
+
3H2O
中。X的化学式为(
)
A.CH3OH
B.C2H5OH
C.C2H6
D.CH4
3.
在化学反应方程式4Al+3O2
2Al2O3中,
_____份质量铝和_____份质量的氧气反应生成
_______份质量的氧化铝。
堂堂清:
C
B
108
96
204
第五单元
化学方程式
课题1
质量守恒定律
(第一课时)
学习目标:
1.通过实验探究质量守恒定律;
2.能用质量守恒定律解释常见化学反
应中的质量关系。
自学指导一:
快速阅读课本92-93页:
记住质量守恒定律的内容
一、质量守恒定律:
在化学反应中,参加反应的各物质的质量总和,等于反应后生成的各物质质量的总和。
1.定义:
1.
6克C与足量的O2完全反应生成22克CO2,其中参加反
应的O2的质量为(
)
A
6g
B
16g
C
22g
D
28g
2.在A+B=C+D中,A和B的混合物1.6克恰好完全反应,
生成C和D的足量比为3:5,则D为(
)
A
0.3g
B
0.6g
C
1.0g
D
1.6g
3.将A、B、C各10克的混合物加热后,完全反应后
B
为8克,
C为18克,
D为4克。则在反应中A和B的
足量比为(
)
A
5:1
B
1:5
C
4:1
D
1:4
自学检测1:
2,判断下列说法是否正确?
⑴水冷却结成冰,总质量没有改变,由此说明:此变化符合质量守恒定律。(
)
⑵化学反应中,反应物的分子数等于生成物的分子数。(
)
⑶二氧化锰在氯酸钾分解反应前后质量不变,是遵循质量守恒定律的。(
)
(4)氯酸钾受热分解后,剩余固体比原反应物轻,这不符合质量守恒定律
。
(
)
×
×
×
×
一、质量守恒定律:
在化学反应中,参加反应的各物质的质量总和,等于反应后生成的各物质质量的总和。
2.注意事项:
①只用于化学变化,物理变化不适用。
②研究的对象是质量,不是体积,分子数目等。
③“参加反应的各物质的质量总和”,应理解为真实参加反应的物质的质量相加。没有反应的多余物质的质量不应计算在内。
1.定义
讨论与交流
已知氢气和氧气反应生成水,且反应的质量比为1:8。现有2克氢气和20克氧气混合反应,生成的水的质量是22克吗?
m1
m2
m1=m2
,反应前后总质量相等
白磷燃烧,产生大量白烟,气
球先变大后又缩小,天平平衡
实验方案
方案一
实验现象
反应前总质量(g)
反应后总质量(g)
分析
铁钉表面出现红色物质,溶液
由蓝色变为浅绿色,天平平衡
M1
M2
M1=M2
,反应前后总质量相等
结论:反应前的总质量等于反应后的总质量
实验方案
方案二
实验现象
反应前总质量(g)
反应后总质量(g)
分析
思考:
方案一中:
1.锥形瓶为什么铺一层
细沙?
2.锥形瓶为什么冷却后再放在天平上称量?
3.玻璃管上端为什么要系一个小气球?小气球有什么现象?
防止锥形瓶底炸裂
防止烫坏托盘,产生浮力,影响实验结果。
防止瓶内气体膨胀而冲开橡皮塞。
小气球先膨胀后缩小。
2.A+B=C+D,
已知12gA和18gB恰好完全反应生成28gC,
则生成的D的质量是(
)
A、30g
B、58g
C、2g
D、无法确定
C
1.氯酸钾m克和二氧化锰n克共热后完全分解,剩余固体为a克。①
二氧化锰在这个反应中是(
)
A.反应物
B.生成物
C.氧化剂
D.催化剂
②反应后的剩余固体中,氯化钾的质量为(
)
A.(m+n-a)g
B.(a-m)g
C.(m-n)g
D.(a-n)g
③产生氧气的质量为(
)
A.(m+n-a)g
B.(m-a)g
C.(m-n)g
D.(n-a)g
D
D
A
堂堂清:
第五单元
化学方程式
课题1
质量守恒定律
(第二课时)
学习目标:
1.能用微粒的观点说明质量守恒的本
质原因;
2.复习化学变化的微观实质。
阅读课本94-95页:
1,思考化学变化的微观实质。
2,质量守恒的原因是什么?
自学指导一:
+
2H2O
O2
2H2
+
一,化学变化的微观实质:
4个水分子
在通电条件下,
生成
种原子,分别为:
个氢原子、、
个氧原子
;这些原子
,生成
个氢分子
、
个氧分子
。
2
8
4
重新组合
4
2
讨论与交流
在一切化学反应中,有哪些量不变化?哪些量变化?哪些量可能会变化?
①原子种类没有改变
②原子数目没有增减
③原子质量没有变化
⑤元素质量不变
⑥物质总质量不变
④元素种类不变
微观
宏观
化学变化中的“变”与“不变”(6、2、1)
一.
一定不变(6个):
二.
一定变(2个):
①分子种类
②物质种类
三.
可能变(1个):
分子个数
二,质量守恒的原因:
在一切化学反应中:
反应前后的_______没有改变,________没有增减,_______也没有变化。所以一切化学反应都遵循质量守恒定律。
原子数目
原子质量
原子种类
阅读课本94-95页,5分钟后回答:
实验5-1,5-2是否满足质量守恒定律?为什么?
自学指导二:
三,质量守恒定律的应用
2.实验现象:_______________________________
固体粉末溶解,有大量的气泡产生;
生成的气体逸散到了空气中。
1.反应:
天平指针向右偏转(变轻)
__________________________
实验5-1:
m(Na2CO3)+m(HCl)=m(NaCl)+
m(CO2
)+
m(H2O)
2.实验现象:
发出耀眼的白光、放出热量,生成白色固体。
1.反应:
实验5-2:
天平指针向左偏转(变重)
m(Mg)
+
m(O2)=======m(MgO)
氧元素进入了生成物
若用有气体参加或有气体生成的化学反应来验证质量守恒定律,则反应一定要在___________中进行。
密闭容器
当堂训练1:1,用质量守恒定律解释
(1
)细铁丝在氧气中燃烧后,生成物的质量比细铁丝的质量大。
(2)加热氯酸钾与二氧化锰的混合物,剩余的固体质量减少了。
根据质量守恒定律,m(Fe)+m(o2)=m(Fe3O4)
氧元素进入了生成物
根据质量守恒定律,m(KClO3)=m(KCl)+m(O2)
生成的气体逸散到了空气中。
1、下列现象不能用质量守恒定律解释的是(
)
A、蜡烛燃烧时慢慢变短
B、白磷在密闭容器中燃烧质量不变
C、铁钉生锈后质量增加
D、水结冰质量不变
D
2、某物质在氧气中燃烧后生成二氧化碳和水,该化合物中一定含
元素。
3、质量守恒的原因是什么?
碳、氢
化学反应前后,原子的
____、____、____都没有改变
数目
种类
质量
当堂训练2:
4
某化合物3.2g完全燃烧需要氧气,同时生成4.4g二氧化碳和3.6g水,则该化合物中一定含
元素。
第五单元
化学方程式
课题1
质量守恒定律
(第三课时)
1.知道什么是化学方程式;
2.了解从化学方程式能获得的信息;
3.掌握化学方程式的读法。
学习目标:
阅读课本96-97页,完成下列问题:
1.什么是化学方程式?
2.从化学方程式能获得哪些信息?
3.化学方程式的读法
自学指导:
一.化学方程式:
如:磷的燃烧
反应文字表达式:___________________________
组成元素符号:____
_____
________
P
O
P、O
O2
P2O5
P
化学方程式:__________________________
化学式:____
_____
________
1.定义:________________________________
用化学式来表示化学反应的式子。
2.化学方程式的读法(意义):
(1)宏观读法(反应物,生成物,反应条件):
磷和氧气在点燃条件下生成五氧化二磷。
(2)宏观读法(反应物生成物的质量关系)
每124份质量的磷与160份质量的氧气在点燃的条件下生成284份质量的五氧化二磷。
(3)微观读法:
每4个磷原子与5个氧分子在点燃的条件下生成2个五氧化二磷分子。
例如:
⑴.反应物、生成物和反应条件;
(3).各微粒间的个数比;
(2).各物质间的质量比。
碳原子
氧分子
二氧化碳分子按1
:
1
:
1的个数比进行反应
碳
氧气
二氧化碳按12:32:44的质量比进行反应
反应物是碳和氧气,生成物是二氧化碳;
反应条件是点燃
3.从化学方程式获得的信息:
1、碳和氧气在点燃的条件下生成二氧化碳
;
2、每1个碳原子和1个氧分子在点燃的条件下生成1
个二氧化碳分子;
3、每12份质量的碳和32份质量的氧气在点燃的条
件下生成44份质量的二氧化碳。
练一练:读出下列化学方程式
C
+
O2
CO2
12
32
44
练一练:计算相对质量和原子个数
C
+
O2
CO2
12
32
44
小结:左右两边每一种原子的个数相等,反应物的相对质量之和等于生成物的相对质量之和。原因:化学反应遵守质量守恒定律。
1.根据反应方程式:R
+
O2
→
CO2
+
H2O中,R中一定不含有的元素是(
)
A.
O
B.
C
C.
S
D.
H
2.在化学反应
x
+
3O2
=
2CO2
+
3H2O
中。X的化学式为(
)
A.CH3OH
B.C2H5OH
C.C2H6
D.CH4
3.
在化学反应方程式4Al+3O2
2Al2O3中,
_____份质量铝和_____份质量的氧气反应生成
_______份质量的氧化铝。
堂堂清:
C
B
108
96
204
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
