九年级化学 第五单元 化学方程式 课题3 利用化学方程式的简单计算(共26张PPT)
文档属性
| 名称 | 九年级化学 第五单元 化学方程式 课题3 利用化学方程式的简单计算(共26张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 758.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-22 17:01:15 | ||
图片预览






文档简介
(共26张PPT)
课题3
利用化学方程式的简单计算
(第一课时)
第五单元
化学方程式
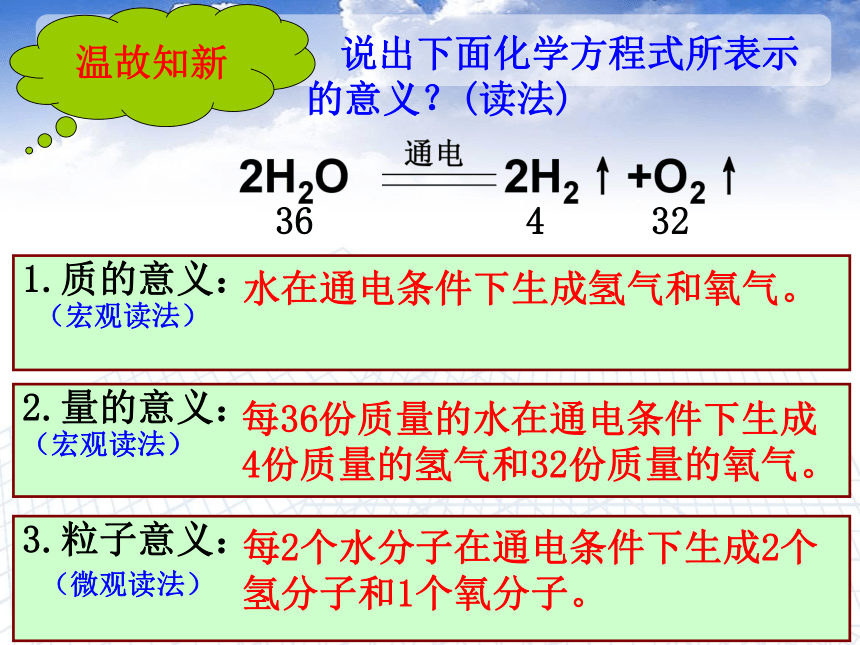
温故知新
说出下面化学方程式所表示
的意义?(读法)
36
4
32
1.质的意义:
(宏观读法)
2.量的意义:
(宏观读法)
3.粒子意义:
(微观读法)
水在通电条件下生成氢气和氧气。
每36份质量的水在通电条件下生成
4份质量的氢气和32份质量的氧气。
每2个水分子在通电条件下生成2个
氢分子和1个氧分子。
1、正确书写化学方程式的基础上会进行简单
的计算。
2、掌握化学方程式计算的解题的格式。
学习重点:
规范解题的格式。
学习目标:
自学指导:
阅读课本102页
时间5分钟,要求仔细观察化学方程式计算的格式。包括设、
数据排列
、比例式、结果的单位、
答等。然后完成自学检测1
2.
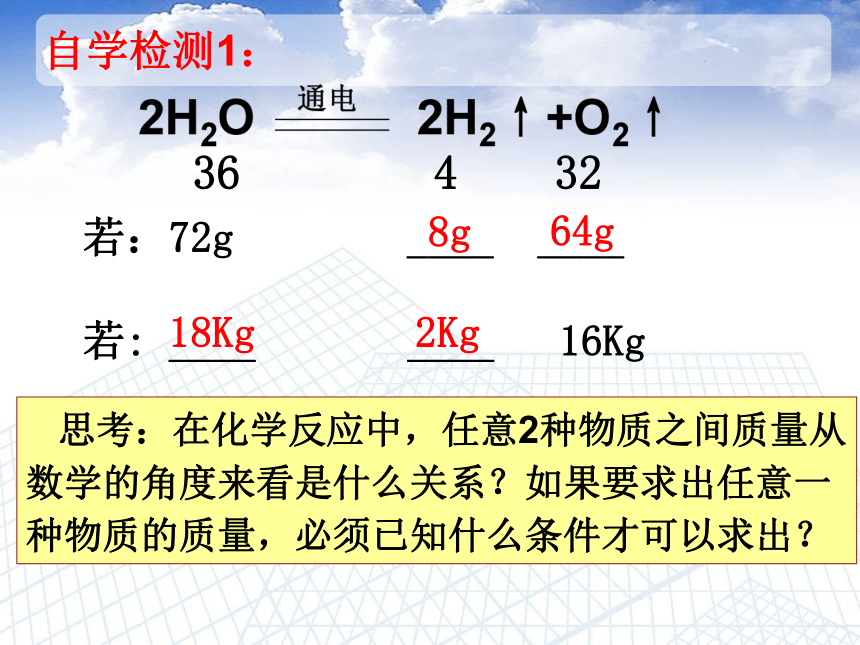
36
4
32
若:72g
____
____
若:
____
____
16Kg
8g
64g
2Kg
18Kg
思考:在化学反应中,任意2种物质之间质量从数学的角度来看是什么关系?如果要求出任意一种物质的质量,必须已知什么条件才可以求出?
自学检测1:
自学检测2:(并归纳步骤)
1.完全燃烧24克镁条,产生多少克氧化镁?
解:设产生氧化镁的质量为x
X=
40g
答:产生40克氧化镁
①
设(不带单位)
②
写(注意检查
是否配平)
③摆质量(算第一排的数
时,要乘以计量系数)
④
列、解(带单位
运算,结果有单位)
⑤
答
温馨提示
1、设未知量一般不要带单位。
2、已知量及结果要带单位且要一样。
3、列比例式方向要一致。
4、别忘了答。
根据化学方程式计算易忽略情况:
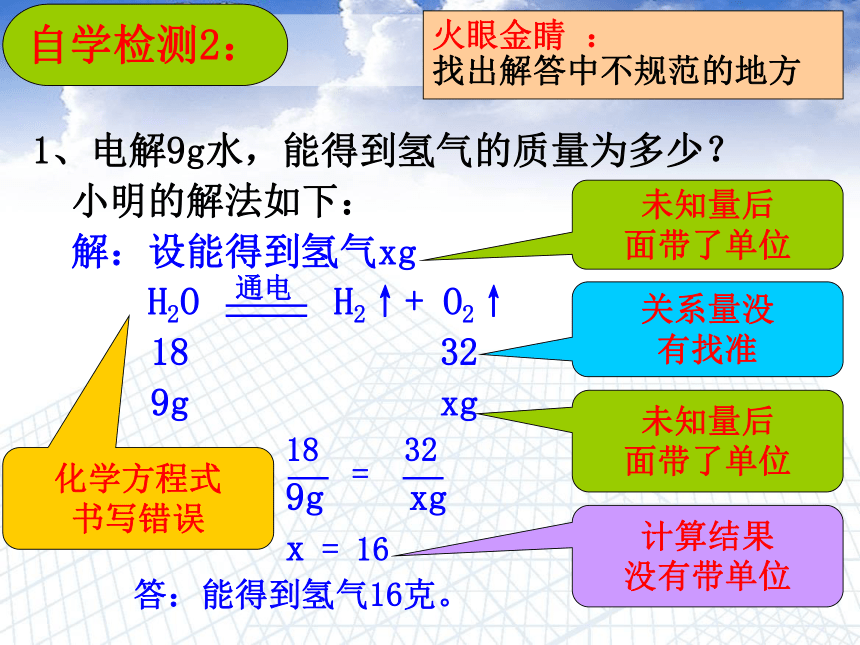
自学检测2:
1、电解9g水,能得到氢气的质量为多少?
小明的解法如下:
解:设能得到氢气xg
H2O
H2↑+
O2↑
18
32
9g
xg
18
32
9g
xg
x
=
16
答:能得到氢气16克。
=
火眼金睛
:
找出解答中不规范的地方
关系量没
有找准
未知量后
面带了单位
计算结果
没有带单位
未知量后
面带了单位
化学方程式
书写错误
2.氢气在氯气中燃烧生成氯化氢气体,计算燃烧100g氢气需要氯气的质量是多少?生成氯化氢气体的质量是少?
解:设需要氯气的质量为x
、生成氯化氢的质量为y:
2
71
73
100g
x
x=3550g
答:燃烧100g氢气需要氯气3550g,生成氯化氢
气体3650g
y
y=3650g
堂堂清:
1.实验室用49克氯酸钾制取氧气,则最多可得到多少克氧气?
2.食盐是一种重要的化工原料。利用食盐可以来制取氢氧化钠、氢气和氯气等,化学反应方程式为:2NaCl
+
2H2O
=
Cl2↑
+
H2↑+
2NaOH
若每天生产氯气71kg,问:
(1)需要氯化钠固体多少千克?
(2)同时能生产氢氧化钠多少千克?
课题3
利用化学方程式的简单计算
(第二课时)
第五单元
化学方程式
学习目标
掌握利用化学方程式计算的几种类型
一.质量守恒计算:
例:把干燥、纯净的KClO3和MnO2的混合物15.5克装入大试管中。
加热制取O2,待完全反应后,将大试管冷却,称量,得到10.7克固体物质。计算:
(1)制得O2多少克?
(2)10.7克固体物质中含有哪些物质?各多少克?
解:(1)O2的质量为:15.5g
-
10.7g
=
4.8g
(2)设生成KCl的质量为x
149
96
X
4.8g
X
=
7.45g
m(MnO2)=10.7g–7.45g=3.25g
答:剩余固体中氯化钾7.45克,二氧化锰为3.25克
自学检测1:
把13.5克干燥的氯酸钾和二氧化锰的混合物加热至完全反应,冷却后称量,剩余固体为8.7克,则原混合物中二氧化锰的质量为多少?
例:将2克H2在20克O2中充分燃烧,生成了多少克H2O?
解:设生成水的质量为x
2H2
+
O2
2H2O
4
32
36
2g
20g
X
(经分析:20g氧气过量)
x
36
4
2g
=
点燃
x
=
18g
答:生成了18克水。
二.过量计算:
例题:将8g硫与不同质量的氧气反应,试将生成
二氧化硫的质量填入下表:
①这题涉及的化学方程式__________________.
②这个化学方程式中各物质参加的质量比为_________.
③当第一次8g硫与4g氧气反应时,为什么不能生成
12g二氧化硫?
④从第二次以后,当不断增加氧气的质量,生成的二氧
化硫质量能否增加?为什么?
8
16
16
1:1:2
硫的质量/g
氧气的质量/g
生成二氧化硫的质量/g
8
4
8
8
8
12
1.将6克得木炭放入20克氧气中充分燃烧后,生成多少克二氧化碳气体?
堂堂清:
课题3
利用化学方程式的简单计算
(第三课时)
第五单元
化学方程式
三.表格数据分析计算:
例:化学兴趣小组同学将12.4克红磷分成四等分,分
别放入给定的氧气中充分燃烧,实验数据如下:
试回答:
(1)根据上述数据,实验中第____次恰好完全反应。
(2)表中的m
=
______。
(3)第____份实验中,红磷有剩余。剩余_____克
二
7.1g
一
1.55
将6g镁分别在一定量氧气中燃烧,有如下数据:
自学检测2
①这些反应中涉及的化学方程式为_________________。
②第
次镁与氧气恰好完全反应
③第
次反应镁有剩余,剩余
g。
④第
次反应氧气有剩余,剩余___g。
⑤这三次实验第___________次符合质量守恒定律。
2
1
3
3
4
1、2、3
第1次
第2次
第3次
所给氧气的质量/g
2
4
8
生成氧化镁的质量/g
5
10
10
4.某校兴趣小组在实验室完成制取O2的实验,他
们取氯酸钾和二氧化锰的混合物固体3克放入
大试管中加热,并在不同的时刻测得剩余固体
的质量如下表:
根据表格数据计算:
⑴完全反应后,产生氧气的质量为____克。
⑵原混合物中氯酸钾的质量分数为多少?
反应时间/min
1.0
1.5
2.0
2.5
3.0
剩余固体质量/g
2.55
2.25
2.10
2.04
2.04
四.质量分数(纯度)计算:
例:在80吨赤铁矿(主要成分是Fe2O3)中测得
Fe2O3的质量为64吨,则该赤铁矿的纯度为
多少?
5.有一种含有水的过氧化氢样品10g,在二氧化锰的催化作用下,完全分解得到了3.2g氧气,求该样品中过氧化氢的质量分数?
解:设该样品中过氧化氢的质量为X
2H2O2
2H2O
+O2
MnO2
68
32
X
3.2g
X=6.8g
该样品中过氧化氢的质量分数为:
10g
×100%=68%
答:该样品中过氧化氢的质量分数为68%
1.在反应A
+
3B
=
2C中,若28克的A和6克的B恰好完全反应。若要生成17克C,则参加反应的B的质量为________.
2.在反应A+3B=2C+2D中,A和B的相对分子质量之比为9:11。已知1.8gA与一定量B恰好完全反应,生成5.1gD,则在此反应中B和C的质量比为________.
3.将m克硫在n克氧气中完全燃烧,生成二氧化硫的质量为
(
)
A
小于m+n克
B大于m+n克
C不大于m+n克
D等于m+n克
4.⑴某物质在氧气中燃烧后只生成二氧化碳和水,判断该化合物中一定含有____元素,可能含有____元素;
(2)某物质在128克氧气中燃烧后只生成88克二氧化碳和72克水,判断该化合物中一定含有____元素;
(3)某4.6克化合物在氧气中燃烧后只生成8.8克二氧化碳和5.4克水,该化合物的化学式为________
.
1.已知含杂质20%的大理石(含CaCO3)250吨,在充
分灼烧够得到生石灰CaO多少吨?
(CaCO3
CaO
+
CO2↑)
2.把150克氯酸钾在一定的条件下,加热一段时间后生
成了48克氧气,求:氯酸钾的分解率?
堂堂清:
高温
课题3
利用化学方程式的简单计算
(第一课时)
第五单元
化学方程式
温故知新
说出下面化学方程式所表示
的意义?(读法)
36
4
32
1.质的意义:
(宏观读法)
2.量的意义:
(宏观读法)
3.粒子意义:
(微观读法)
水在通电条件下生成氢气和氧气。
每36份质量的水在通电条件下生成
4份质量的氢气和32份质量的氧气。
每2个水分子在通电条件下生成2个
氢分子和1个氧分子。
1、正确书写化学方程式的基础上会进行简单
的计算。
2、掌握化学方程式计算的解题的格式。
学习重点:
规范解题的格式。
学习目标:
自学指导:
阅读课本102页
时间5分钟,要求仔细观察化学方程式计算的格式。包括设、
数据排列
、比例式、结果的单位、
答等。然后完成自学检测1
2.
36
4
32
若:72g
____
____
若:
____
____
16Kg
8g
64g
2Kg
18Kg
思考:在化学反应中,任意2种物质之间质量从数学的角度来看是什么关系?如果要求出任意一种物质的质量,必须已知什么条件才可以求出?
自学检测1:
自学检测2:(并归纳步骤)
1.完全燃烧24克镁条,产生多少克氧化镁?
解:设产生氧化镁的质量为x
X=
40g
答:产生40克氧化镁
①
设(不带单位)
②
写(注意检查
是否配平)
③摆质量(算第一排的数
时,要乘以计量系数)
④
列、解(带单位
运算,结果有单位)
⑤
答
温馨提示
1、设未知量一般不要带单位。
2、已知量及结果要带单位且要一样。
3、列比例式方向要一致。
4、别忘了答。
根据化学方程式计算易忽略情况:
自学检测2:
1、电解9g水,能得到氢气的质量为多少?
小明的解法如下:
解:设能得到氢气xg
H2O
H2↑+
O2↑
18
32
9g
xg
18
32
9g
xg
x
=
16
答:能得到氢气16克。
=
火眼金睛
:
找出解答中不规范的地方
关系量没
有找准
未知量后
面带了单位
计算结果
没有带单位
未知量后
面带了单位
化学方程式
书写错误
2.氢气在氯气中燃烧生成氯化氢气体,计算燃烧100g氢气需要氯气的质量是多少?生成氯化氢气体的质量是少?
解:设需要氯气的质量为x
、生成氯化氢的质量为y:
2
71
73
100g
x
x=3550g
答:燃烧100g氢气需要氯气3550g,生成氯化氢
气体3650g
y
y=3650g
堂堂清:
1.实验室用49克氯酸钾制取氧气,则最多可得到多少克氧气?
2.食盐是一种重要的化工原料。利用食盐可以来制取氢氧化钠、氢气和氯气等,化学反应方程式为:2NaCl
+
2H2O
=
Cl2↑
+
H2↑+
2NaOH
若每天生产氯气71kg,问:
(1)需要氯化钠固体多少千克?
(2)同时能生产氢氧化钠多少千克?
课题3
利用化学方程式的简单计算
(第二课时)
第五单元
化学方程式
学习目标
掌握利用化学方程式计算的几种类型
一.质量守恒计算:
例:把干燥、纯净的KClO3和MnO2的混合物15.5克装入大试管中。
加热制取O2,待完全反应后,将大试管冷却,称量,得到10.7克固体物质。计算:
(1)制得O2多少克?
(2)10.7克固体物质中含有哪些物质?各多少克?
解:(1)O2的质量为:15.5g
-
10.7g
=
4.8g
(2)设生成KCl的质量为x
149
96
X
4.8g
X
=
7.45g
m(MnO2)=10.7g–7.45g=3.25g
答:剩余固体中氯化钾7.45克,二氧化锰为3.25克
自学检测1:
把13.5克干燥的氯酸钾和二氧化锰的混合物加热至完全反应,冷却后称量,剩余固体为8.7克,则原混合物中二氧化锰的质量为多少?
例:将2克H2在20克O2中充分燃烧,生成了多少克H2O?
解:设生成水的质量为x
2H2
+
O2
2H2O
4
32
36
2g
20g
X
(经分析:20g氧气过量)
x
36
4
2g
=
点燃
x
=
18g
答:生成了18克水。
二.过量计算:
例题:将8g硫与不同质量的氧气反应,试将生成
二氧化硫的质量填入下表:
①这题涉及的化学方程式__________________.
②这个化学方程式中各物质参加的质量比为_________.
③当第一次8g硫与4g氧气反应时,为什么不能生成
12g二氧化硫?
④从第二次以后,当不断增加氧气的质量,生成的二氧
化硫质量能否增加?为什么?
8
16
16
1:1:2
硫的质量/g
氧气的质量/g
生成二氧化硫的质量/g
8
4
8
8
8
12
1.将6克得木炭放入20克氧气中充分燃烧后,生成多少克二氧化碳气体?
堂堂清:
课题3
利用化学方程式的简单计算
(第三课时)
第五单元
化学方程式
三.表格数据分析计算:
例:化学兴趣小组同学将12.4克红磷分成四等分,分
别放入给定的氧气中充分燃烧,实验数据如下:
试回答:
(1)根据上述数据,实验中第____次恰好完全反应。
(2)表中的m
=
______。
(3)第____份实验中,红磷有剩余。剩余_____克
二
7.1g
一
1.55
将6g镁分别在一定量氧气中燃烧,有如下数据:
自学检测2
①这些反应中涉及的化学方程式为_________________。
②第
次镁与氧气恰好完全反应
③第
次反应镁有剩余,剩余
g。
④第
次反应氧气有剩余,剩余___g。
⑤这三次实验第___________次符合质量守恒定律。
2
1
3
3
4
1、2、3
第1次
第2次
第3次
所给氧气的质量/g
2
4
8
生成氧化镁的质量/g
5
10
10
4.某校兴趣小组在实验室完成制取O2的实验,他
们取氯酸钾和二氧化锰的混合物固体3克放入
大试管中加热,并在不同的时刻测得剩余固体
的质量如下表:
根据表格数据计算:
⑴完全反应后,产生氧气的质量为____克。
⑵原混合物中氯酸钾的质量分数为多少?
反应时间/min
1.0
1.5
2.0
2.5
3.0
剩余固体质量/g
2.55
2.25
2.10
2.04
2.04
四.质量分数(纯度)计算:
例:在80吨赤铁矿(主要成分是Fe2O3)中测得
Fe2O3的质量为64吨,则该赤铁矿的纯度为
多少?
5.有一种含有水的过氧化氢样品10g,在二氧化锰的催化作用下,完全分解得到了3.2g氧气,求该样品中过氧化氢的质量分数?
解:设该样品中过氧化氢的质量为X
2H2O2
2H2O
+O2
MnO2
68
32
X
3.2g
X=6.8g
该样品中过氧化氢的质量分数为:
10g
×100%=68%
答:该样品中过氧化氢的质量分数为68%
1.在反应A
+
3B
=
2C中,若28克的A和6克的B恰好完全反应。若要生成17克C,则参加反应的B的质量为________.
2.在反应A+3B=2C+2D中,A和B的相对分子质量之比为9:11。已知1.8gA与一定量B恰好完全反应,生成5.1gD,则在此反应中B和C的质量比为________.
3.将m克硫在n克氧气中完全燃烧,生成二氧化硫的质量为
(
)
A
小于m+n克
B大于m+n克
C不大于m+n克
D等于m+n克
4.⑴某物质在氧气中燃烧后只生成二氧化碳和水,判断该化合物中一定含有____元素,可能含有____元素;
(2)某物质在128克氧气中燃烧后只生成88克二氧化碳和72克水,判断该化合物中一定含有____元素;
(3)某4.6克化合物在氧气中燃烧后只生成8.8克二氧化碳和5.4克水,该化合物的化学式为________
.
1.已知含杂质20%的大理石(含CaCO3)250吨,在充
分灼烧够得到生石灰CaO多少吨?
(CaCO3
CaO
+
CO2↑)
2.把150克氯酸钾在一定的条件下,加热一段时间后生
成了48克氧气,求:氯酸钾的分解率?
堂堂清:
高温
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
