人教化学选修6第一单元课题2中和滴定图像题的解法探究(共17张PPT)
文档属性
| 名称 | 人教化学选修6第一单元课题2中和滴定图像题的解法探究(共17张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-25 20:09:43 | ||
图片预览




文档简介
(共17张PPT)
中和滴定图像题的解法探究
【考情分析】
高考考什么?
1.巩固离子浓度比较和平衡常数计算
2.能用特殊点解决中和滴定图像题
3.体会离子图像题的变化观念和守恒思想
【学习目标】
298
K时,在20.0
mL
0.10
mol·L-1氨水中滴入0.10
mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10
mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是( )
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0
mL
C.M点处的溶液中
c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
【课前真题】
D
高考怎么考?
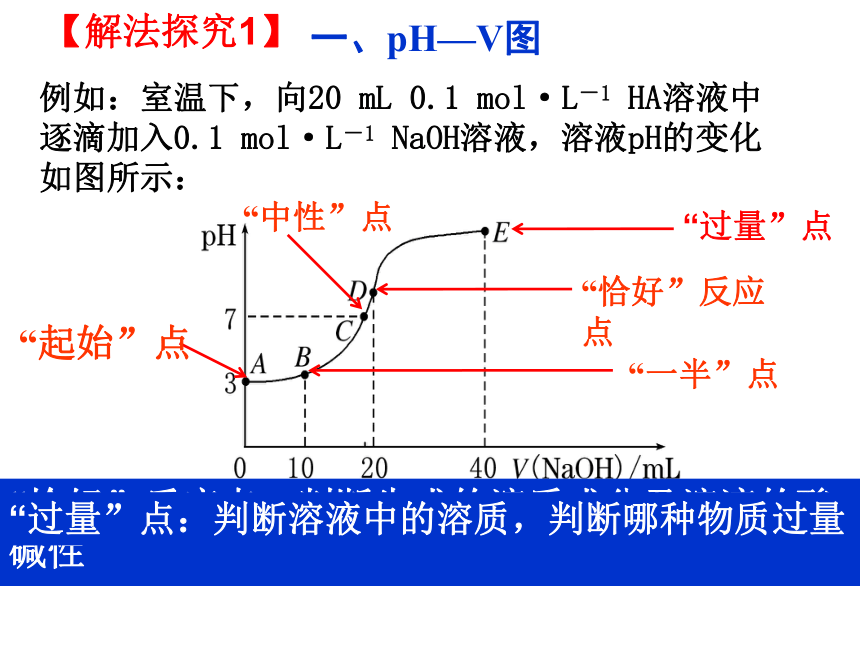
例如:室温下,向20
mL
0.1
mol·L-1
HA溶液中逐滴加入0.1
mol·L-1
NaOH溶液,溶液pH的变化如图所示:
【解法探究1】
一、pH—V图
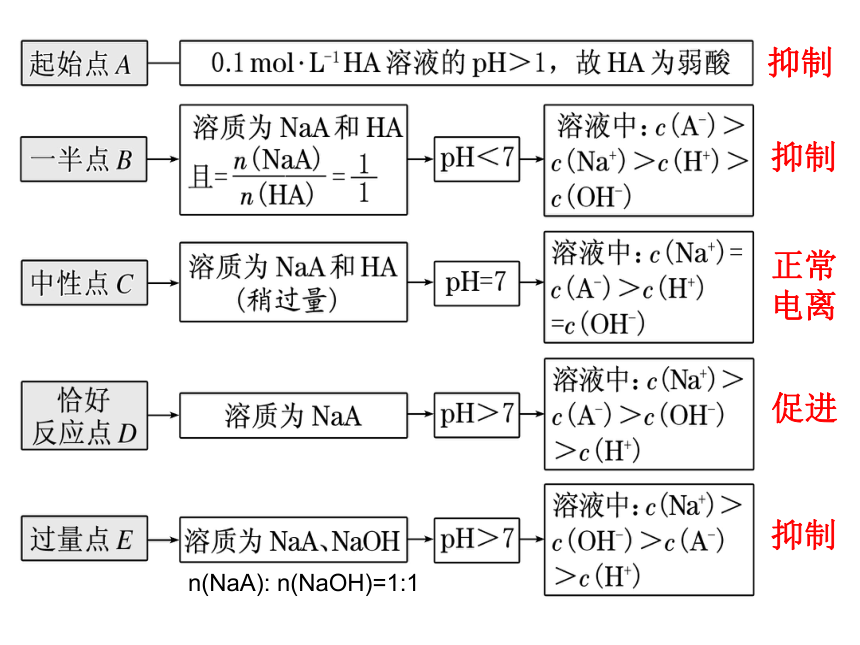
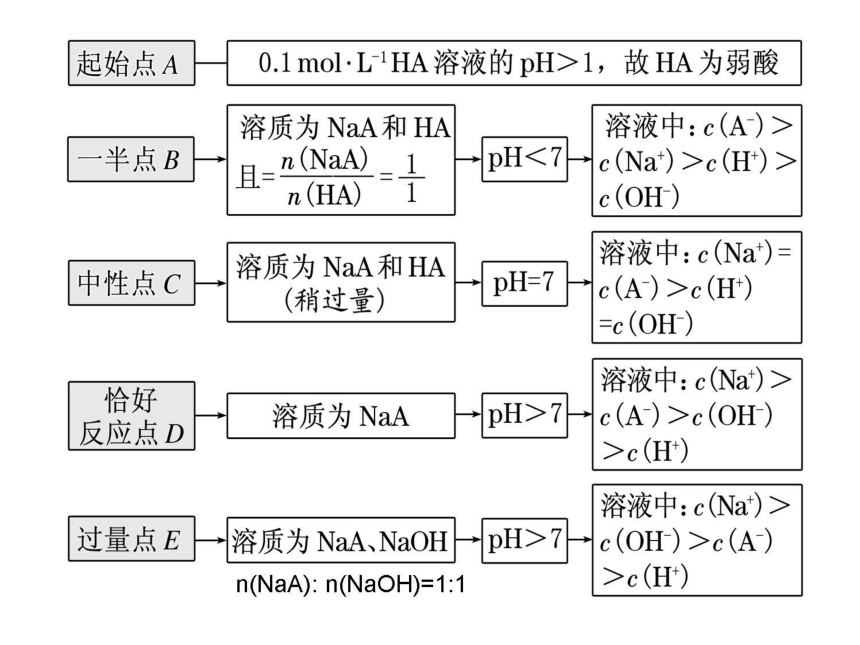
“起始”点:判断酸、碱的相对强弱
“一半”点:判断是哪种溶质的等量混合
“中性”点:判断溶液中溶质的成分及哪种物质过
量或不足
“恰好”反应点:判断生成的溶质成分及溶液的酸碱性
“过量”点:判断溶液中的溶质,判断哪种物质过量
抑制
抑制
正常
电离
促进
抑制
【解法探究2】
二、c水(H+)/
c水(OH-)—V图
A
B
C
D
E
?
【典例1】用0.1
mol/L
NaOH溶液滴定10
mL
0.1
mol/L
H2A溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法错误的是( )
A.A点溶液中加入少量水:C(OH-)/C(H2A)增大
B.B点:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.C点:c(Na+)=c(HA-)+2c(A2-)
D.水电离出来的c(OH-):B>D
D
【对点练习1】室温下向10
mL
0.1
mol·L-1
NaOH溶液中加入0.1
mol·L-1的一元酸HA,溶液pH的变化曲线如下所示。下列说法正确的是( )
A.a点所示溶液中c(Na+)>c(A-)>c(HA)>c(OH-)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)>c(HA)
D
【典例2】298K时,向20ml
c
mol/LKOH溶液中滴加0.1mol/LHCOOH溶液,混合溶液中水电离的c(OH-)与滴加甲酸(弱酸)溶液体积(V)的关系如图所示。下列说法正确的是
(
)
上述使用的KOH溶液浓度的数值为0.01
c点对应的溶液中:c(OH-)>c(H+)
+
c(HCOOH)
若d点对应的甲酸溶液体积为V1mL,则HCOOH的电离常数Ka=2×10-6/(V1-20)
b点对应的溶液中:
c(K+)=c(HCOO-)
C
【对点练习2】
常温下,向20
mL某浓度的硫酸溶液中滴入0.1
mol·L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是( )
A.V=40
B.d点所示溶液中:c(NH4+)=2c(SO42-)
C.c点所示溶液中:c(H+)-c(OH-)=2c(NH3·H2O)
D.b点溶液PH=7
B
【解法探究3】
三、pH—对数图
【典例3】常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是(
)
D
1.两条线?
2.特殊点?
【对点练习3】常温下将NaOH?溶液分别滴加到两种一元弱酸HA?和HB?中,两种混合溶液的pH?与离子浓度变化的关系如图所示。下列叙述错误的是(
)
A.电离常数:Ka(HB)>Ka(HA)
B.Ka(HA)的数量级为10-5
C.当HA?与NaOH?溶液混合至中性时:c(A-)=c(HA)
D.等浓度等体积的HA?和NaB混合后所得溶液中:c(H+)>c(OH-)
C
常温下,二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的PH与微粒浓度变化的关系如图所示,下列有关说法错误的是(
)
【加固练习】
D
中和滴定图像题的解法探究
【考情分析】
高考考什么?
1.巩固离子浓度比较和平衡常数计算
2.能用特殊点解决中和滴定图像题
3.体会离子图像题的变化观念和守恒思想
【学习目标】
298
K时,在20.0
mL
0.10
mol·L-1氨水中滴入0.10
mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10
mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是( )
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0
mL
C.M点处的溶液中
c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
【课前真题】
D
高考怎么考?
例如:室温下,向20
mL
0.1
mol·L-1
HA溶液中逐滴加入0.1
mol·L-1
NaOH溶液,溶液pH的变化如图所示:
【解法探究1】
一、pH—V图
“起始”点:判断酸、碱的相对强弱
“一半”点:判断是哪种溶质的等量混合
“中性”点:判断溶液中溶质的成分及哪种物质过
量或不足
“恰好”反应点:判断生成的溶质成分及溶液的酸碱性
“过量”点:判断溶液中的溶质,判断哪种物质过量
抑制
抑制
正常
电离
促进
抑制
【解法探究2】
二、c水(H+)/
c水(OH-)—V图
A
B
C
D
E
?
【典例1】用0.1
mol/L
NaOH溶液滴定10
mL
0.1
mol/L
H2A溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法错误的是( )
A.A点溶液中加入少量水:C(OH-)/C(H2A)增大
B.B点:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.C点:c(Na+)=c(HA-)+2c(A2-)
D.水电离出来的c(OH-):B>D
D
【对点练习1】室温下向10
mL
0.1
mol·L-1
NaOH溶液中加入0.1
mol·L-1的一元酸HA,溶液pH的变化曲线如下所示。下列说法正确的是( )
A.a点所示溶液中c(Na+)>c(A-)>c(HA)>c(OH-)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)>c(HA)
D
【典例2】298K时,向20ml
c
mol/LKOH溶液中滴加0.1mol/LHCOOH溶液,混合溶液中水电离的c(OH-)与滴加甲酸(弱酸)溶液体积(V)的关系如图所示。下列说法正确的是
(
)
上述使用的KOH溶液浓度的数值为0.01
c点对应的溶液中:c(OH-)>c(H+)
+
c(HCOOH)
若d点对应的甲酸溶液体积为V1mL,则HCOOH的电离常数Ka=2×10-6/(V1-20)
b点对应的溶液中:
c(K+)=c(HCOO-)
C
【对点练习2】
常温下,向20
mL某浓度的硫酸溶液中滴入0.1
mol·L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是( )
A.V=40
B.d点所示溶液中:c(NH4+)=2c(SO42-)
C.c点所示溶液中:c(H+)-c(OH-)=2c(NH3·H2O)
D.b点溶液PH=7
B
【解法探究3】
三、pH—对数图
【典例3】常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是(
)
D
1.两条线?
2.特殊点?
【对点练习3】常温下将NaOH?溶液分别滴加到两种一元弱酸HA?和HB?中,两种混合溶液的pH?与离子浓度变化的关系如图所示。下列叙述错误的是(
)
A.电离常数:Ka(HB)>Ka(HA)
B.Ka(HA)的数量级为10-5
C.当HA?与NaOH?溶液混合至中性时:c(A-)=c(HA)
D.等浓度等体积的HA?和NaB混合后所得溶液中:c(H+)>c(OH-)
C
常温下,二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的PH与微粒浓度变化的关系如图所示,下列有关说法错误的是(
)
【加固练习】
D
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
