人教选修4化学反应原理:序言(有效碰撞理论)(共34张PPT)
文档属性
| 名称 | 人教选修4化学反应原理:序言(有效碰撞理论)(共34张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 460.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-25 20:26:28 | ||
图片预览











文档简介
(共34张PPT)
化学反应原理--绪言
化学的精髓和魅力所在是:
化学反应原理(规律)
什么是化学?
著名科学家R·布里斯罗在就任美国化学会会长期间写了一部经典的著作,名为《化学的今天和明天》。在该书的副标题中,化学被神圣地定义为“一门中心的、实用的、创造性的科学”。
与人类已知的几百万种生物相比,已知的化合物已达数亿种,近来每年化学家创造的新化合物就达100万种以上。
化学与制药、石油、橡胶、造纸、建材、钢铁、食品、纺织、皮革等与国民经济息息相关的产业衰荣与共。据统计,大约有50%的工业化学家活跃在这些行业中。
为了保卫地球、珍惜环境,化学家们开创了绿色时代。“绿色化学”正在努力并且已经能够做到:使天空更清洁,使化工厂排放的水与取用时一样干净。
1、化学研究的核心问题是:
2、化学中最具有创造性的工作是:
3、如何实现这个过程?
化学反应的原理和过程
设计和创造新的分子
利用已发现的原理、理论来进行设计并实现这个过程
这就是学习化学反应原理的目的
氢气与其他物质的反应
反应条件及现象
难易程度
H2+F2
阴暗、爆炸
易
H2+Cl2
光照、爆炸或点燃
较易
H2+N2
高温、高压、催化剂
难
问题:
1.观察表格信息,思考为什么反应的快慢、难易程度不同?或者说反应的快慢、难易程度与什么有关系?
---内因
结论1:影响化学反应速率的根本原因是反应物本身的性质。
2.将H2+O2混合,在室温条件下可以稳定存在数百年,但点燃后却会发生剧烈的爆炸反应,而且只要配比适当,可以完全转化成生成物。由此说明了什么问题?
3.
H2+N2即使在高温、高压、催化剂条件下,也不可能完全转化为生成物。由此你又能得出什么结论?
---外因
结论2:内部因素已经具备了,不同的外界条件都能够不同程度的改变化学反应的速率。
结论3:有些反应是有一定限度的。
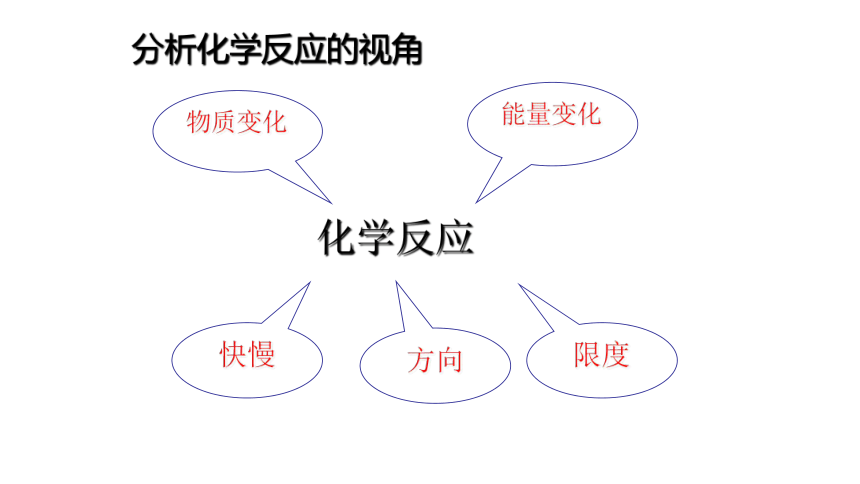
分析化学反应的视角
物质变化
方向
快慢
能量变化
限度
化学反应
化学反应与能量
化学反应速率和化学平衡
溶液中的离子平衡
电化学基础
从能量变化的角度来探讨化学变化
讨论了最基本的化学反应原理,包括反应速速率、反应方向及反应限度
从理论的高度来认识酸碱盐的本质及其在溶液中的反应
电化学的基础知识(原电池、电解池、化学电源、金属电化腐蚀和防护)。
平衡理论
及其应用
化学能与热能电能的转化
一、《化学反应原理》的基本内容:
(1)化学反应是怎样发生的
(2)为什么有的反应快、有的反应慢
(3)它遵循怎样的规律
(4)如何控制化学反应才能为人所用
学习化学反应原理:
那么如何来研究一个反应,研究化学反应原理的基本方法和思路是怎样?
二、研究化学反应原理的思路与方法
——简化概念模型法
简化后的有效碰撞模型
请仔细阅读课本绪言P2--4页内容
(一)设想
气体分子之间通常存在着比气体分子本身的体积要大得多的空间,忽略了分子与分子之间的相互作用力,分子之间不存在牵制关系,因此,在常温常压下,可以认为气体分子的运动是自由的,因而,它们之间的碰撞可以视为是随机的。
(二)模型的基本构架
【研究情景】
在一个洁净的容器中,使H2和O2按体积比2:1的比例混合,气体分子因自由运动而不断相互碰撞(互相接触)——这是发生化学反应的必要条件。
事实:研究结果表明,从分子的热运动看,分子发生碰撞的机会很多。如在常温常压下每个H2、O2自身或它们之间的碰撞频率为2.355×1010次/s。假如每次碰撞都能发生化学反应,则化学变化瞬间即可完成,但事实并非如此。
结论:并不是每次分子间的碰撞都会引起化学反应,只有其中部分的气体分子碰撞是有效的,即有效碰撞。
【假设1】反应物分子之间只要相互碰撞就能发生化学反应。
反应物间接触才能发生化学反应
分子不停运动
接触
碰撞
有效碰撞
无效碰撞
思考:什么是有效碰撞?
结论
分子间的碰撞是发生化学反应的必要条件
而有效碰撞是发生化学反应的充要条件
1、有效碰撞
能够导致分子中化学键断裂,引起化学反应的碰撞。
思考:为什么有的碰撞可以发生反应(有效碰撞),而有的不能发生反应(无效碰撞)?
推断:一定与分子本身的性质和能量有关。
无效碰撞
有效碰撞
无效碰撞
有效碰撞
发生有效碰撞的条件
推论:某一个化学反应的速率大小与单位时间内分子有效碰撞的次数有关,单位时间内有效碰撞的次数越多,该反应的速率越快。
(1)发生碰撞的分子必须有足够高的能量
(2)分子发生碰撞时必须有合理的取向
2、活化分子
具有较高能量,有可能发生有效碰撞的分子。
活化分子具有的高能量从何来?
①吸收外界能量
(如加热、光照等)
②分子间碰撞时,能量交换不均衡而出现较高能量的分子。
能发生有效碰撞的分子一定是活化分子。
但活化分子的碰撞不一定是有效碰撞,还与碰撞的角度有关。(碰撞时的取向合适不合适)
(活化分子间的碰撞只有取向正确的才是有效碰撞,才能引起化学变化)
有效碰撞次数的多少与单位体积内反应物中活化分子的多少有关。
结论
3、活化能
活化分子高出反应物分子平均能量的部分。活化能的大小是由反应物分子的性质决定。
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
反应热
该反应是吸热反应还是放热反应?
活化分子变成生成物分子放出的能量
E2-E1是反应热
内因起主要决定作用
活化能作用:使反应物活化,从而启动反应或改变反应速率
从上图可知:活化能与化学反应难易有什么关系?
活化能高,反应难;活化能低,反应易。
我们知道在2H2O2=O2+2H2O反应中加入催化剂MnO2会加速H2O2的分解,你知道为什么吗?
为什么活化能高的反应不容易发生呢?
活化能高,活化分子的百分数低,反应难。
结论:
活化分子的多少与该反应的活化能的大小有关,
活化能的大小是由反应物分子的性质决定。
推论1:
活化能越小,则一般分子成为活化分子越容易,则活化分子越多,单位时间内有效碰撞越多,反应速率越快。
推论2:
活化能越小,一般分子成为活化分子越容易,则反应条件越简单。
常用的提供活化能的方法:
加热、光照、超声波、核辐射、外加磁场
活化能高,活化分子的百分数低,反应难;
活化能低,活化分子的百分数高,反应易。
有没有活化能为0的化学反应?
案例1:AgNO3溶液与NaCl溶液混合
离子间的反应瞬间完成
可看作活化能为0
案例2:在高空50~85Km的大气层,平均温度只有-50℃,存在大量自由原子之间的反应,不需要活化能的推动。
反应活化能为0的反应:
自由移动的原子或离子之间的反应
思考:催化剂在我们提高生产效率和经济效益中起关键作用,试想一下为什么催化剂能提高反应速率?
在化学反应中能改变其他物质的反应速率,而本身质量和化学性质在反应前后不变的物质。
4、催
化
剂(触媒)
催化剂作用:可以降低化学反应所需的活化能,也就等于提高了活化分子的百分数,从而提高了有效碰撞的频率,反应速率大幅提高。
能量
反应过程
生成物
反应物
反应热
E1
E2
活化分子
加了催化剂
没加催化剂
降低反应的活化能来加快反应的速率
思考:1、加入催化剂为什么可以加快反应速率?
2、加入催化剂对反应热有没有影响?
催化剂通过降低反应的活化能来加快反应速率
加入催化剂能降低活化分子的“门槛”,但是对这个化学反应前后的能量变化(反应热)并不产生任何影响。
催化剂与反应物结合为中间产物,降低了反应的活化能,使活化分子百分数大大增加,反应速率大大加快。反应结束,中间产物消失,催化剂复原。
催化原理:中间产物理论
催化剂有正催化剂和负催化剂之分
2、活化能的大小意味着反应的难易程度,活化能越大则越难反应,反之越易。
3、不同的反应所需的活化能差别很大,活化能越小,活化分子所占的百分率越大,反应速率越大
注意:
1、反应热的大小与活化能大小无关,与催化剂无关。仅与反应物与生成物具有的总能量差有关。
活化分子百分数=
活化分子数
总分子数
100%
有效碰撞
活化分子
活化能
催化剂
能发生化学反应的碰撞叫有效碰撞。
具有足够的能量能发生有效碰撞的分子叫活化分子。
活化分子所多出的那部分能量叫活化能。
能改变化学反应速率,而本身质量和化学性质在反应前后不变的物质。
一个反应要发生一般要经历哪些过程?
小结
普通
分子
得到能量
活化
分子
合理
取向的
碰撞
有效
碰撞
新物质
能量
活化能
某一化学反应的速率大小与单位时间内分子的有效碰撞次数有关;而有效碰撞次数的多少与单位体积内反应物中活化分子的多少有关;活化分子的多少又与该反应活化能的大小有关。活化能的大小是由该反应的反应物分子的性质决定的,而反应物分子的性质又与分子的内部结构密切相关。
通过绪言的学习,初步了解“有效碰撞”、“活化分子与活化能”的概念模型,认识催化剂对于化学科学研究和化工生产的巨大作用,为其后的学习打下基础。
还知道:
某一化学反应的速率大小与单位时间内分子的有效碰撞次数有关;而有效碰撞次数的多少与单位体积活化分子百分数有关;活化分子的多少又与该反应活化能的大小有关。活化能的大小是由该反应的反应物分子性质决定的,而反应物分子的性质又与分子的内部结构密切相关。
碰撞是发生化学反应的必要条件,有效碰撞是发生化学反应的充分条件。
⑴浓度越高,反应速率越快
原因:浓度增大,单位体积的活化分子数增多,单位时间内的有效碰撞次数增多
练习:活化能、活化分子、有效碰撞等概念模型的实际应用
⑵有气体参加的反应,压强越高,反应速率越快
原因:压强增大,浓度就增大,单位体积内的活化分子数增多,单位时间内的有效碰撞次数增多
⑶温度越高,反应速率越快
原因:温度升高,活化分子百分数增加,单位时间内的有效碰撞次数增多。
⑷加催化剂反应速率加快
(影响力:催化剂>温度>浓度)。
原因:催化剂能降低活化能,使活化分子数大大增加,单位时间内的有效碰撞次数显著增多。
随堂练习
练习:下列说法错误的是
A.当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应
B.发生有效碰撞的分子一定是活化分子
C.活化分子间的碰撞一定是有效碰撞
D.活化分子间每次碰撞都发生化学反应
E.能发生有效碰撞的分子必须具有相当高的能量
F.活化能指活化分子多出反应物分子平均能量的那部分能量
G.使用催化剂能改变分子的活化能
H.催化剂能使不起反应的物质间发生反应
√
√
√
学习化学的方法
1.加强预习,做有准备的学习;
2.专心上课,做有时效的学习;
3.及时练习,做有基础的学习;
4.会提问题,做有反思的学习;
5.乐于动手,做有生活的学习。
化学反应原理--绪言
化学的精髓和魅力所在是:
化学反应原理(规律)
什么是化学?
著名科学家R·布里斯罗在就任美国化学会会长期间写了一部经典的著作,名为《化学的今天和明天》。在该书的副标题中,化学被神圣地定义为“一门中心的、实用的、创造性的科学”。
与人类已知的几百万种生物相比,已知的化合物已达数亿种,近来每年化学家创造的新化合物就达100万种以上。
化学与制药、石油、橡胶、造纸、建材、钢铁、食品、纺织、皮革等与国民经济息息相关的产业衰荣与共。据统计,大约有50%的工业化学家活跃在这些行业中。
为了保卫地球、珍惜环境,化学家们开创了绿色时代。“绿色化学”正在努力并且已经能够做到:使天空更清洁,使化工厂排放的水与取用时一样干净。
1、化学研究的核心问题是:
2、化学中最具有创造性的工作是:
3、如何实现这个过程?
化学反应的原理和过程
设计和创造新的分子
利用已发现的原理、理论来进行设计并实现这个过程
这就是学习化学反应原理的目的
氢气与其他物质的反应
反应条件及现象
难易程度
H2+F2
阴暗、爆炸
易
H2+Cl2
光照、爆炸或点燃
较易
H2+N2
高温、高压、催化剂
难
问题:
1.观察表格信息,思考为什么反应的快慢、难易程度不同?或者说反应的快慢、难易程度与什么有关系?
---内因
结论1:影响化学反应速率的根本原因是反应物本身的性质。
2.将H2+O2混合,在室温条件下可以稳定存在数百年,但点燃后却会发生剧烈的爆炸反应,而且只要配比适当,可以完全转化成生成物。由此说明了什么问题?
3.
H2+N2即使在高温、高压、催化剂条件下,也不可能完全转化为生成物。由此你又能得出什么结论?
---外因
结论2:内部因素已经具备了,不同的外界条件都能够不同程度的改变化学反应的速率。
结论3:有些反应是有一定限度的。
分析化学反应的视角
物质变化
方向
快慢
能量变化
限度
化学反应
化学反应与能量
化学反应速率和化学平衡
溶液中的离子平衡
电化学基础
从能量变化的角度来探讨化学变化
讨论了最基本的化学反应原理,包括反应速速率、反应方向及反应限度
从理论的高度来认识酸碱盐的本质及其在溶液中的反应
电化学的基础知识(原电池、电解池、化学电源、金属电化腐蚀和防护)。
平衡理论
及其应用
化学能与热能电能的转化
一、《化学反应原理》的基本内容:
(1)化学反应是怎样发生的
(2)为什么有的反应快、有的反应慢
(3)它遵循怎样的规律
(4)如何控制化学反应才能为人所用
学习化学反应原理:
那么如何来研究一个反应,研究化学反应原理的基本方法和思路是怎样?
二、研究化学反应原理的思路与方法
——简化概念模型法
简化后的有效碰撞模型
请仔细阅读课本绪言P2--4页内容
(一)设想
气体分子之间通常存在着比气体分子本身的体积要大得多的空间,忽略了分子与分子之间的相互作用力,分子之间不存在牵制关系,因此,在常温常压下,可以认为气体分子的运动是自由的,因而,它们之间的碰撞可以视为是随机的。
(二)模型的基本构架
【研究情景】
在一个洁净的容器中,使H2和O2按体积比2:1的比例混合,气体分子因自由运动而不断相互碰撞(互相接触)——这是发生化学反应的必要条件。
事实:研究结果表明,从分子的热运动看,分子发生碰撞的机会很多。如在常温常压下每个H2、O2自身或它们之间的碰撞频率为2.355×1010次/s。假如每次碰撞都能发生化学反应,则化学变化瞬间即可完成,但事实并非如此。
结论:并不是每次分子间的碰撞都会引起化学反应,只有其中部分的气体分子碰撞是有效的,即有效碰撞。
【假设1】反应物分子之间只要相互碰撞就能发生化学反应。
反应物间接触才能发生化学反应
分子不停运动
接触
碰撞
有效碰撞
无效碰撞
思考:什么是有效碰撞?
结论
分子间的碰撞是发生化学反应的必要条件
而有效碰撞是发生化学反应的充要条件
1、有效碰撞
能够导致分子中化学键断裂,引起化学反应的碰撞。
思考:为什么有的碰撞可以发生反应(有效碰撞),而有的不能发生反应(无效碰撞)?
推断:一定与分子本身的性质和能量有关。
无效碰撞
有效碰撞
无效碰撞
有效碰撞
发生有效碰撞的条件
推论:某一个化学反应的速率大小与单位时间内分子有效碰撞的次数有关,单位时间内有效碰撞的次数越多,该反应的速率越快。
(1)发生碰撞的分子必须有足够高的能量
(2)分子发生碰撞时必须有合理的取向
2、活化分子
具有较高能量,有可能发生有效碰撞的分子。
活化分子具有的高能量从何来?
①吸收外界能量
(如加热、光照等)
②分子间碰撞时,能量交换不均衡而出现较高能量的分子。
能发生有效碰撞的分子一定是活化分子。
但活化分子的碰撞不一定是有效碰撞,还与碰撞的角度有关。(碰撞时的取向合适不合适)
(活化分子间的碰撞只有取向正确的才是有效碰撞,才能引起化学变化)
有效碰撞次数的多少与单位体积内反应物中活化分子的多少有关。
结论
3、活化能
活化分子高出反应物分子平均能量的部分。活化能的大小是由反应物分子的性质决定。
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
反应热
该反应是吸热反应还是放热反应?
活化分子变成生成物分子放出的能量
E2-E1是反应热
内因起主要决定作用
活化能作用:使反应物活化,从而启动反应或改变反应速率
从上图可知:活化能与化学反应难易有什么关系?
活化能高,反应难;活化能低,反应易。
我们知道在2H2O2=O2+2H2O反应中加入催化剂MnO2会加速H2O2的分解,你知道为什么吗?
为什么活化能高的反应不容易发生呢?
活化能高,活化分子的百分数低,反应难。
结论:
活化分子的多少与该反应的活化能的大小有关,
活化能的大小是由反应物分子的性质决定。
推论1:
活化能越小,则一般分子成为活化分子越容易,则活化分子越多,单位时间内有效碰撞越多,反应速率越快。
推论2:
活化能越小,一般分子成为活化分子越容易,则反应条件越简单。
常用的提供活化能的方法:
加热、光照、超声波、核辐射、外加磁场
活化能高,活化分子的百分数低,反应难;
活化能低,活化分子的百分数高,反应易。
有没有活化能为0的化学反应?
案例1:AgNO3溶液与NaCl溶液混合
离子间的反应瞬间完成
可看作活化能为0
案例2:在高空50~85Km的大气层,平均温度只有-50℃,存在大量自由原子之间的反应,不需要活化能的推动。
反应活化能为0的反应:
自由移动的原子或离子之间的反应
思考:催化剂在我们提高生产效率和经济效益中起关键作用,试想一下为什么催化剂能提高反应速率?
在化学反应中能改变其他物质的反应速率,而本身质量和化学性质在反应前后不变的物质。
4、催
化
剂(触媒)
催化剂作用:可以降低化学反应所需的活化能,也就等于提高了活化分子的百分数,从而提高了有效碰撞的频率,反应速率大幅提高。
能量
反应过程
生成物
反应物
反应热
E1
E2
活化分子
加了催化剂
没加催化剂
降低反应的活化能来加快反应的速率
思考:1、加入催化剂为什么可以加快反应速率?
2、加入催化剂对反应热有没有影响?
催化剂通过降低反应的活化能来加快反应速率
加入催化剂能降低活化分子的“门槛”,但是对这个化学反应前后的能量变化(反应热)并不产生任何影响。
催化剂与反应物结合为中间产物,降低了反应的活化能,使活化分子百分数大大增加,反应速率大大加快。反应结束,中间产物消失,催化剂复原。
催化原理:中间产物理论
催化剂有正催化剂和负催化剂之分
2、活化能的大小意味着反应的难易程度,活化能越大则越难反应,反之越易。
3、不同的反应所需的活化能差别很大,活化能越小,活化分子所占的百分率越大,反应速率越大
注意:
1、反应热的大小与活化能大小无关,与催化剂无关。仅与反应物与生成物具有的总能量差有关。
活化分子百分数=
活化分子数
总分子数
100%
有效碰撞
活化分子
活化能
催化剂
能发生化学反应的碰撞叫有效碰撞。
具有足够的能量能发生有效碰撞的分子叫活化分子。
活化分子所多出的那部分能量叫活化能。
能改变化学反应速率,而本身质量和化学性质在反应前后不变的物质。
一个反应要发生一般要经历哪些过程?
小结
普通
分子
得到能量
活化
分子
合理
取向的
碰撞
有效
碰撞
新物质
能量
活化能
某一化学反应的速率大小与单位时间内分子的有效碰撞次数有关;而有效碰撞次数的多少与单位体积内反应物中活化分子的多少有关;活化分子的多少又与该反应活化能的大小有关。活化能的大小是由该反应的反应物分子的性质决定的,而反应物分子的性质又与分子的内部结构密切相关。
通过绪言的学习,初步了解“有效碰撞”、“活化分子与活化能”的概念模型,认识催化剂对于化学科学研究和化工生产的巨大作用,为其后的学习打下基础。
还知道:
某一化学反应的速率大小与单位时间内分子的有效碰撞次数有关;而有效碰撞次数的多少与单位体积活化分子百分数有关;活化分子的多少又与该反应活化能的大小有关。活化能的大小是由该反应的反应物分子性质决定的,而反应物分子的性质又与分子的内部结构密切相关。
碰撞是发生化学反应的必要条件,有效碰撞是发生化学反应的充分条件。
⑴浓度越高,反应速率越快
原因:浓度增大,单位体积的活化分子数增多,单位时间内的有效碰撞次数增多
练习:活化能、活化分子、有效碰撞等概念模型的实际应用
⑵有气体参加的反应,压强越高,反应速率越快
原因:压强增大,浓度就增大,单位体积内的活化分子数增多,单位时间内的有效碰撞次数增多
⑶温度越高,反应速率越快
原因:温度升高,活化分子百分数增加,单位时间内的有效碰撞次数增多。
⑷加催化剂反应速率加快
(影响力:催化剂>温度>浓度)。
原因:催化剂能降低活化能,使活化分子数大大增加,单位时间内的有效碰撞次数显著增多。
随堂练习
练习:下列说法错误的是
A.当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应
B.发生有效碰撞的分子一定是活化分子
C.活化分子间的碰撞一定是有效碰撞
D.活化分子间每次碰撞都发生化学反应
E.能发生有效碰撞的分子必须具有相当高的能量
F.活化能指活化分子多出反应物分子平均能量的那部分能量
G.使用催化剂能改变分子的活化能
H.催化剂能使不起反应的物质间发生反应
√
√
√
学习化学的方法
1.加强预习,做有准备的学习;
2.专心上课,做有时效的学习;
3.及时练习,做有基础的学习;
4.会提问题,做有反思的学习;
5.乐于动手,做有生活的学习。
