人教版选修四高中化学第四章第一节《原电池》课件(共29张PPT)
文档属性
| 名称 | 人教版选修四高中化学第四章第一节《原电池》课件(共29张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-26 11:06:07 | ||
图片预览






文档简介
(共29张PPT)
第四章
电化学基础
第一节
原
电
池
人教版选修4
·
化学反应原理
复习回顾
1、原电池是______________________的装置。
原电池反应的本质是_______________反应。
将化学能转化为电能
氧化还原反应
2、如右图所示,组成的原电池:
(1)当电解质溶液为稀H2SO4时:
Zn电极是____(填“正”或“负”)极,
其电极反应为_______________,该反应
是______(填“氧化”或“还原”,下同)反应;
Cu电极是______极,其电极反应为
_______________,该反应是_________反应。
(2)当电解质溶液为CuSO4溶液时:
Zn电极
是____极,其电极反应为_____________,
该反应是________反应;Cu电极是____极,
其电极反应为_______________,该反应是_________反应.
负
Zn
-2e
-
=
Zn
2+
氧化
正
2H+
+2e-
=H2↑
还原
负
Zn
-2e
-
=
Zn
2+
氧化
正
Cu2+
+
2e
-
=
Cu
还原
【实验验证化学能转化
为电能的客观事实】
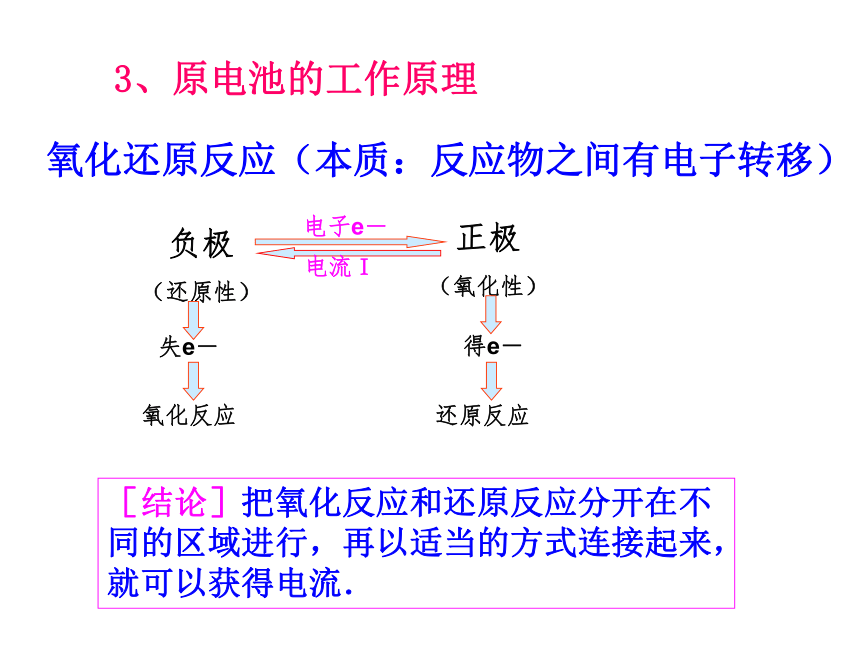
3、原电池的工作原理
氧化还原反应(本质:反应物之间有电子转移)
[结论]把氧化反应和还原反应分开在不同的区域进行,再以适当的方式连接起来,就可以获得电流.
(可以)
(可以)
(可以)
(不可以)
形成条件一:
活泼性不同的两个电极
负极:较活泼的金属
正极:较不活泼的金属、石墨等
判断下列哪些装置能构成原电池。为什么?
形成条件二:电极需插进电解质溶液中;
形成条件三:必须形成闭合回路
(可以)
(不可以)
(可以)
(不可以)
(1)有两种活动性不同的金属(或一
种是非金属单质或金属氧化物)作电极。
(2)电极材料均插入电解质溶液中。
(3)两极相连形成闭合电路。
(4)内部条件:能自发进行氧化还
原反应。
4、组成原电池的条件
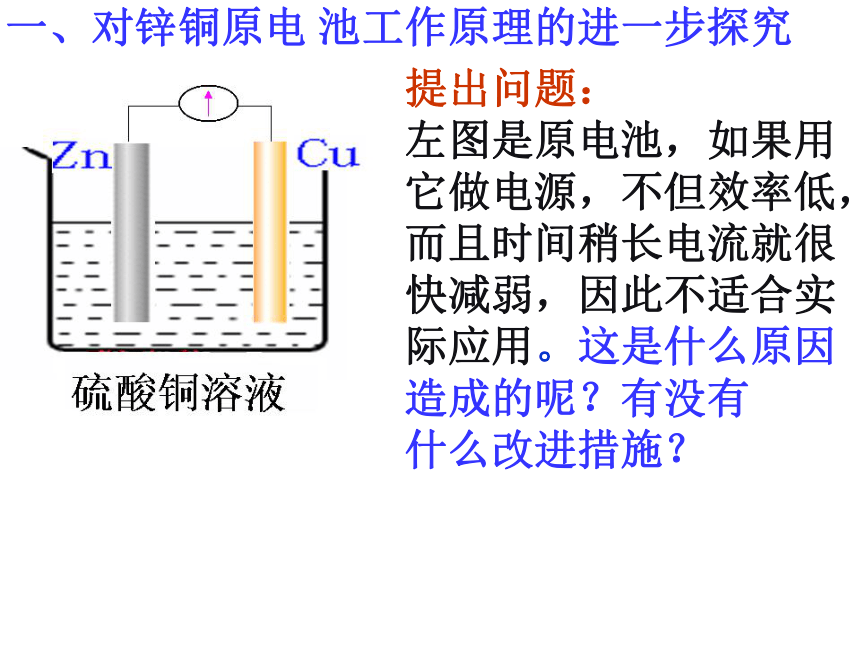
一、对锌铜原电
池工作原理的进一步探究
提出问题:
左图是原电池,如果用它做电源,不但效率低,而且时间稍长电流就很快减弱,因此不适合实际应用。这是什么原因造成的呢?有没有
什么改进措施?
造成的主要原因:由于锌片与硫酸铜溶液直
接接触,在反应一段时间后,难以避免溶液
中有铜离子在锌片表面直接还原,一旦有少
量的铜在锌片表面析出,即在负极(锌)表
面也构成了原电池,进一步加速铜在负极锌
表面析出,致使向外输出的电流强度减弱。
当锌片表面完全被铜覆盖后,不再构成原
电池了,也就没有电流在产生。
改进措施?
将锌片与硫酸铜溶液隔离
硫酸锌溶液
硫酸铜溶液
为了避免发生这种现象,设计如下图(书P71图4-1)所示的原电池装置,你能解释它的工作原理吗?
盐桥中通常装有含琼胶的KCl饱和溶液
此装置优点:能稳定长时间放电
盐桥在此的作用是什么?改进后的装置为什么能够持续、稳定的产生电流?
阅读教材72页
得出结论
盐桥的作用:
(1)使整个装置构成通路,代替两溶液直接接触。
(2)平衡电荷。
在整个装置的电流回路中,溶液中的电流通路是靠离子迁移完成的。Zn失去电子形成的Zn2+进入ZnSO4溶液,ZnSO4溶液因Zn2+增多而带正电荷。同时,CuSO4则由于Cu2+
变为Cu
,使得
SO42-相对较多而带负电荷。溶液不保持电中性,这两种因素均会阻止电子从锌片流向铜片,造成电流中断。
由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶液扩散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别中和过剩的电荷,保持溶液的电中性,因而放电作用不间断地进行,一直到锌片全部溶解或
CuSO4溶液中的
Cu2+几乎完全沉淀下来。若电解质溶液与KCl溶液反应产生沉淀,可用NH4NO3代替KCl作盐桥。
上述原电池装置是将什么反应的化学能转换成电能的?指出电池的正负极,并分别写出其中负极和正极的电极反应式以及该电池的总反应方程式。
负极(锌片):
Zn
-2e
-
=
Zn
2+
(氧化反应)
正极(铜片):
Cu2+
+
2e
-
=
Cu
(还原反应)
电池反应(总化学方程式):Zn
+
Cu2+
=
Zn
2+
+
Cu
电池符号:
Zn
︱
ZnSO4‖
CuSO4
︱
Cu
负极
盐桥
正极
二、由两个半电池组成原电池的工作原理
(1)把氧化反应和还原反应分开在不同区域进行,再以适当方式连接,可以获得电流。
①在这类电池中,用还原性较强的物质作为负极,负极向外电路提供电子;用氧化性较强的物质作为正极,正极从外电路得到电子。
②在原电池的内部,两极浸在电解质溶液中,并通过阴阳离子的定向运动而形成内电路。
(2)原电池的正负极的判断方法
电子流出的极
电子流入的极
——负极
——正极
较活泼的电极材料
较不活泼的电极材料
——负极
——正极
宏观判断:
①根据电极材料
②根据原电池电极
发生的反应
——负极
——正极
发生氧化反应的极
发生还原反应的极
③根据电极增重还是减重
④根据电极有气泡冒出:
质量增加的电极
工作后
质量减少的电极
——正极
——负极
工作后,有气泡冒出的电极为正极
(3)电解质溶液和电极材料的选择
(电池的电极必须导电)
电解质溶液一般要能够与负极发生反应。但若是两个半反应分别在两个烧杯中进行,则左右两个烧杯中的电解质溶液应
与电极材料具有相同的阳离子。
1、根据氧化还原反应电子转移判断电极反应。
2、根据电极反应确定合适的电极材料和电解质溶液
原电池的设计
利用Fe
+
Cu2+=Fe2+
+Cu,设计一个原电池.
Cu
Fe
CuSO4
FeSO4
化合价升高
失2e-
化合价降低
得2e-
思考讨论:
利用此氧化还原反应来设计原电池,写出电极反应式。并画出装置图
(Cu+
2
FeCl3
=
CuCl2+
2FeCl2)
化合价降低得2e-
Cu+
2
Fe3+
=
Cu2+
+
2Fe2+
化合价升高失2e-
Cu
C
CuCl2
FeCl3
装置图
离子方程式Cu+
2
Fe3+
=
Cu2+
+
2Fe2+
总结
1、复习回忆了原电池的形成。
2、进一步了解原电池的反应原理,正确书写电极反应式。
3、利用氧化还原反应原理设计了原电池。
1、下列装置中电流表指针会发生偏转的
是(
)
3
2、锌铜原电池产生电流时,阳离子(
)
A
移向Zn
极,阴离子移向Cu
极
B
移向Cu
极,阴离子移向Zn
极
C
和阴离子都移向Zn极
D
和阴离子都移向Cu
极
B
3、把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为
(
)
A.a
>
b
>
c
>
d
B.a
>
c
>
d
>
b
C.c
>
a
>
b
.>
d
D.b
>
d
>
c
>
a
B
4、如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是
A.
铁圈和银圈左右摇摆不定
B.
保持平衡状态
C.
铁圈向下倾斜,银圈向上倾斜
D.
银圈向下倾斜,铁圈向上倾斜
D
Cu+
2
AgNO3
=
Cu(NO3)2
+
2Ag
化合价升高失2e-
化合价降低得2e-
电极:负极是Cu,正极可以是Ag或C等。
电极反应式:
负极:Cu
–
2e-
=
Cu2+
正极:2Ag+
+
2e-
=
2
Ag
电解液:
Cu(NO3)2
、AgNO3
5、利用下面反应设计原电池选择电极材料和电解质溶液,写出电极方程式;并画出原电池简意图。
1.某原电池总反应式为:Cu+2Fe3+=Cu2++2Fe2+,能实现该反应的原电池是(
)
2.将镁片和铝片用导线相连,分别同时插入稀H2SO4和NaOH溶液中,写出两池中的电极反应式和电池反应式。
B
①Mg—Al—稀H2SO4原电池:
负极(Mg):Mg-2e-=Mg2+(氧化反应)
正极(Al):2H++2e-=H2↑(还原反应)
电池反应:Mg+2H+=Mg2++H2↑
②Al—Mg—NaOH原电池:
负极(Al):2Al-6e-+8OH-=2AlO2-+4H2O(氧化反应)
正极(Mg):6H2O+6e-=3H2↑+6OH-(还原反应)
电池反应:2Al+2OH-+2H2O=2AlO2-+3H2↑
A
B
C
D
电极材料
Cu、Zn
Cu、Ag
Cu、C
Fe、Zn
电解质溶液
FeCl3
Fe2(SO4)3
Fe(NO3)2
CuSO4
第四章
电化学基础
第一节
原
电
池
人教版选修4
·
化学反应原理
复习回顾
1、原电池是______________________的装置。
原电池反应的本质是_______________反应。
将化学能转化为电能
氧化还原反应
2、如右图所示,组成的原电池:
(1)当电解质溶液为稀H2SO4时:
Zn电极是____(填“正”或“负”)极,
其电极反应为_______________,该反应
是______(填“氧化”或“还原”,下同)反应;
Cu电极是______极,其电极反应为
_______________,该反应是_________反应。
(2)当电解质溶液为CuSO4溶液时:
Zn电极
是____极,其电极反应为_____________,
该反应是________反应;Cu电极是____极,
其电极反应为_______________,该反应是_________反应.
负
Zn
-2e
-
=
Zn
2+
氧化
正
2H+
+2e-
=H2↑
还原
负
Zn
-2e
-
=
Zn
2+
氧化
正
Cu2+
+
2e
-
=
Cu
还原
【实验验证化学能转化
为电能的客观事实】
3、原电池的工作原理
氧化还原反应(本质:反应物之间有电子转移)
[结论]把氧化反应和还原反应分开在不同的区域进行,再以适当的方式连接起来,就可以获得电流.
(可以)
(可以)
(可以)
(不可以)
形成条件一:
活泼性不同的两个电极
负极:较活泼的金属
正极:较不活泼的金属、石墨等
判断下列哪些装置能构成原电池。为什么?
形成条件二:电极需插进电解质溶液中;
形成条件三:必须形成闭合回路
(可以)
(不可以)
(可以)
(不可以)
(1)有两种活动性不同的金属(或一
种是非金属单质或金属氧化物)作电极。
(2)电极材料均插入电解质溶液中。
(3)两极相连形成闭合电路。
(4)内部条件:能自发进行氧化还
原反应。
4、组成原电池的条件
一、对锌铜原电
池工作原理的进一步探究
提出问题:
左图是原电池,如果用它做电源,不但效率低,而且时间稍长电流就很快减弱,因此不适合实际应用。这是什么原因造成的呢?有没有
什么改进措施?
造成的主要原因:由于锌片与硫酸铜溶液直
接接触,在反应一段时间后,难以避免溶液
中有铜离子在锌片表面直接还原,一旦有少
量的铜在锌片表面析出,即在负极(锌)表
面也构成了原电池,进一步加速铜在负极锌
表面析出,致使向外输出的电流强度减弱。
当锌片表面完全被铜覆盖后,不再构成原
电池了,也就没有电流在产生。
改进措施?
将锌片与硫酸铜溶液隔离
硫酸锌溶液
硫酸铜溶液
为了避免发生这种现象,设计如下图(书P71图4-1)所示的原电池装置,你能解释它的工作原理吗?
盐桥中通常装有含琼胶的KCl饱和溶液
此装置优点:能稳定长时间放电
盐桥在此的作用是什么?改进后的装置为什么能够持续、稳定的产生电流?
阅读教材72页
得出结论
盐桥的作用:
(1)使整个装置构成通路,代替两溶液直接接触。
(2)平衡电荷。
在整个装置的电流回路中,溶液中的电流通路是靠离子迁移完成的。Zn失去电子形成的Zn2+进入ZnSO4溶液,ZnSO4溶液因Zn2+增多而带正电荷。同时,CuSO4则由于Cu2+
变为Cu
,使得
SO42-相对较多而带负电荷。溶液不保持电中性,这两种因素均会阻止电子从锌片流向铜片,造成电流中断。
由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶液扩散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别中和过剩的电荷,保持溶液的电中性,因而放电作用不间断地进行,一直到锌片全部溶解或
CuSO4溶液中的
Cu2+几乎完全沉淀下来。若电解质溶液与KCl溶液反应产生沉淀,可用NH4NO3代替KCl作盐桥。
上述原电池装置是将什么反应的化学能转换成电能的?指出电池的正负极,并分别写出其中负极和正极的电极反应式以及该电池的总反应方程式。
负极(锌片):
Zn
-2e
-
=
Zn
2+
(氧化反应)
正极(铜片):
Cu2+
+
2e
-
=
Cu
(还原反应)
电池反应(总化学方程式):Zn
+
Cu2+
=
Zn
2+
+
Cu
电池符号:
Zn
︱
ZnSO4‖
CuSO4
︱
Cu
负极
盐桥
正极
二、由两个半电池组成原电池的工作原理
(1)把氧化反应和还原反应分开在不同区域进行,再以适当方式连接,可以获得电流。
①在这类电池中,用还原性较强的物质作为负极,负极向外电路提供电子;用氧化性较强的物质作为正极,正极从外电路得到电子。
②在原电池的内部,两极浸在电解质溶液中,并通过阴阳离子的定向运动而形成内电路。
(2)原电池的正负极的判断方法
电子流出的极
电子流入的极
——负极
——正极
较活泼的电极材料
较不活泼的电极材料
——负极
——正极
宏观判断:
①根据电极材料
②根据原电池电极
发生的反应
——负极
——正极
发生氧化反应的极
发生还原反应的极
③根据电极增重还是减重
④根据电极有气泡冒出:
质量增加的电极
工作后
质量减少的电极
——正极
——负极
工作后,有气泡冒出的电极为正极
(3)电解质溶液和电极材料的选择
(电池的电极必须导电)
电解质溶液一般要能够与负极发生反应。但若是两个半反应分别在两个烧杯中进行,则左右两个烧杯中的电解质溶液应
与电极材料具有相同的阳离子。
1、根据氧化还原反应电子转移判断电极反应。
2、根据电极反应确定合适的电极材料和电解质溶液
原电池的设计
利用Fe
+
Cu2+=Fe2+
+Cu,设计一个原电池.
Cu
Fe
CuSO4
FeSO4
化合价升高
失2e-
化合价降低
得2e-
思考讨论:
利用此氧化还原反应来设计原电池,写出电极反应式。并画出装置图
(Cu+
2
FeCl3
=
CuCl2+
2FeCl2)
化合价降低得2e-
Cu+
2
Fe3+
=
Cu2+
+
2Fe2+
化合价升高失2e-
Cu
C
CuCl2
FeCl3
装置图
离子方程式Cu+
2
Fe3+
=
Cu2+
+
2Fe2+
总结
1、复习回忆了原电池的形成。
2、进一步了解原电池的反应原理,正确书写电极反应式。
3、利用氧化还原反应原理设计了原电池。
1、下列装置中电流表指针会发生偏转的
是(
)
3
2、锌铜原电池产生电流时,阳离子(
)
A
移向Zn
极,阴离子移向Cu
极
B
移向Cu
极,阴离子移向Zn
极
C
和阴离子都移向Zn极
D
和阴离子都移向Cu
极
B
3、把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为
(
)
A.a
>
b
>
c
>
d
B.a
>
c
>
d
>
b
C.c
>
a
>
b
.>
d
D.b
>
d
>
c
>
a
B
4、如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是
A.
铁圈和银圈左右摇摆不定
B.
保持平衡状态
C.
铁圈向下倾斜,银圈向上倾斜
D.
银圈向下倾斜,铁圈向上倾斜
D
Cu+
2
AgNO3
=
Cu(NO3)2
+
2Ag
化合价升高失2e-
化合价降低得2e-
电极:负极是Cu,正极可以是Ag或C等。
电极反应式:
负极:Cu
–
2e-
=
Cu2+
正极:2Ag+
+
2e-
=
2
Ag
电解液:
Cu(NO3)2
、AgNO3
5、利用下面反应设计原电池选择电极材料和电解质溶液,写出电极方程式;并画出原电池简意图。
1.某原电池总反应式为:Cu+2Fe3+=Cu2++2Fe2+,能实现该反应的原电池是(
)
2.将镁片和铝片用导线相连,分别同时插入稀H2SO4和NaOH溶液中,写出两池中的电极反应式和电池反应式。
B
①Mg—Al—稀H2SO4原电池:
负极(Mg):Mg-2e-=Mg2+(氧化反应)
正极(Al):2H++2e-=H2↑(还原反应)
电池反应:Mg+2H+=Mg2++H2↑
②Al—Mg—NaOH原电池:
负极(Al):2Al-6e-+8OH-=2AlO2-+4H2O(氧化反应)
正极(Mg):6H2O+6e-=3H2↑+6OH-(还原反应)
电池反应:2Al+2OH-+2H2O=2AlO2-+3H2↑
A
B
C
D
电极材料
Cu、Zn
Cu、Ag
Cu、C
Fe、Zn
电解质溶液
FeCl3
Fe2(SO4)3
Fe(NO3)2
CuSO4
