人教版高一化学必修一2.2离子反应1 课件 (共25张PPT)
文档属性
| 名称 | 人教版高一化学必修一2.2离子反应1 课件 (共25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 447.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-26 14:38:20 | ||
图片预览








文档简介
(共25张PPT)
第二节
离子反应
生活中的问题
湿手更易触电,原因是什么?
【触电原因】
……潮湿的空气导电,不纯的水导电——湿手触开关或浴室触电
【注意事项】
……不用湿手板开关、换灯泡,插、拔插头
不站在潮湿的桌椅上接触火线…
——引自初三物理“用电安全”
问:
①根据初中所学的知识,哪些物质在什
么情况下可以电离出自由移动的离子?
②可通过什么方法检验这些物质是否电
离?
小结:
1、酸、碱、盐的水溶液可以电离出自
由移动的离子。
2、可通过其水溶液是否导电来检验物
质是否电离出自由移动的离子
一、电解质和非电解质:
电解质:在水溶液里或熔融状态下能
够导电的化合物。
非电解质:在水溶液里或熔融状态下
能够导电的化合物。
如:酸、碱、盐和水、活泼金属氧化物
如:非金属氧化物、大多数有机物(蔗糖、
酒精)和氨
想一想:
下列物质哪些是电解质?哪些是非电解
质?哪些能导电?
①金属铜
②固态NaCl
③O2
④H2SO4
⑤碳棒
⑥酒精水溶液
⑦KOH溶液
⑧熔融状态的KNO3⑨葡萄糖⑩NaCl溶液
电解质:②④⑧
非电解质:⑨
能导电:①⑤⑦⑧⑩
启示:
1、能够导电的物质不一定全是电解质。
2、电解质必须在水溶液里或熔化状态
下才能有自由移动的离子,才能导电。
3、单质既不是电解质也不是非电解质
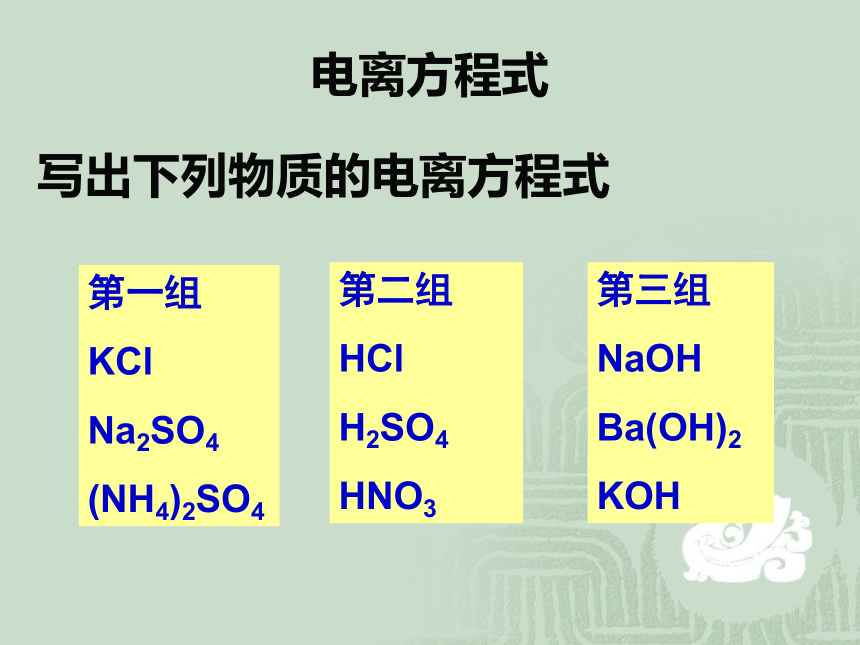
电离方程式
写出下列物质的电离方程式
第一组
KCl
Na2SO4
(NH4)2SO4
第二组
HCl
H2SO4
HNO3
第三组
NaOH
Ba(OH)2
KOH
二、强电解质和弱电解质:
强电解质:在水溶液里全部电离成离子的
电解质。
弱电解质:在水溶液里只有部分分子电
离成离子的电解质。
如:强酸、强碱和大多数的盐
如:弱酸、弱碱还有水
几种电解质溶液的导电能力有什么不同?
为什么?
1、溶液导电能力强弱与单位体积溶液中
离子的多少和离子所带电荷数有关。
2、在溶液的体积、浓度以及溶液中阴(或
阳)离子所带的电荷数都相同的情况下,
导电能力强的溶液里能够自由移动的离
子数目一定比导电能力弱的溶液里能够
自由移动的离子数目多。
离子化合物,
某些共价化合物
某些共价化合物
完全
部分
离子
分子、离子
强
弱
大多数盐、强酸、
强碱
弱酸、弱碱、水
强电解质
弱电解质
物质结构
电离程度
溶液时
微粒
导电性
类别
三、离子反应:
CuSO4溶液与BaCl2溶液进行离子反应的实质是:
SO42-
+
Ba2+
==
BaSO4↓
用实际参加反应的离子符号表示离子
反应的式子叫离子方程式。
如何正确书写离子方程式?
1、写出化学方程式:
例:2AgNO3
+
CuCl2
==
2AgCl↓+
Cu(NO3)2
2、把易溶于水、易电离的物质写成离子形式,
难溶或难电离的物质以及气体等仍用化学
式表示。
2Ag++2NO3-+Cu2++2Cl-
==
2AgCl↓+Cu2++2NO3-
3、删去方程式两边形式相同的离子:
2Ag++2NO3-+Cu2++2Cl-
==
2AgCl↓+Cu2++2NO3-
4、整理方程式并检查两边各元素的原子
个数和电荷总数是否相等:
2Ag+
+
2Cl-
==
2AgCl↓
Ag+
+
Cl-
==
AgCl↓
练一练:
用离子方程式表示下列反应:
1、盐酸与氢氧化钠溶液中和
H+
+
OH-
==
H2O
2、硫酸中加入氢氧化钾溶液
H+
+
OH-
==
H2O
3、澄清石灰水中滴入硝酸
H+
+
OH-
==
H2O
4、氢氧化铜溶于盐酸
Cu(OH)2
+
2H+
==
Cu2+
+
2H2O
启示:
离子方程式不仅可表示一定物质间
的某个反应,而且可表示所有同一
类型的离子反应。
例:书本
P17
练:把下列化学方程式改写成离子方程式:
1.2FeCl2+Cl2==2FeCl3
2Fe2++Cl2==2Fe3++2Cl-
2.Br2+SO2+2H2O==2HBr+H2SO4
Br2+SO2+2H2O==4H++2Br-+SO42-
3.KClO3+6HCl==3Cl2↑+KCl+3H2O
ClO3-+5Cl-+6H+==3Cl2↑+3H2O
溶液中常见的离子反应:
离子互换的非氧化还原反应:
——有难溶物、难电离物及挥发
性物质
离子间的氧化还原反应:
——氧化剂、还原剂越强,离子
反应越完全
书写离子方程式应注意的问题:
⑴凡非溶液中进行的反应一般不能写
离子方程式。
⑵单质、氧化物在离子方程式中一律写
化学式;弱酸(HF、H2S、HClO、H2SO3
等)、弱碱(NH3·H2O)等难电离物质写
化学式;难溶于水的物质(如CaCO3、
BaSO3、FeS、BaSO4、Fe(OH)3等)写化
学式。
练:写出下列反应的离子方程式:
1、SO2气体溶于足量氢氧化钠溶液
SO2
+
2OH-
==
SO32-
+
H2O
2、向氨水中加入稀盐酸
NH3·H2O+H+==NH4++H2O
3、碳酸氢钙溶液与盐酸反应
HCO3-+H+==H2O+CO2↑
⑶多元弱酸的酸式盐的酸根离子在离
子方程式中不能拆开写。
例:1、NaHCO3与盐酸反应:
HCO3-+H+==H2O+CO2↑
2、KHSO4与BaCl2反应:
SO42-+Ba2+==BaSO4↓
⑷对于微溶物的处理:
①在生成物中有微溶物,微溶物用化
学式。
②当反应物里有微溶物处于溶液状态
(稀溶液),应写成离子形式。
③当反应物里有微溶物处于浊液或固
态,应写化学式。
⑸操作顺序或反应物相对量不同时
离子方程式不同。
例:1、少量烧碱滴入Ca(HCO3)2溶液
Ca2++HCO3-+OH-==CaCO3↓+H2O
2、足量烧碱滴入Ca(HCO3)2溶液
Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O
思考:NaHCO3溶液与Ca(OH)2溶液混合?
KHSO4溶液与Ba(OH)2溶液混合?
1、⑴NaHCO3少量时:
Ca2++HCO3-+OH-==CaCO3↓+H2O
⑵
NaHCO3过量时:
Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O
2、⑴KHSO4少量时:
Ba2++SO42-+H++OH-==BaSO4
↓
+H2O
⑵
KHSO4过量时:
Ba2++SO42-+2H++2OH-==BaSO4↓+2H2O
第二节
离子反应
生活中的问题
湿手更易触电,原因是什么?
【触电原因】
……潮湿的空气导电,不纯的水导电——湿手触开关或浴室触电
【注意事项】
……不用湿手板开关、换灯泡,插、拔插头
不站在潮湿的桌椅上接触火线…
——引自初三物理“用电安全”
问:
①根据初中所学的知识,哪些物质在什
么情况下可以电离出自由移动的离子?
②可通过什么方法检验这些物质是否电
离?
小结:
1、酸、碱、盐的水溶液可以电离出自
由移动的离子。
2、可通过其水溶液是否导电来检验物
质是否电离出自由移动的离子
一、电解质和非电解质:
电解质:在水溶液里或熔融状态下能
够导电的化合物。
非电解质:在水溶液里或熔融状态下
能够导电的化合物。
如:酸、碱、盐和水、活泼金属氧化物
如:非金属氧化物、大多数有机物(蔗糖、
酒精)和氨
想一想:
下列物质哪些是电解质?哪些是非电解
质?哪些能导电?
①金属铜
②固态NaCl
③O2
④H2SO4
⑤碳棒
⑥酒精水溶液
⑦KOH溶液
⑧熔融状态的KNO3⑨葡萄糖⑩NaCl溶液
电解质:②④⑧
非电解质:⑨
能导电:①⑤⑦⑧⑩
启示:
1、能够导电的物质不一定全是电解质。
2、电解质必须在水溶液里或熔化状态
下才能有自由移动的离子,才能导电。
3、单质既不是电解质也不是非电解质
电离方程式
写出下列物质的电离方程式
第一组
KCl
Na2SO4
(NH4)2SO4
第二组
HCl
H2SO4
HNO3
第三组
NaOH
Ba(OH)2
KOH
二、强电解质和弱电解质:
强电解质:在水溶液里全部电离成离子的
电解质。
弱电解质:在水溶液里只有部分分子电
离成离子的电解质。
如:强酸、强碱和大多数的盐
如:弱酸、弱碱还有水
几种电解质溶液的导电能力有什么不同?
为什么?
1、溶液导电能力强弱与单位体积溶液中
离子的多少和离子所带电荷数有关。
2、在溶液的体积、浓度以及溶液中阴(或
阳)离子所带的电荷数都相同的情况下,
导电能力强的溶液里能够自由移动的离
子数目一定比导电能力弱的溶液里能够
自由移动的离子数目多。
离子化合物,
某些共价化合物
某些共价化合物
完全
部分
离子
分子、离子
强
弱
大多数盐、强酸、
强碱
弱酸、弱碱、水
强电解质
弱电解质
物质结构
电离程度
溶液时
微粒
导电性
类别
三、离子反应:
CuSO4溶液与BaCl2溶液进行离子反应的实质是:
SO42-
+
Ba2+
==
BaSO4↓
用实际参加反应的离子符号表示离子
反应的式子叫离子方程式。
如何正确书写离子方程式?
1、写出化学方程式:
例:2AgNO3
+
CuCl2
==
2AgCl↓+
Cu(NO3)2
2、把易溶于水、易电离的物质写成离子形式,
难溶或难电离的物质以及气体等仍用化学
式表示。
2Ag++2NO3-+Cu2++2Cl-
==
2AgCl↓+Cu2++2NO3-
3、删去方程式两边形式相同的离子:
2Ag++2NO3-+Cu2++2Cl-
==
2AgCl↓+Cu2++2NO3-
4、整理方程式并检查两边各元素的原子
个数和电荷总数是否相等:
2Ag+
+
2Cl-
==
2AgCl↓
Ag+
+
Cl-
==
AgCl↓
练一练:
用离子方程式表示下列反应:
1、盐酸与氢氧化钠溶液中和
H+
+
OH-
==
H2O
2、硫酸中加入氢氧化钾溶液
H+
+
OH-
==
H2O
3、澄清石灰水中滴入硝酸
H+
+
OH-
==
H2O
4、氢氧化铜溶于盐酸
Cu(OH)2
+
2H+
==
Cu2+
+
2H2O
启示:
离子方程式不仅可表示一定物质间
的某个反应,而且可表示所有同一
类型的离子反应。
例:书本
P17
练:把下列化学方程式改写成离子方程式:
1.2FeCl2+Cl2==2FeCl3
2Fe2++Cl2==2Fe3++2Cl-
2.Br2+SO2+2H2O==2HBr+H2SO4
Br2+SO2+2H2O==4H++2Br-+SO42-
3.KClO3+6HCl==3Cl2↑+KCl+3H2O
ClO3-+5Cl-+6H+==3Cl2↑+3H2O
溶液中常见的离子反应:
离子互换的非氧化还原反应:
——有难溶物、难电离物及挥发
性物质
离子间的氧化还原反应:
——氧化剂、还原剂越强,离子
反应越完全
书写离子方程式应注意的问题:
⑴凡非溶液中进行的反应一般不能写
离子方程式。
⑵单质、氧化物在离子方程式中一律写
化学式;弱酸(HF、H2S、HClO、H2SO3
等)、弱碱(NH3·H2O)等难电离物质写
化学式;难溶于水的物质(如CaCO3、
BaSO3、FeS、BaSO4、Fe(OH)3等)写化
学式。
练:写出下列反应的离子方程式:
1、SO2气体溶于足量氢氧化钠溶液
SO2
+
2OH-
==
SO32-
+
H2O
2、向氨水中加入稀盐酸
NH3·H2O+H+==NH4++H2O
3、碳酸氢钙溶液与盐酸反应
HCO3-+H+==H2O+CO2↑
⑶多元弱酸的酸式盐的酸根离子在离
子方程式中不能拆开写。
例:1、NaHCO3与盐酸反应:
HCO3-+H+==H2O+CO2↑
2、KHSO4与BaCl2反应:
SO42-+Ba2+==BaSO4↓
⑷对于微溶物的处理:
①在生成物中有微溶物,微溶物用化
学式。
②当反应物里有微溶物处于溶液状态
(稀溶液),应写成离子形式。
③当反应物里有微溶物处于浊液或固
态,应写化学式。
⑸操作顺序或反应物相对量不同时
离子方程式不同。
例:1、少量烧碱滴入Ca(HCO3)2溶液
Ca2++HCO3-+OH-==CaCO3↓+H2O
2、足量烧碱滴入Ca(HCO3)2溶液
Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O
思考:NaHCO3溶液与Ca(OH)2溶液混合?
KHSO4溶液与Ba(OH)2溶液混合?
1、⑴NaHCO3少量时:
Ca2++HCO3-+OH-==CaCO3↓+H2O
⑵
NaHCO3过量时:
Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O
2、⑴KHSO4少量时:
Ba2++SO42-+H++OH-==BaSO4
↓
+H2O
⑵
KHSO4过量时:
Ba2++SO42-+2H++2OH-==BaSO4↓+2H2O
