苏教化学必修1专题1第一单元丰富多彩的化学物质(共27张PPT)
文档属性
| 名称 | 苏教化学必修1专题1第一单元丰富多彩的化学物质(共27张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-26 00:00:00 | ||
图片预览








文档简介
(共27张PPT)
复习:
1、在同温同压下,同质量的下列气体占有的
体积由大到小的顺序是
①Cl2
②N2
③H2
④CO2
⑤O2
(③②⑤④①)
2、下列说法正确的是(NA为阿伏加德罗常数的值)
A常温、常压下,11.2
L
N2含有的分子数为0.5NA
B常温常压下,1mol氦气含有的原子数为2NA
C
17gNH3所含原子数为10NA
D在同温、同压下,相同体积的任何气体单质所含分子数和原子数都相同
C
四、物质的分散系
专题1
化学家眼中的物质世界
第一单元
丰富多彩的化学物质
主要内容
一.分散系
二.胶体
三.电解质和非电解质
四.电离方程式
试试看:
根据下列的分类各举几例:
溶液:
悬浊液:
乳浊液:
想一想:它们有什么共同特点?
盐水、糖水、双氧水、硫酸铜溶液等
泥水、石灰浆、硫酸钡与水混合
油水混合、苯与水混合
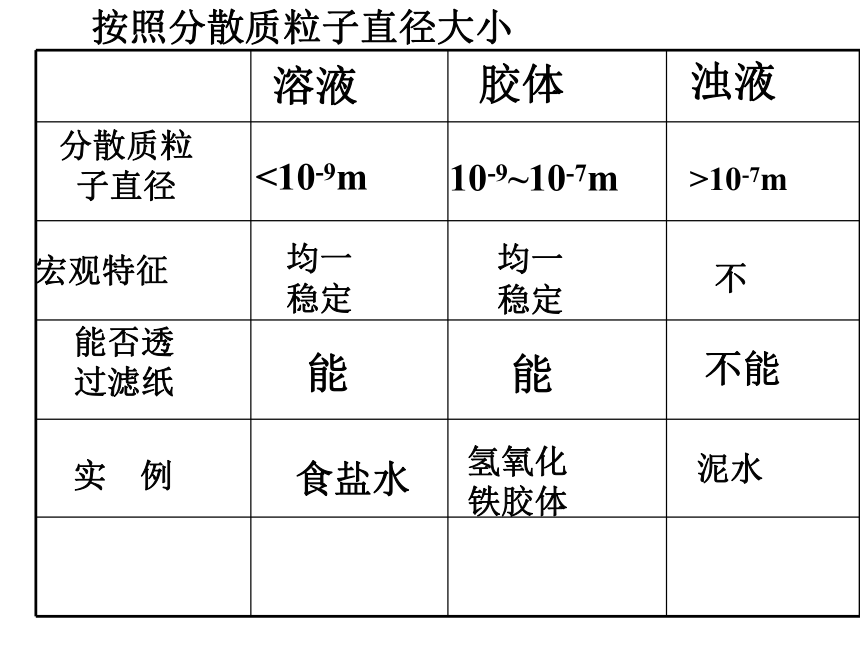
一、分散系
1、定义:一种或几种物质分散到另一种物质中形成的混合物
分散系
分散质
分散剂
被分散成微粒的物质
起容纳分散质作用的物质
溶液
胶体
浊液
分散质粒
子直径
宏观特征
能否透
过滤纸
实
例
<10-9m
>10-7m
10-9~10-7m
均一
稳定
均一
稳定
不
能
能
不能
食盐水
氢氧化
铁胶体
泥水
按照分散质粒子直径大小
二
胶体
1、定义:分散质微粒直径大小在10-9~10-7m(1-100nm)之间的分散系。
烟、云、雾,豆浆、血液、肥皂水、墨水、有色玻璃、含有灰尘颗粒的空气
几种常见的胶体
豆浆
肥皂水
液溶胶
气
溶
胶
固
溶
胶
1、丁达尔效应(区别溶液与胶体)
2.
吸附性
胶体具有吸附性,能够吸附水中的悬浮物并使之沉降,具有净水作用。
如:Fe(OH)3胶体和Al(OH)3胶体
此外,还可用于制有色玻璃、制胶体火药、胶态磁流体用于治癌。(参考课本P14)
1、胶体和其他分散系(溶液、浊液)的本质区别是
(
)
A、分散质粒子的直径
B、是不是一种稳定的体系
C、会不会产生丁达乐效应
D、粒子有没有带电荷
A
【问题解决】
2、“纳米材料”是粒子直径为1~100nm(纳米)的材料,纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质(
)。
①是溶液
②是胶体
③能产生丁达尔效应
④静置后会出现黑色沉淀
A.①④
B.②③④
C.②③
D.①③④
C
【问题解决】
在水溶液中或熔融状态下能导电的化合物
在水溶液中和熔融状态下都不能导电的化合物
电解质:
非电解质:
三、电解质和非电解质
注意:
(1)电解质、非电解质应是化合物。
Cu、NaCl溶液既不是电解质也不是非电解质
(2)水溶液里或熔融状态下。
(3)电解质必须是该化合物本身能电离出自
由移动的离子而导电。
像CO2、SO2
这样的酸性氧化物不是电解质,
CaO、Na2O是电解质。(熔融能导电)
1.判断下列说法是否正确
A
:Cu能导电,所以Cu是电解质;
B:NaCl溶液导电,所以NaCl溶液是电解质;
C:固体NaCl不导电,但NaCl是电解质;
D:SO3溶于水得到H2SO4溶液,H2SO4溶液
具有导电性,所以SO3是电解质;
E:BaSO4的水溶液不导电,所以BaSO4是非电
解质。
√
×
×
×
×
2.下列物质:
(1)液态氯化氢
(2)CuO
(3)熔融MgCl2
(4)胆矾晶体
(5)食盐水
(6)酒精
(7)氨水
(8)液氨
(9)汞
(10)BaSO4
(11)SO3
(12)石墨
其中能导电的物质有
,
属于电解质的是
,
属于非电解质的是
。
3、5、7、9、12
1、2、3、4、10
6、8、11
常见的电解质:
1、酸:HCl、H2SO4、HNO3等
2、碱:NaOH、Ca(OH)2、Ba(OH)2等
3、盐:NaCl、Na2CO3、NaHO3、BaSO4
等
4、金属氧化物:CuO、Fe2O3等
常见的非电解质:
1、大多数有机物:蔗糖、酒精等
2、非金属氧化物:CO2、SO2、SO3
等
3、NH3
1、下列叙述正确的是(
)
A、在水溶液中能电离出自由移动的离子的化合物是电解质
B、凡是在水溶液里和受热熔化状态下都不导电的物质叫非电解质
C、能导电的物质一定是电解质
D、某物质若不是电解质就一定是非电解质
课堂练习
A
2、下列叙述正确的是(
)
A、液态HCl不导电,所以HCl不是电解质
B、NH3的水溶液能导电,所以NH3是电解质
C、Cu不是电解质,所以它是非电解质
D、BaSO4
难溶于水,但熔融状态下可以电离
出自由移动的离子从而导电所以BaSO4是电解质
课堂练习
D
四.电离方程式
氯化钠溶于水发生电离
电离:电解质在水溶液中或熔融状态下产生自由移动的离子的过程。
表示方法:电离方程式
KNO3=
K+
+
NO3-
NaOH=Na+
+
OH-
四.电离方程式
HCl
=
H+
+
Cl-
电离方程式书写原则:
1
方程式前后原子个数守恒
2
方程式中正负电荷代数和为0
3
原子团不能拆开写(例:HCO3
-
OH-
SO42-),
HSO4-除外
NaHCO3=Na+
+
HCO3
-
NaHSO4=Na+
+H+
+SO42-
课堂练习
1、写出下列物质的电离方程式。
KCl、KOH
、CaCl2
、
Ba(OH)2、
HCl、
Na2CO3
、
H2O
Na2CO3
=
2Na+
+
CO3
2-
KCl
=
K+
+
Cl-
HCl
=
H+
+
Cl-
KOH=K+
+
OH-
Ba(OH)2=Ba2+
+
2OH-
CaCl2
=
Ca2+
+
2Cl-
H2O=H++OH-
2、下列电离方程式错误的是(
)
A.Al2(SO4)3=2Al3+
+
SO42-
B.(NH4)2CO3=2NH4++CO32-
C.Ca(OH)2=
Ca2+
+
2OH-
D.K2SO4=K+2+
SO42-
AD
课堂总结
一.分散性
二.胶体
三.电解质和非电解质
四.电离方程式
复习:
1、在同温同压下,同质量的下列气体占有的
体积由大到小的顺序是
①Cl2
②N2
③H2
④CO2
⑤O2
(③②⑤④①)
2、下列说法正确的是(NA为阿伏加德罗常数的值)
A常温、常压下,11.2
L
N2含有的分子数为0.5NA
B常温常压下,1mol氦气含有的原子数为2NA
C
17gNH3所含原子数为10NA
D在同温、同压下,相同体积的任何气体单质所含分子数和原子数都相同
C
四、物质的分散系
专题1
化学家眼中的物质世界
第一单元
丰富多彩的化学物质
主要内容
一.分散系
二.胶体
三.电解质和非电解质
四.电离方程式
试试看:
根据下列的分类各举几例:
溶液:
悬浊液:
乳浊液:
想一想:它们有什么共同特点?
盐水、糖水、双氧水、硫酸铜溶液等
泥水、石灰浆、硫酸钡与水混合
油水混合、苯与水混合
一、分散系
1、定义:一种或几种物质分散到另一种物质中形成的混合物
分散系
分散质
分散剂
被分散成微粒的物质
起容纳分散质作用的物质
溶液
胶体
浊液
分散质粒
子直径
宏观特征
能否透
过滤纸
实
例
<10-9m
>10-7m
10-9~10-7m
均一
稳定
均一
稳定
不
能
能
不能
食盐水
氢氧化
铁胶体
泥水
按照分散质粒子直径大小
二
胶体
1、定义:分散质微粒直径大小在10-9~10-7m(1-100nm)之间的分散系。
烟、云、雾,豆浆、血液、肥皂水、墨水、有色玻璃、含有灰尘颗粒的空气
几种常见的胶体
豆浆
肥皂水
液溶胶
气
溶
胶
固
溶
胶
1、丁达尔效应(区别溶液与胶体)
2.
吸附性
胶体具有吸附性,能够吸附水中的悬浮物并使之沉降,具有净水作用。
如:Fe(OH)3胶体和Al(OH)3胶体
此外,还可用于制有色玻璃、制胶体火药、胶态磁流体用于治癌。(参考课本P14)
1、胶体和其他分散系(溶液、浊液)的本质区别是
(
)
A、分散质粒子的直径
B、是不是一种稳定的体系
C、会不会产生丁达乐效应
D、粒子有没有带电荷
A
【问题解决】
2、“纳米材料”是粒子直径为1~100nm(纳米)的材料,纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质(
)。
①是溶液
②是胶体
③能产生丁达尔效应
④静置后会出现黑色沉淀
A.①④
B.②③④
C.②③
D.①③④
C
【问题解决】
在水溶液中或熔融状态下能导电的化合物
在水溶液中和熔融状态下都不能导电的化合物
电解质:
非电解质:
三、电解质和非电解质
注意:
(1)电解质、非电解质应是化合物。
Cu、NaCl溶液既不是电解质也不是非电解质
(2)水溶液里或熔融状态下。
(3)电解质必须是该化合物本身能电离出自
由移动的离子而导电。
像CO2、SO2
这样的酸性氧化物不是电解质,
CaO、Na2O是电解质。(熔融能导电)
1.判断下列说法是否正确
A
:Cu能导电,所以Cu是电解质;
B:NaCl溶液导电,所以NaCl溶液是电解质;
C:固体NaCl不导电,但NaCl是电解质;
D:SO3溶于水得到H2SO4溶液,H2SO4溶液
具有导电性,所以SO3是电解质;
E:BaSO4的水溶液不导电,所以BaSO4是非电
解质。
√
×
×
×
×
2.下列物质:
(1)液态氯化氢
(2)CuO
(3)熔融MgCl2
(4)胆矾晶体
(5)食盐水
(6)酒精
(7)氨水
(8)液氨
(9)汞
(10)BaSO4
(11)SO3
(12)石墨
其中能导电的物质有
,
属于电解质的是
,
属于非电解质的是
。
3、5、7、9、12
1、2、3、4、10
6、8、11
常见的电解质:
1、酸:HCl、H2SO4、HNO3等
2、碱:NaOH、Ca(OH)2、Ba(OH)2等
3、盐:NaCl、Na2CO3、NaHO3、BaSO4
等
4、金属氧化物:CuO、Fe2O3等
常见的非电解质:
1、大多数有机物:蔗糖、酒精等
2、非金属氧化物:CO2、SO2、SO3
等
3、NH3
1、下列叙述正确的是(
)
A、在水溶液中能电离出自由移动的离子的化合物是电解质
B、凡是在水溶液里和受热熔化状态下都不导电的物质叫非电解质
C、能导电的物质一定是电解质
D、某物质若不是电解质就一定是非电解质
课堂练习
A
2、下列叙述正确的是(
)
A、液态HCl不导电,所以HCl不是电解质
B、NH3的水溶液能导电,所以NH3是电解质
C、Cu不是电解质,所以它是非电解质
D、BaSO4
难溶于水,但熔融状态下可以电离
出自由移动的离子从而导电所以BaSO4是电解质
课堂练习
D
四.电离方程式
氯化钠溶于水发生电离
电离:电解质在水溶液中或熔融状态下产生自由移动的离子的过程。
表示方法:电离方程式
KNO3=
K+
+
NO3-
NaOH=Na+
+
OH-
四.电离方程式
HCl
=
H+
+
Cl-
电离方程式书写原则:
1
方程式前后原子个数守恒
2
方程式中正负电荷代数和为0
3
原子团不能拆开写(例:HCO3
-
OH-
SO42-),
HSO4-除外
NaHCO3=Na+
+
HCO3
-
NaHSO4=Na+
+H+
+SO42-
课堂练习
1、写出下列物质的电离方程式。
KCl、KOH
、CaCl2
、
Ba(OH)2、
HCl、
Na2CO3
、
H2O
Na2CO3
=
2Na+
+
CO3
2-
KCl
=
K+
+
Cl-
HCl
=
H+
+
Cl-
KOH=K+
+
OH-
Ba(OH)2=Ba2+
+
2OH-
CaCl2
=
Ca2+
+
2Cl-
H2O=H++OH-
2、下列电离方程式错误的是(
)
A.Al2(SO4)3=2Al3+
+
SO42-
B.(NH4)2CO3=2NH4++CO32-
C.Ca(OH)2=
Ca2+
+
2OH-
D.K2SO4=K+2+
SO42-
AD
课堂总结
一.分散性
二.胶体
三.电解质和非电解质
四.电离方程式
