乙醇课件
图片预览







文档简介
(共28张PPT)
生活中的两种有机物
第一课时 乙醇
煮酒论英雄
明月几时有,把酒问青天
中华民族灿烂的文化史上记载许多与酒有关的典故和诗文。
各种饮用酒里都含有酒精
啤酒含酒精:3% - 5%
葡萄酒含酒精:6% - 20%
黄酒含酒精:8% - 15%
白酒含酒精:38% - 65%
气 味 :
无色透明
特殊香味
液体
比水小
跟水以任意比互溶
能够溶解多种无机物和有机物
易挥发(好酒不怕巷子深)
一、乙醇的物理性质
颜 色 :
溶解性:
密 度:
挥发性:
状 态:
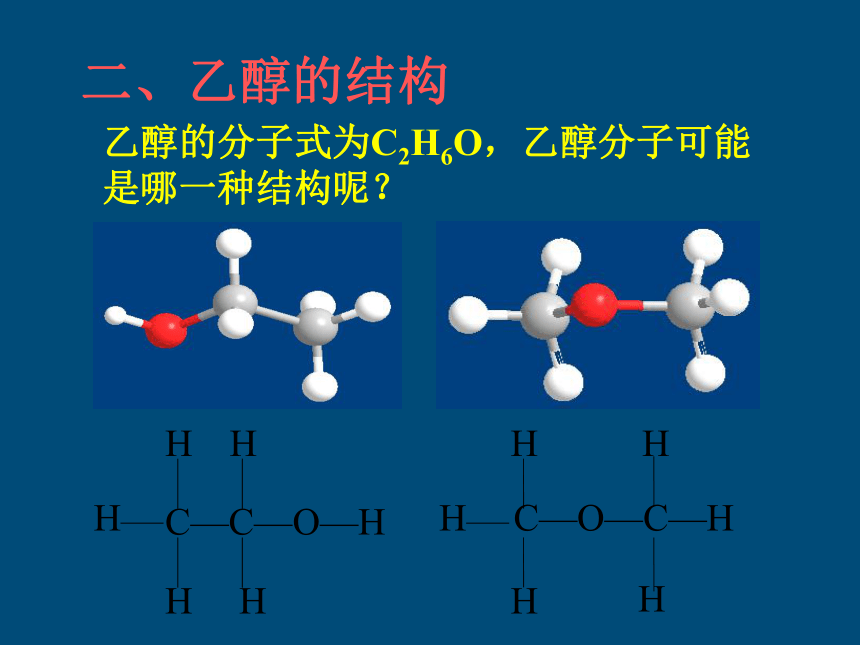
乙醇的分子式为C2H6O,乙醇分子可能是哪一种结构呢?
C—C—O—H
H
H
H
H
H
C—O—C—H
H
H
H
H
H
二、乙醇的结构
实验 1 钠与乙醇的反应
实验仪器: 试管 镊子
实验药品: 金属钠 无水乙醇
实验步骤: 取一小块金属钠,用滤纸将表面的煤油吸干净,然后投入盛有约5mL乙醇的试管中,观察现象。
现 象
钠与水的反应 乙醇与钠的反应
钠浮在水面上
钠沉在乙醇底部
钠熔化成小亮球
缓慢放出气泡
钠在水面来回游动
发出嘶嘶的响声
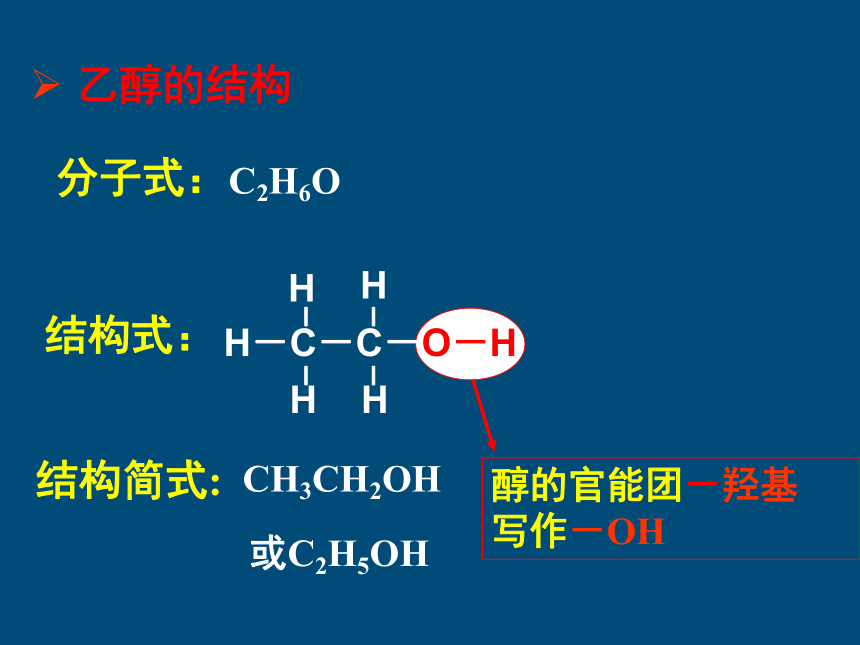
结构式:
结构简式:
CH3CH2OH
或C2H5OH
分子式:
C2H6O
乙醇的结构
醇的官能团-羟基
写作-OH
H-C-C-O-H
-
H
-
-
-
H
H
H
烃的衍生物: 烃分子中的氢原子被其他原子或 原子团所取代而生成的一系列化合物。
官能团: 决定有机化合物的化学特性的原子或原子团.
C
H
H
H
C
O
H
H
H
①
该反应属于 反应。
取代
①处O—H
键断开
三、乙醇的化学性质
1、乙醇与金属钠的反应
2CH3CH2O H + 2Na → 2CH3CH2ONa +H2↑
2Na+2H2O=2NaOH+H2
2、乙醇的氧化反应
①乙醇的燃烧
C2H5OH+3O2 2CO2+3H2O
点燃
实验室里也常用它作为燃料。
乙醇可用作内燃机的燃料,
现象:乙醇在空气中燃烧,火焰呈淡蓝色。同时放出大量的热。
实验2 乙醇催化氧化反应
(1)将铜丝在酒精灯的外焰加热,观察现象,描述上述变化。
(2)将铜丝由外焰向内焰移动,观察铜丝的变化。你能解释变化的原因吗?
(3)将铜丝红热,插入乙醇中,反复几次。观察铜丝的变化,小心闻试管中液体产生的气味。
乙醇的化学性质
2Cu+O2 2CuO
红色→黑色
黑色→红色
C2H5OH+CuO CH3CHO+H2O+Cu
总反应方程式:
乙醛
刺激性气味液体
注意:铜丝在实验中是催化剂
2C2H5OH+O2 2CH3CHO+2H2O
Cu
△
△
△
(2)乙醇的催化氧化
醇催化氧化机理:
H
C
H
H
O
H
C
H
H
①
④
③
②
与 —OH相连的碳上必须有H
想一想
催化氧化的结构特点
C
H
H
H
C
H
H
O
H
C
H
H
(丙醇)催化氧化的产物?断的哪两个键?
①
②
④
③
⑤
练一练
CH3
CH3 C OH
CH3
?
C—C—O—H
H
H
H
H
H
①
②
③
④
三、乙醇的化学性质
(1)与活泼金属反应
(2) 氧化反应
燃烧
催化氧化
小 结
一、乙醇的物理性质
二、乙醇的分子结构
①
①③
全部
四、乙醇的用途
(1)作燃料,制造饮料和香精
(2)是一种重要的有机化工原料如用
乙 醇制造乙酸、乙醚等。
(3)乙醇又是一种有机溶剂,用于溶解
树脂,制造涂料。
(4)医疗上常用75%(体积分数)的酒
精作消毒剂。
身边的化学Ⅰ
酒精的快速检测:
让驾车人呼出的气体接触载有经过硫酸酸化处理的氧化剂
重铬酸钾的硅胶,可测出呼出的气体中是否含有乙醇及乙
醇含量的高低。
世界卫生组织的事故调查显示,大约50%-60%的交通事故与酒后驾驶有关。
驾驶员正在接受酒精检查
K2Cr2O7
(橙红色)
Cr2(SO4)3
(绿色)
乙醇
酒精检测的原理
身边的化学Ⅱ
酒精中毒:酒精在人体内的代谢速率是有限的,
如果一个人饮酒的速率大于体内代谢的速率,
酒精就会在体内器官,特别是在肝脏和大脑中
积蓄,积蓄至一定程度即出现酒精中毒症状。
1.把铜丝放在酒精灯火焰是加热,可看到铜丝
表面生成( )色的( ),再迅速把铜丝插入盛有乙醇的试管里,看到铜丝表面颜色变( ),反复多次,试管内有( )
气味的( )生成,反应中乙醇被( ) (氧化,还原)
黑 氧化铜
红
刺激性
乙醛
氧化
2.把质量为mg的铜丝灼烧变成黑色,立即放入下列物质中,使铜丝变成红色,而且质量仍为mg的是( )
A.稀H2SO4 B.C2H5OH C.Ca(OH)2溶液 D.CO
3.下列试剂中,能用于检验酒精中是否含有水的事( )
A.硫酸铜晶体 B.浓硫酸 C.无水硫酸铜 D.钠
BD
C
讨论
乙醇的功过是非
生活中的两种有机物
第一课时 乙醇
煮酒论英雄
明月几时有,把酒问青天
中华民族灿烂的文化史上记载许多与酒有关的典故和诗文。
各种饮用酒里都含有酒精
啤酒含酒精:3% - 5%
葡萄酒含酒精:6% - 20%
黄酒含酒精:8% - 15%
白酒含酒精:38% - 65%
气 味 :
无色透明
特殊香味
液体
比水小
跟水以任意比互溶
能够溶解多种无机物和有机物
易挥发(好酒不怕巷子深)
一、乙醇的物理性质
颜 色 :
溶解性:
密 度:
挥发性:
状 态:
乙醇的分子式为C2H6O,乙醇分子可能是哪一种结构呢?
C—C—O—H
H
H
H
H
H
C—O—C—H
H
H
H
H
H
二、乙醇的结构
实验 1 钠与乙醇的反应
实验仪器: 试管 镊子
实验药品: 金属钠 无水乙醇
实验步骤: 取一小块金属钠,用滤纸将表面的煤油吸干净,然后投入盛有约5mL乙醇的试管中,观察现象。
现 象
钠与水的反应 乙醇与钠的反应
钠浮在水面上
钠沉在乙醇底部
钠熔化成小亮球
缓慢放出气泡
钠在水面来回游动
发出嘶嘶的响声
结构式:
结构简式:
CH3CH2OH
或C2H5OH
分子式:
C2H6O
乙醇的结构
醇的官能团-羟基
写作-OH
H-C-C-O-H
-
H
-
-
-
H
H
H
烃的衍生物: 烃分子中的氢原子被其他原子或 原子团所取代而生成的一系列化合物。
官能团: 决定有机化合物的化学特性的原子或原子团.
C
H
H
H
C
O
H
H
H
①
该反应属于 反应。
取代
①处O—H
键断开
三、乙醇的化学性质
1、乙醇与金属钠的反应
2CH3CH2O H + 2Na → 2CH3CH2ONa +H2↑
2Na+2H2O=2NaOH+H2
2、乙醇的氧化反应
①乙醇的燃烧
C2H5OH+3O2 2CO2+3H2O
点燃
实验室里也常用它作为燃料。
乙醇可用作内燃机的燃料,
现象:乙醇在空气中燃烧,火焰呈淡蓝色。同时放出大量的热。
实验2 乙醇催化氧化反应
(1)将铜丝在酒精灯的外焰加热,观察现象,描述上述变化。
(2)将铜丝由外焰向内焰移动,观察铜丝的变化。你能解释变化的原因吗?
(3)将铜丝红热,插入乙醇中,反复几次。观察铜丝的变化,小心闻试管中液体产生的气味。
乙醇的化学性质
2Cu+O2 2CuO
红色→黑色
黑色→红色
C2H5OH+CuO CH3CHO+H2O+Cu
总反应方程式:
乙醛
刺激性气味液体
注意:铜丝在实验中是催化剂
2C2H5OH+O2 2CH3CHO+2H2O
Cu
△
△
△
(2)乙醇的催化氧化
醇催化氧化机理:
H
C
H
H
O
H
C
H
H
①
④
③
②
与 —OH相连的碳上必须有H
想一想
催化氧化的结构特点
C
H
H
H
C
H
H
O
H
C
H
H
(丙醇)催化氧化的产物?断的哪两个键?
①
②
④
③
⑤
练一练
CH3
CH3 C OH
CH3
?
C—C—O—H
H
H
H
H
H
①
②
③
④
三、乙醇的化学性质
(1)与活泼金属反应
(2) 氧化反应
燃烧
催化氧化
小 结
一、乙醇的物理性质
二、乙醇的分子结构
①
①③
全部
四、乙醇的用途
(1)作燃料,制造饮料和香精
(2)是一种重要的有机化工原料如用
乙 醇制造乙酸、乙醚等。
(3)乙醇又是一种有机溶剂,用于溶解
树脂,制造涂料。
(4)医疗上常用75%(体积分数)的酒
精作消毒剂。
身边的化学Ⅰ
酒精的快速检测:
让驾车人呼出的气体接触载有经过硫酸酸化处理的氧化剂
重铬酸钾的硅胶,可测出呼出的气体中是否含有乙醇及乙
醇含量的高低。
世界卫生组织的事故调查显示,大约50%-60%的交通事故与酒后驾驶有关。
驾驶员正在接受酒精检查
K2Cr2O7
(橙红色)
Cr2(SO4)3
(绿色)
乙醇
酒精检测的原理
身边的化学Ⅱ
酒精中毒:酒精在人体内的代谢速率是有限的,
如果一个人饮酒的速率大于体内代谢的速率,
酒精就会在体内器官,特别是在肝脏和大脑中
积蓄,积蓄至一定程度即出现酒精中毒症状。
1.把铜丝放在酒精灯火焰是加热,可看到铜丝
表面生成( )色的( ),再迅速把铜丝插入盛有乙醇的试管里,看到铜丝表面颜色变( ),反复多次,试管内有( )
气味的( )生成,反应中乙醇被( ) (氧化,还原)
黑 氧化铜
红
刺激性
乙醛
氧化
2.把质量为mg的铜丝灼烧变成黑色,立即放入下列物质中,使铜丝变成红色,而且质量仍为mg的是( )
A.稀H2SO4 B.C2H5OH C.Ca(OH)2溶液 D.CO
3.下列试剂中,能用于检验酒精中是否含有水的事( )
A.硫酸铜晶体 B.浓硫酸 C.无水硫酸铜 D.钠
BD
C
讨论
乙醇的功过是非
