人教版化学选修3第一章原子结构与性质第一节原子结构第三课时(共14张PPT)
文档属性
| 名称 | 人教版化学选修3第一章原子结构与性质第一节原子结构第三课时(共14张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 446.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-27 18:11:34 | ||
图片预览






文档简介
(共14张PPT)
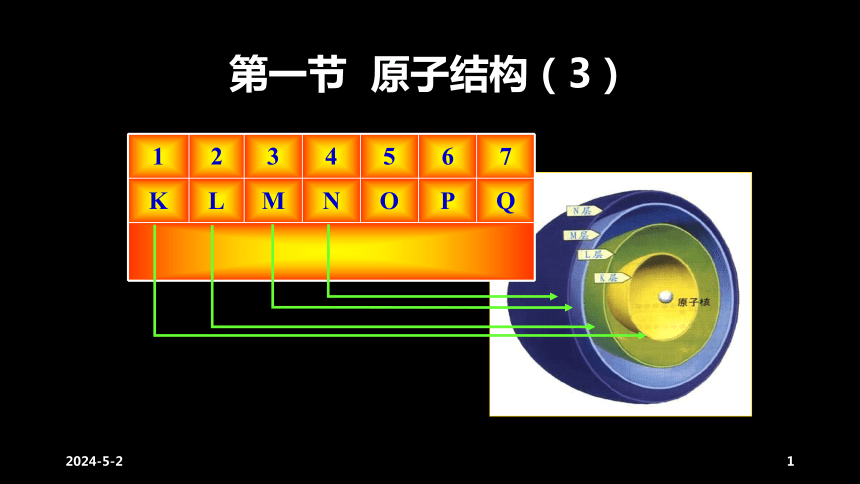
1
2
3
4
5
6
7
K
L
M
N
O
P
Q
第一节
原子结构(3)
2020/7/22
1
激发态原子:基态原子的电子吸收能量后电子会跃迁到较高的能级,变为激发态原子。
四、能量最低原理、基态与激发态、光谱
1.能量最低原理:
原子的电子排布遵循构造原理能使整个原子的能量处于最低状态。
2.基态原子:
处于最低能量的原子
(稳定)
(不稳定)
如:Na
1s22s22p63s1
如:Na
1s22s22p63p1
2020/7/22
2
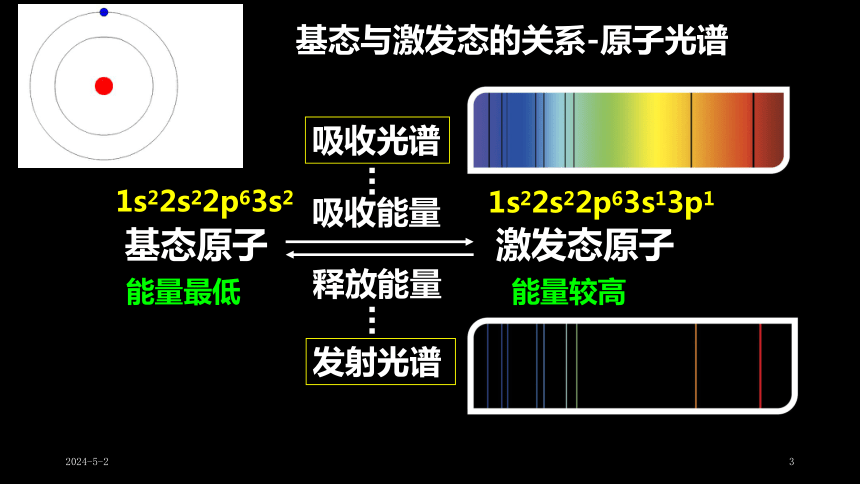
基态与激发态的关系-原子光谱
基态原子
激发态原子
吸收能量
释放能量
发射光谱
吸收光谱
能量较高
能量最低
1s22s22p63s2
1s22s22p63s13p1
2020/7/22
3
基态与激发态相互转化的应用
焰色反应
2020/7/22
4
焰色反应就是某些金属原子的电子在高温火焰中,接受了能量,使原子外层的电子从基态激跃迁到激发态;处于激发态的电子是十分不稳定的,在极短的时间内(约10-8s)便跃迁到基态或较低的能级上,并在跃迁过程中将能量以一定波长(颜色)的光释放出来。由于各种元素的能级是被限定的,因此在向基态跃迁时释放的能量也就不同。碱金属及碱土金属的能级差正好对应于可见光范围,于是我们就看到了各种色彩。
焰火呈现五颜六色的原因
2020/7/22
5
光谱:
按一定次序排列的彩色光带
2020/7/22
6
3.原子光谱
不同元素的原子的核外电子发生跃迁时会吸收或释放不同频率的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称为原子光谱。
锂、氦、汞的吸收光谱
锂、氦、汞的发射光谱
特征:暗背景,
亮线
特征:亮背景,暗线
2020/7/22
7
4.光谱分析
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
2020/7/22
8
②化学研究中利用光谱分析检测一些物质的存在与含量等。
①通过原子光谱发现许多元素。
如:铯(1860年)和铷(1861年),其光谱中有特征的篮光和红光。
又如:1868年科学家们通过太阳光谱的分析发现了稀有气体氦
可见光波长780nm—350nm
(2017·全国卷Ⅰ)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为________nm(填选项字母)。
A.404.4
B.553.5
C.589.2
D.670.8
E.766.5
2020/7/22
9
氢原子的光谱
2020/7/22
10
课堂练习
下列图象中所发生的现象与电子的跃迁无关的是
A
B
C
D
生活中的可见光一般都和电子跃迁有关
2020/7/22
11
D
2、判断下列表达是正确还是错误
1)1s22p1属于基态;
2)1s22s2
2p63s2
3p63d54s1属于激发态;
3)1s22s2
2p63d1属于激发态;
4)1s22s2
2p63p1属于基态;
构造原理:
1s;2s
2p;3s
3p;4s
3d
4p;
5s
4d
5p;
6s
4f
5d
6p;7s
5f
6d7p
2020/7/22
12
x
x
√
x
3、在太阳的光谱中有许多暗线,这表明(
)
A.太阳内部含有这些暗线所对应的元素
B.太阳大气层中缺少这些暗线所对应的元素
C.太阳大气层中含有这些暗线所对应的元素
D.地球的大气层中含有这些暗线所对应的元素
C
2020/7/22
13
4、关于光谱分析,下列说法错误的(
)
A.光谱分析的依据是每种元素都有其独特的
特征谱线
B.光谱分析不能用连续光谱
C.光谱分析既可以用发射谱也可以用吸收光谱
D.分析月亮的光谱可得知月球的化学组成
D
2020/7/22
14
1
2
3
4
5
6
7
K
L
M
N
O
P
Q
第一节
原子结构(3)
2020/7/22
1
激发态原子:基态原子的电子吸收能量后电子会跃迁到较高的能级,变为激发态原子。
四、能量最低原理、基态与激发态、光谱
1.能量最低原理:
原子的电子排布遵循构造原理能使整个原子的能量处于最低状态。
2.基态原子:
处于最低能量的原子
(稳定)
(不稳定)
如:Na
1s22s22p63s1
如:Na
1s22s22p63p1
2020/7/22
2
基态与激发态的关系-原子光谱
基态原子
激发态原子
吸收能量
释放能量
发射光谱
吸收光谱
能量较高
能量最低
1s22s22p63s2
1s22s22p63s13p1
2020/7/22
3
基态与激发态相互转化的应用
焰色反应
2020/7/22
4
焰色反应就是某些金属原子的电子在高温火焰中,接受了能量,使原子外层的电子从基态激跃迁到激发态;处于激发态的电子是十分不稳定的,在极短的时间内(约10-8s)便跃迁到基态或较低的能级上,并在跃迁过程中将能量以一定波长(颜色)的光释放出来。由于各种元素的能级是被限定的,因此在向基态跃迁时释放的能量也就不同。碱金属及碱土金属的能级差正好对应于可见光范围,于是我们就看到了各种色彩。
焰火呈现五颜六色的原因
2020/7/22
5
光谱:
按一定次序排列的彩色光带
2020/7/22
6
3.原子光谱
不同元素的原子的核外电子发生跃迁时会吸收或释放不同频率的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称为原子光谱。
锂、氦、汞的吸收光谱
锂、氦、汞的发射光谱
特征:暗背景,
亮线
特征:亮背景,暗线
2020/7/22
7
4.光谱分析
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
2020/7/22
8
②化学研究中利用光谱分析检测一些物质的存在与含量等。
①通过原子光谱发现许多元素。
如:铯(1860年)和铷(1861年),其光谱中有特征的篮光和红光。
又如:1868年科学家们通过太阳光谱的分析发现了稀有气体氦
可见光波长780nm—350nm
(2017·全国卷Ⅰ)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为________nm(填选项字母)。
A.404.4
B.553.5
C.589.2
D.670.8
E.766.5
2020/7/22
9
氢原子的光谱
2020/7/22
10
课堂练习
下列图象中所发生的现象与电子的跃迁无关的是
A
B
C
D
生活中的可见光一般都和电子跃迁有关
2020/7/22
11
D
2、判断下列表达是正确还是错误
1)1s22p1属于基态;
2)1s22s2
2p63s2
3p63d54s1属于激发态;
3)1s22s2
2p63d1属于激发态;
4)1s22s2
2p63p1属于基态;
构造原理:
1s;2s
2p;3s
3p;4s
3d
4p;
5s
4d
5p;
6s
4f
5d
6p;7s
5f
6d7p
2020/7/22
12
x
x
√
x
3、在太阳的光谱中有许多暗线,这表明(
)
A.太阳内部含有这些暗线所对应的元素
B.太阳大气层中缺少这些暗线所对应的元素
C.太阳大气层中含有这些暗线所对应的元素
D.地球的大气层中含有这些暗线所对应的元素
C
2020/7/22
13
4、关于光谱分析,下列说法错误的(
)
A.光谱分析的依据是每种元素都有其独特的
特征谱线
B.光谱分析不能用连续光谱
C.光谱分析既可以用发射谱也可以用吸收光谱
D.分析月亮的光谱可得知月球的化学组成
D
2020/7/22
14
