苏教化学必修1专题1第一单元丰富多彩的化学物质 课件 (共18张PPT)
文档属性
| 名称 | 苏教化学必修1专题1第一单元丰富多彩的化学物质 课件 (共18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-27 00:00:00 | ||
图片预览






文档简介
(共18张PPT)
物质的分散系
一、分散系
1.分散系:把一种或几种物质分散在另一种物质中所得到的混合体系.
被分散的物质称为分散质
容纳分散质的物质称为分散剂
举例:
氯化钠溶液、糖水、酒精的水溶液、碘酒、
泥浆水、牛奶、
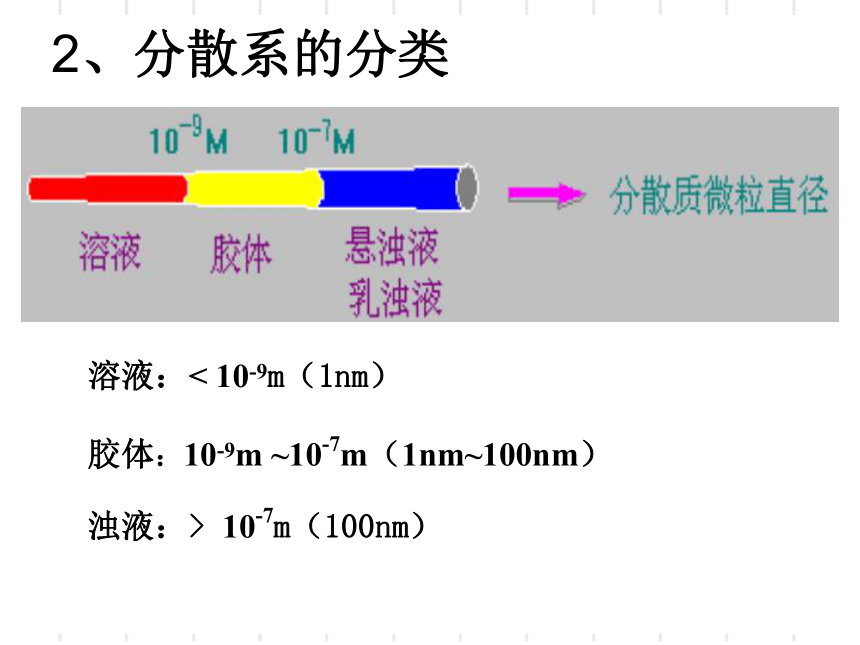
2、分散系的分类
溶液:<
10-9m(1nm)
胶体:10-9m
~10-7m(1nm~100nm)
浊液:>
10-7m(100nm)
讨论:分散系的比较
<
10-9m
10-9
m
~
10-7m
>10-7m
均匀、稳定
均匀、较稳定
不均匀、不稳定
能
能
不能
能
不能
不能
氯化钠溶液、
豆浆、牛奶、
泥水
蔗糖溶液
氢氧化铁胶体
溶液
胶体
浊液
分散质粒子的直径
特征
能否透过滤纸(滤纸孔隙
10-7m)
能否透过半透膜(半透膜孔隙10-9m)
实例
问题解决:
1.
如何除去Na2CO3粉末中的CaCO3?
溶解、过滤、蒸发、结晶。
2.如何分离Fe(OH)3胶体中的NaCl
?
渗析:用半透膜分离胶体和溶液(溶液可以
透过半透膜,而胶体不能透过半透膜)
丁达尔效应:光束通过胶体时,在垂直于光线的方向可以看到一条光亮的通路。
探究:如何区分胶体和溶液呢?
原因:发生丁达尔效应是因为发生了光的散射
自然界的丁达尔现象
胶体的应用
胶体具有吸附性,能吸附水中的悬浮颗粒并沉降,因而常用于净水。
日常生活中我们常用来净水的是KAl(SO4)2·12H2O(十二水硫酸铝钾),俗称明矾,溶于水可形成Al(OH)3胶体,
是一种良好的净水剂。
在溶液中溶质是分散质,溶剂是分散剂,为什么有的化合物溶于水能导电,而有的化合物溶于水不能导电?
思考:
交流与讨论:
下面物质中能导电的是
①NaCl固体
②NaCl溶液
③HCl气体
④盐酸
⑤铜
⑥石墨
⑦蔗糖溶液
②④⑤⑥
思考:
1.为什么NaCl固体不能导电,而NaCl溶液却能
导电?
2.盐酸、NaCl溶液能导电和铜、石墨能导电有
什么不同?
3.为什么蔗糖溶液不导电?
氯化钠固体溶于水的过程
蔗糖溶于水的过程
交流讨论
归纳整理:
1.
电解质:在水溶液里或熔融状态下能导电的化合物?。
常见的电解质:酸、碱、盐和大多数金属氧化物。
2.非电解质:在水溶液里和熔融状态下均不能导电的化合物?。
常见的非电解质:非金属氧化物(CO2、SO2等)、氮的氢化物(NH3)、大多数有机化合物。
交流与讨论:
讨论一:BaSO4、AgCl是否是电解质?
讨论二:判断Cl2、
CO2、NH3、稀硫酸、盐酸是
否是电解质?
判断一:氧化钠溶于水能导电,所以它是电解质?
判断二:固体氯化钠不导电,所以它不是电解质?
电离方程式:表示?
酸、碱、盐等电解质在溶液中或熔融状态下电离成能够自由移动的离子的式子
。
例如:
NaCl=Na++Cl-
NaOH=Na++OH-
H2SO4=2H++SO42-
书写下列物质的电离方程式:
①HCl
②Ca(OH)2
③Ba(OH)2
④KNO3
⑤Na2CO3
盐:电离时产生的金属阳离子(或铵根离子)和酸根阴离子的化合物
从电离的角度定义酸、碱、盐。
酸:电离时产生的阳离子全部是H+
碱:电离时产生的阴离子全部是OH-
练一练:
⑴硫酸 ⑵蔗糖 ⑶氨 ⑷HNO3
⑸NH3·H2O ⑹锌粒
⑺NH4Cl
⑻乙醇
⑼石墨 ⑽Ca(OH)2
⑾H3PO4
⑿Na2O
判断上述物质中属于非电解质的是_________。
属于电解质的是______。
2、
3、
8
1
、4
、
5
、7、
10
、11、
12
物质的分散系
一、分散系
1.分散系:把一种或几种物质分散在另一种物质中所得到的混合体系.
被分散的物质称为分散质
容纳分散质的物质称为分散剂
举例:
氯化钠溶液、糖水、酒精的水溶液、碘酒、
泥浆水、牛奶、
2、分散系的分类
溶液:<
10-9m(1nm)
胶体:10-9m
~10-7m(1nm~100nm)
浊液:>
10-7m(100nm)
讨论:分散系的比较
<
10-9m
10-9
m
~
10-7m
>10-7m
均匀、稳定
均匀、较稳定
不均匀、不稳定
能
能
不能
能
不能
不能
氯化钠溶液、
豆浆、牛奶、
泥水
蔗糖溶液
氢氧化铁胶体
溶液
胶体
浊液
分散质粒子的直径
特征
能否透过滤纸(滤纸孔隙
10-7m)
能否透过半透膜(半透膜孔隙10-9m)
实例
问题解决:
1.
如何除去Na2CO3粉末中的CaCO3?
溶解、过滤、蒸发、结晶。
2.如何分离Fe(OH)3胶体中的NaCl
?
渗析:用半透膜分离胶体和溶液(溶液可以
透过半透膜,而胶体不能透过半透膜)
丁达尔效应:光束通过胶体时,在垂直于光线的方向可以看到一条光亮的通路。
探究:如何区分胶体和溶液呢?
原因:发生丁达尔效应是因为发生了光的散射
自然界的丁达尔现象
胶体的应用
胶体具有吸附性,能吸附水中的悬浮颗粒并沉降,因而常用于净水。
日常生活中我们常用来净水的是KAl(SO4)2·12H2O(十二水硫酸铝钾),俗称明矾,溶于水可形成Al(OH)3胶体,
是一种良好的净水剂。
在溶液中溶质是分散质,溶剂是分散剂,为什么有的化合物溶于水能导电,而有的化合物溶于水不能导电?
思考:
交流与讨论:
下面物质中能导电的是
①NaCl固体
②NaCl溶液
③HCl气体
④盐酸
⑤铜
⑥石墨
⑦蔗糖溶液
②④⑤⑥
思考:
1.为什么NaCl固体不能导电,而NaCl溶液却能
导电?
2.盐酸、NaCl溶液能导电和铜、石墨能导电有
什么不同?
3.为什么蔗糖溶液不导电?
氯化钠固体溶于水的过程
蔗糖溶于水的过程
交流讨论
归纳整理:
1.
电解质:在水溶液里或熔融状态下能导电的化合物?。
常见的电解质:酸、碱、盐和大多数金属氧化物。
2.非电解质:在水溶液里和熔融状态下均不能导电的化合物?。
常见的非电解质:非金属氧化物(CO2、SO2等)、氮的氢化物(NH3)、大多数有机化合物。
交流与讨论:
讨论一:BaSO4、AgCl是否是电解质?
讨论二:判断Cl2、
CO2、NH3、稀硫酸、盐酸是
否是电解质?
判断一:氧化钠溶于水能导电,所以它是电解质?
判断二:固体氯化钠不导电,所以它不是电解质?
电离方程式:表示?
酸、碱、盐等电解质在溶液中或熔融状态下电离成能够自由移动的离子的式子
。
例如:
NaCl=Na++Cl-
NaOH=Na++OH-
H2SO4=2H++SO42-
书写下列物质的电离方程式:
①HCl
②Ca(OH)2
③Ba(OH)2
④KNO3
⑤Na2CO3
盐:电离时产生的金属阳离子(或铵根离子)和酸根阴离子的化合物
从电离的角度定义酸、碱、盐。
酸:电离时产生的阳离子全部是H+
碱:电离时产生的阴离子全部是OH-
练一练:
⑴硫酸 ⑵蔗糖 ⑶氨 ⑷HNO3
⑸NH3·H2O ⑹锌粒
⑺NH4Cl
⑻乙醇
⑼石墨 ⑽Ca(OH)2
⑾H3PO4
⑿Na2O
判断上述物质中属于非电解质的是_________。
属于电解质的是______。
2、
3、
8
1
、4
、
5
、7、
10
、11、
12
