苏教化学必修1专题1第二单元 研究物质的实验方法 课件 (共25张PPT)
文档属性
| 名称 | 苏教化学必修1专题1第二单元 研究物质的实验方法 课件 (共25张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-27 00:00:00 | ||
图片预览





文档简介
(共25张PPT)
常见物质的检验
常见物质的检验
鉴别与鉴定的区别
鉴别:重在别,即区别。根据不同物质具有不同的特性,用物理或化学的方法将两种或两种以上的已知物质一一区别开来。
鉴定:根据物质的某种特性,用实验的方法来确定它是否是某种物质。鉴定某种物质必须分别检验其中的阴离子、阳离子或其他成分。
依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断。
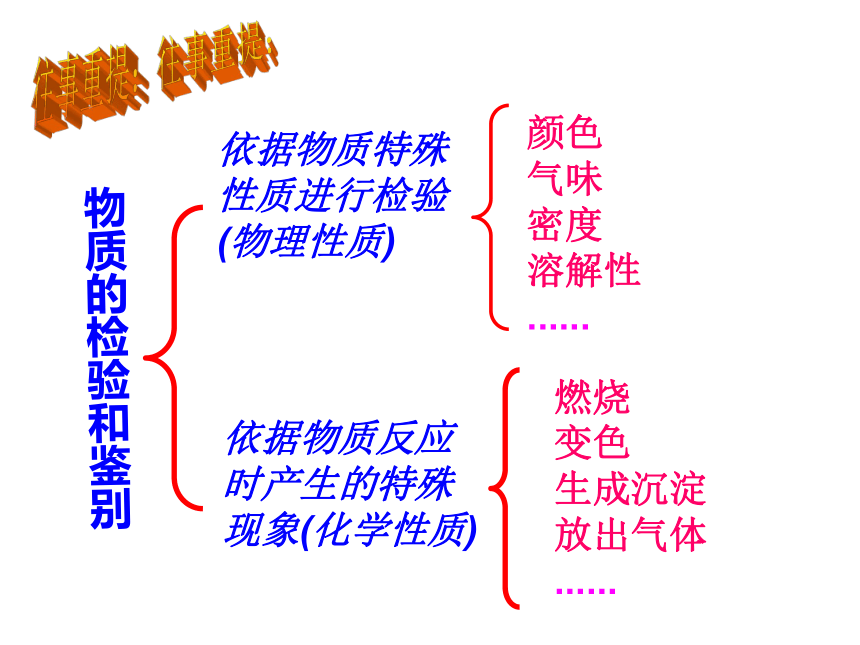
物质的检验和鉴别
依据物质特殊性质进行检验
(物理性质)
颜色
气味
密度
溶解性
......
燃烧
变色
生成沉淀
放出气体
......
依据物质反应时产生的特殊现象(化学性质)
往事重提:
有特殊颜色的物质:
①黑色粉末:
Fe3O4、CuO、MnO2、
木炭粉、铁粉...
②红色固体:
Cu、Fe2O3、HgO...
③一些离子在溶液中的颜色:
Cu2+--蓝色、
Fe3+--棕黄色、
Fe2+--浅绿色、
MnO4-
--紫色。
回顾知识:
淀粉的检验:
我们学过哪些物质的检验?
蛋白质纤维(丝绸、羊毛制品):
碳酸盐(CO32-):
遇碘单质变蓝色;
灼烧有烧焦羽毛的特殊气味
加入盐酸放出二氧化碳气体
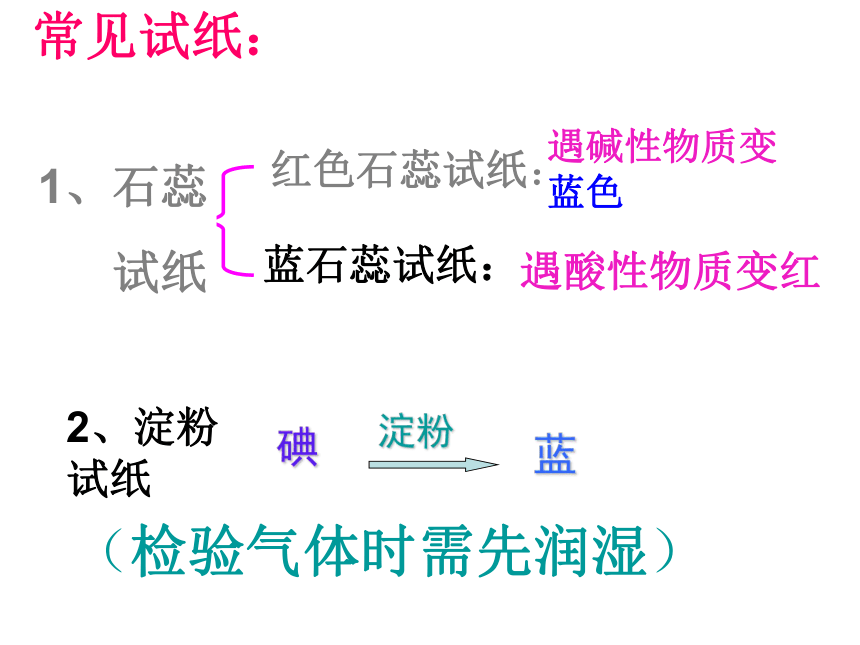
常见试纸:
红色石蕊试纸:
1、石蕊
试纸
遇碱性物质变蓝色
蓝石蕊试纸:
遇酸性物质变红
2、淀粉
试纸
(检验气体时需先润湿)
碘
淀粉
蓝
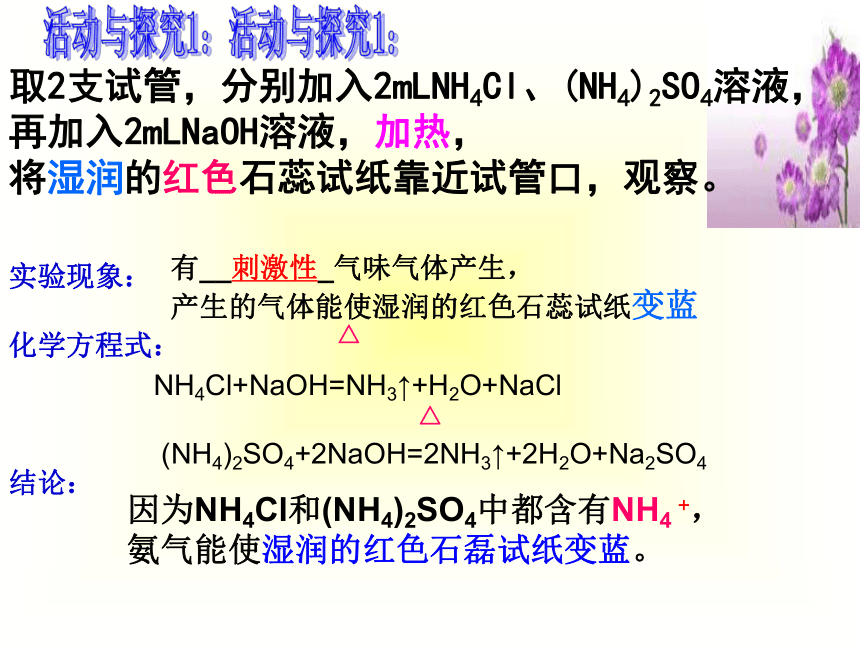
活动与探究1:
取2支试管,分别加入2mLNH4Cl、(NH4)2SO4溶液,
再加入2mLNaOH溶液,加热,
将湿润的红色石蕊试纸靠近试管口,观察。
实验现象:
化学方程式:
结论:
有__刺激性_气味气体产生,
产生的气体能使湿润的红色石蕊试纸变蓝
因为NH4Cl和(NH4)2SO4中都含有NH4
+,氨气能使湿润的红色石磊试纸变蓝。
所以NH4+的检验方法是:
取样,加入强碱,加热,若生成能使湿润的红色石蕊试纸变蓝的刺激性气味气体,则该样品中含NH4+。
试管内有__________生成,
滴入稀硝酸,___________________。
白色沉淀
白色沉淀不溶解
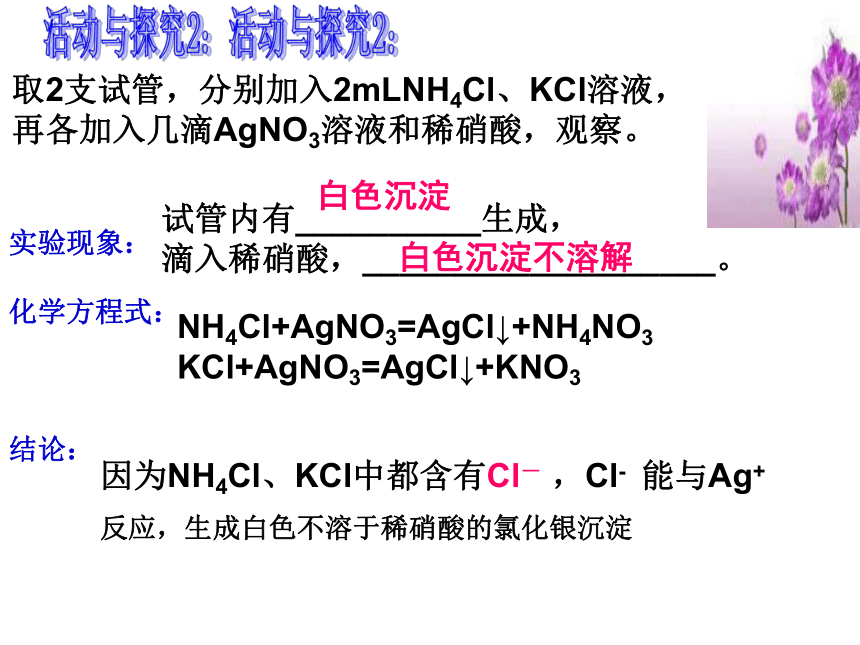
活动与探究2:
取2支试管,分别加入2mLNH4Cl、KCl溶液,
再各加入几滴AgNO3溶液和稀硝酸,观察。
实验现象:
化学方程式:
结论:
NH4Cl+AgNO3=AgCl↓+NH4NO3
KCl+AgNO3=AgCl↓+KNO3
因为NH4Cl、KCl中都含有Cl-
,Cl-
能与Ag+
反应,生成白色不溶于稀硝酸的氯化银沉淀
所以Cl-的检验方法是:
取样(溶解),加入硝酸银溶液,如生成不溶于稀硝酸的白色沉淀,则样品中含Cl-。
思考:为什么该实验中要加入稀硝酸?
作用是排除CO32-、SO32-等的干扰(因为也能与AgNO3反应生成白色沉淀,但这些沉淀溶于稀硝酸)
活动与探究3:
取2支试管,分别加入2mL(NH4)2SO4、K2SO4溶液,
再各滴加几滴BaCl2溶液和稀盐酸,观察。
实验现象:
化学方程式:
结论:
试管内有_________生成,
加入稀盐酸_________________。
白色沉淀
白色沉淀不溶解
(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl
K2SO4+BaCl2=
BaSO4↓+2KCl
因为硫酸氨,硫酸钾中都含有
SO42
-,
硫酸根离子能与氯化钡中的钡离子反应,生成白色的硫酸钡沉淀,该沉淀不溶于稀盐酸
取样(溶解),先加足量稀盐酸酸化(排除Ag+等离子的
干扰),
再取上清液加入如BaCl2,
如有白色沉淀生成,则该样品中含SO42-。
思考:
某样品溶液中加入BaCl2溶液,再加稀盐酸,有不溶于稀
盐酸的白色沉淀生成,能说明该样品中一定含有SO42-吗?
答:不能。有可能含有Ag+或SO42-。
怎样才能排除Ag+的干扰呢?
答:先在样品溶液中加足量稀盐酸,如有白色沉淀生成,
则含Ag+;反之则无Ag+。
归纳:如何正确检验SO42-?
活动与探究4:
取一根铂丝(或光亮的细铁丝),放在酒精灯火焰上灼烧至无色,然后蘸取少量KCl溶液,置于火焰上灼烧,透过蓝色钴玻璃观察火焰颜色。再用稀盐酸洗净铂丝,并在火焰上灼烧至无色,蘸取少量K2SO4溶液,重复以上实验。
现象:
KCl溶液灼烧时透过蓝色钴玻璃可以看到火焰
为紫色,
K2SO4溶液烧时透过蓝色钴玻璃可以看到火焰为紫色。
焰色反应---
定义:
许多金属或它们的化合物在灼烧时,会使
火焰呈现特殊的颜色。
1.用来检验金属元素(单质或金属离子)。
2.与状态(固态,液态;单质,化合物)无关,
只与金属元素有关。
注意:
3.
焰色反应是物理变化(颜色),不是化学
变化
Na:
黄色
(金属钠,Na2CO3,Na2SO4,NaCl,NaOH
…)
K:
紫色(透过蓝色钴玻璃)
(金属钾,K2CO3,K2SO4,KCl,KOH
…)
Cu:
绿色
(金属铜,CuCl2,Cu(NO3)2,CuSO4,Cu(OH)2
…)
焰色反应的实验要点:
1、铂丝或细铁丝在使用前要稀盐酸冲洗,放在酒精灯上灼烧至无色。
2、灼烧时用酒精灯的外焰
3、做钾的焰色反应时一定要透过蓝色的钴玻璃观察。
焰色反应是
(
)
A.单质的性质
B.化合物的性质
C.离子的性质
D.元素的性质
D
试一试!
归纳:一般物质的检验方法
加入稀盐酸生成使澄清石灰水变浑浊的无色、无味的气体
加入稀盐酸后无现象,再加入BaCl2溶液产生白色沉淀
加入NaOH溶液,加热后产生气体使湿润的红色石蕊试纸变蓝(湿润的PH试纸变蓝)
加入AgNO3溶液产生白色沉淀再加入稀硝酸白色沉淀不溶解
用洁净的铂丝蘸取样品,在火焰上灼烧,火焰呈黄色
用洁净的铂丝蘸取少量样品,置于火焰上灼烧,透过蓝色钴玻璃观察火焰颜色呈紫色
待检验的物质
检
验
方
法
和
现
象
碳酸盐
(CO32-)
硫酸盐
(SO42-)
铵盐
(NH4+)
氯离子
(Cl-)
钠盐
(Na+)
钾盐
(K+)
待测物质
检验方法
现象结论
Ag+
加Cl-,稀硝酸
生成不溶于稀硝酸的白色沉淀
OH-
①紫色石蕊试剂
②酚酞试剂
①变蓝
②变红
H+
①紫色石蕊试剂
②活泼金属
…
①变红
②气体(H2)
练习
1.能用来区别BaCl2、NaCl、Na2CO3三种物质的试
剂是(
)
A.
AgNO3
B.
稀硫酸
C.
稀盐酸
D.
稀硝酸
2.能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四
瓶无色溶液加以区别的一种试剂是(必要时可以加
热)(
)
A.BaCl2
B.NaOH
C.Ba(OH)2
D.AgNO3
B
C
1、以下是对某水溶液进行离子检验的方法和结论,其中正确的是(
)
A、先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀,溶液中一定含有大量SO
B、加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量
的CO
C、加入足量浓NaOH溶液,产生了带有强烈刺激性气味的气体。溶液中一定含有大量的NH
D、先加适量的盐酸将溶液酸化,再加入AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl-
+
4
2-
3
2-
4
C
课堂反馈
2、能用来区别BaCl2、NaCl、Na2CO3三种物质的
试剂是(
)
A.
AgNO3
B.
稀硫酸
C.
稀盐酸
D.
稀硝酸
3、在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁和硫酸铁溶液,这种试剂是(
)
A.NaOH?
?????????
B.Na2CO3
C.AgNO3?
????????
D.BaCl2
B
A
A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B.
某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42-
C.某无色溶液滴入紫色石蕊试液显红色,该溶液一定是酸溶液
D.验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl-
4、对下列实验过程的评价,正确的是
D
1、PH试纸:即广范试纸。
2、石蕊试纸
红石蕊试纸:
遇碱性物质变蓝
蓝石蕊试纸:
遇酸性物质变红
(检验气体需先湿润)
3、淀粉试纸:遇I2变蓝
常见物质的检验
常见物质的检验
鉴别与鉴定的区别
鉴别:重在别,即区别。根据不同物质具有不同的特性,用物理或化学的方法将两种或两种以上的已知物质一一区别开来。
鉴定:根据物质的某种特性,用实验的方法来确定它是否是某种物质。鉴定某种物质必须分别检验其中的阴离子、阳离子或其他成分。
依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断。
物质的检验和鉴别
依据物质特殊性质进行检验
(物理性质)
颜色
气味
密度
溶解性
......
燃烧
变色
生成沉淀
放出气体
......
依据物质反应时产生的特殊现象(化学性质)
往事重提:
有特殊颜色的物质:
①黑色粉末:
Fe3O4、CuO、MnO2、
木炭粉、铁粉...
②红色固体:
Cu、Fe2O3、HgO...
③一些离子在溶液中的颜色:
Cu2+--蓝色、
Fe3+--棕黄色、
Fe2+--浅绿色、
MnO4-
--紫色。
回顾知识:
淀粉的检验:
我们学过哪些物质的检验?
蛋白质纤维(丝绸、羊毛制品):
碳酸盐(CO32-):
遇碘单质变蓝色;
灼烧有烧焦羽毛的特殊气味
加入盐酸放出二氧化碳气体
常见试纸:
红色石蕊试纸:
1、石蕊
试纸
遇碱性物质变蓝色
蓝石蕊试纸:
遇酸性物质变红
2、淀粉
试纸
(检验气体时需先润湿)
碘
淀粉
蓝
活动与探究1:
取2支试管,分别加入2mLNH4Cl、(NH4)2SO4溶液,
再加入2mLNaOH溶液,加热,
将湿润的红色石蕊试纸靠近试管口,观察。
实验现象:
化学方程式:
结论:
有__刺激性_气味气体产生,
产生的气体能使湿润的红色石蕊试纸变蓝
因为NH4Cl和(NH4)2SO4中都含有NH4
+,氨气能使湿润的红色石磊试纸变蓝。
所以NH4+的检验方法是:
取样,加入强碱,加热,若生成能使湿润的红色石蕊试纸变蓝的刺激性气味气体,则该样品中含NH4+。
试管内有__________生成,
滴入稀硝酸,___________________。
白色沉淀
白色沉淀不溶解
活动与探究2:
取2支试管,分别加入2mLNH4Cl、KCl溶液,
再各加入几滴AgNO3溶液和稀硝酸,观察。
实验现象:
化学方程式:
结论:
NH4Cl+AgNO3=AgCl↓+NH4NO3
KCl+AgNO3=AgCl↓+KNO3
因为NH4Cl、KCl中都含有Cl-
,Cl-
能与Ag+
反应,生成白色不溶于稀硝酸的氯化银沉淀
所以Cl-的检验方法是:
取样(溶解),加入硝酸银溶液,如生成不溶于稀硝酸的白色沉淀,则样品中含Cl-。
思考:为什么该实验中要加入稀硝酸?
作用是排除CO32-、SO32-等的干扰(因为也能与AgNO3反应生成白色沉淀,但这些沉淀溶于稀硝酸)
活动与探究3:
取2支试管,分别加入2mL(NH4)2SO4、K2SO4溶液,
再各滴加几滴BaCl2溶液和稀盐酸,观察。
实验现象:
化学方程式:
结论:
试管内有_________生成,
加入稀盐酸_________________。
白色沉淀
白色沉淀不溶解
(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl
K2SO4+BaCl2=
BaSO4↓+2KCl
因为硫酸氨,硫酸钾中都含有
SO42
-,
硫酸根离子能与氯化钡中的钡离子反应,生成白色的硫酸钡沉淀,该沉淀不溶于稀盐酸
取样(溶解),先加足量稀盐酸酸化(排除Ag+等离子的
干扰),
再取上清液加入如BaCl2,
如有白色沉淀生成,则该样品中含SO42-。
思考:
某样品溶液中加入BaCl2溶液,再加稀盐酸,有不溶于稀
盐酸的白色沉淀生成,能说明该样品中一定含有SO42-吗?
答:不能。有可能含有Ag+或SO42-。
怎样才能排除Ag+的干扰呢?
答:先在样品溶液中加足量稀盐酸,如有白色沉淀生成,
则含Ag+;反之则无Ag+。
归纳:如何正确检验SO42-?
活动与探究4:
取一根铂丝(或光亮的细铁丝),放在酒精灯火焰上灼烧至无色,然后蘸取少量KCl溶液,置于火焰上灼烧,透过蓝色钴玻璃观察火焰颜色。再用稀盐酸洗净铂丝,并在火焰上灼烧至无色,蘸取少量K2SO4溶液,重复以上实验。
现象:
KCl溶液灼烧时透过蓝色钴玻璃可以看到火焰
为紫色,
K2SO4溶液烧时透过蓝色钴玻璃可以看到火焰为紫色。
焰色反应---
定义:
许多金属或它们的化合物在灼烧时,会使
火焰呈现特殊的颜色。
1.用来检验金属元素(单质或金属离子)。
2.与状态(固态,液态;单质,化合物)无关,
只与金属元素有关。
注意:
3.
焰色反应是物理变化(颜色),不是化学
变化
Na:
黄色
(金属钠,Na2CO3,Na2SO4,NaCl,NaOH
…)
K:
紫色(透过蓝色钴玻璃)
(金属钾,K2CO3,K2SO4,KCl,KOH
…)
Cu:
绿色
(金属铜,CuCl2,Cu(NO3)2,CuSO4,Cu(OH)2
…)
焰色反应的实验要点:
1、铂丝或细铁丝在使用前要稀盐酸冲洗,放在酒精灯上灼烧至无色。
2、灼烧时用酒精灯的外焰
3、做钾的焰色反应时一定要透过蓝色的钴玻璃观察。
焰色反应是
(
)
A.单质的性质
B.化合物的性质
C.离子的性质
D.元素的性质
D
试一试!
归纳:一般物质的检验方法
加入稀盐酸生成使澄清石灰水变浑浊的无色、无味的气体
加入稀盐酸后无现象,再加入BaCl2溶液产生白色沉淀
加入NaOH溶液,加热后产生气体使湿润的红色石蕊试纸变蓝(湿润的PH试纸变蓝)
加入AgNO3溶液产生白色沉淀再加入稀硝酸白色沉淀不溶解
用洁净的铂丝蘸取样品,在火焰上灼烧,火焰呈黄色
用洁净的铂丝蘸取少量样品,置于火焰上灼烧,透过蓝色钴玻璃观察火焰颜色呈紫色
待检验的物质
检
验
方
法
和
现
象
碳酸盐
(CO32-)
硫酸盐
(SO42-)
铵盐
(NH4+)
氯离子
(Cl-)
钠盐
(Na+)
钾盐
(K+)
待测物质
检验方法
现象结论
Ag+
加Cl-,稀硝酸
生成不溶于稀硝酸的白色沉淀
OH-
①紫色石蕊试剂
②酚酞试剂
①变蓝
②变红
H+
①紫色石蕊试剂
②活泼金属
…
①变红
②气体(H2)
练习
1.能用来区别BaCl2、NaCl、Na2CO3三种物质的试
剂是(
)
A.
AgNO3
B.
稀硫酸
C.
稀盐酸
D.
稀硝酸
2.能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四
瓶无色溶液加以区别的一种试剂是(必要时可以加
热)(
)
A.BaCl2
B.NaOH
C.Ba(OH)2
D.AgNO3
B
C
1、以下是对某水溶液进行离子检验的方法和结论,其中正确的是(
)
A、先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀,溶液中一定含有大量SO
B、加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量
的CO
C、加入足量浓NaOH溶液,产生了带有强烈刺激性气味的气体。溶液中一定含有大量的NH
D、先加适量的盐酸将溶液酸化,再加入AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl-
+
4
2-
3
2-
4
C
课堂反馈
2、能用来区别BaCl2、NaCl、Na2CO3三种物质的
试剂是(
)
A.
AgNO3
B.
稀硫酸
C.
稀盐酸
D.
稀硝酸
3、在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁和硫酸铁溶液,这种试剂是(
)
A.NaOH?
?????????
B.Na2CO3
C.AgNO3?
????????
D.BaCl2
B
A
A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B.
某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42-
C.某无色溶液滴入紫色石蕊试液显红色,该溶液一定是酸溶液
D.验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl-
4、对下列实验过程的评价,正确的是
D
1、PH试纸:即广范试纸。
2、石蕊试纸
红石蕊试纸:
遇碱性物质变蓝
蓝石蕊试纸:
遇酸性物质变红
(检验气体需先湿润)
3、淀粉试纸:遇I2变蓝
