铝 金属材料
图片预览





文档简介
(共18张PPT)
第二节 铝 金属材料(第一课时)
含量:O>Si >Al >Fe
金属元素在地壳中的含量
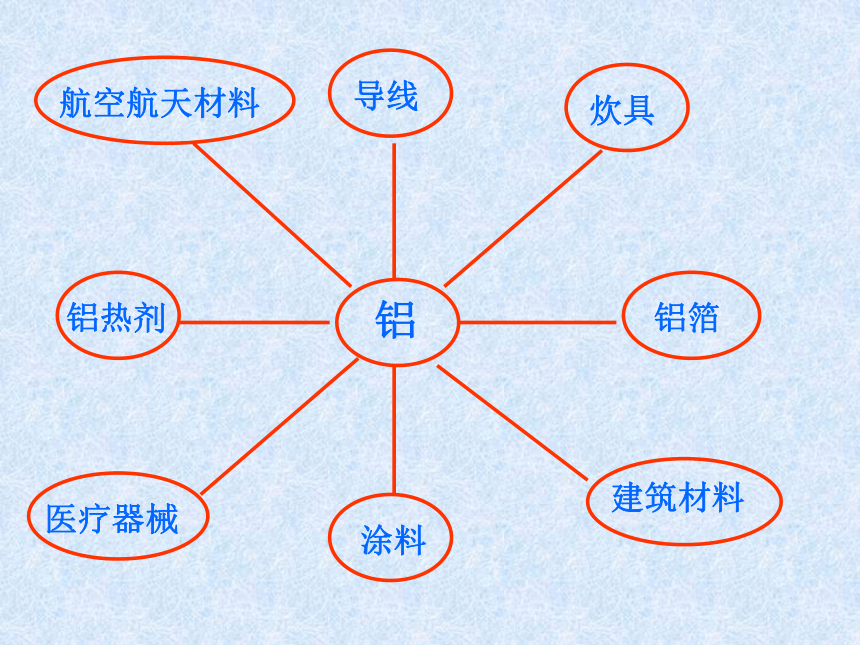
铝
导线
炊具
航空航天材料
铝箔
建筑材料
涂料
医疗器械
铝热剂
一、铝单质的物理性质
银白色有金属光泽的固体,熔沸点较高,密度较小,有良好的导电性、导热性和延展性。
二、铝单质的化学性质
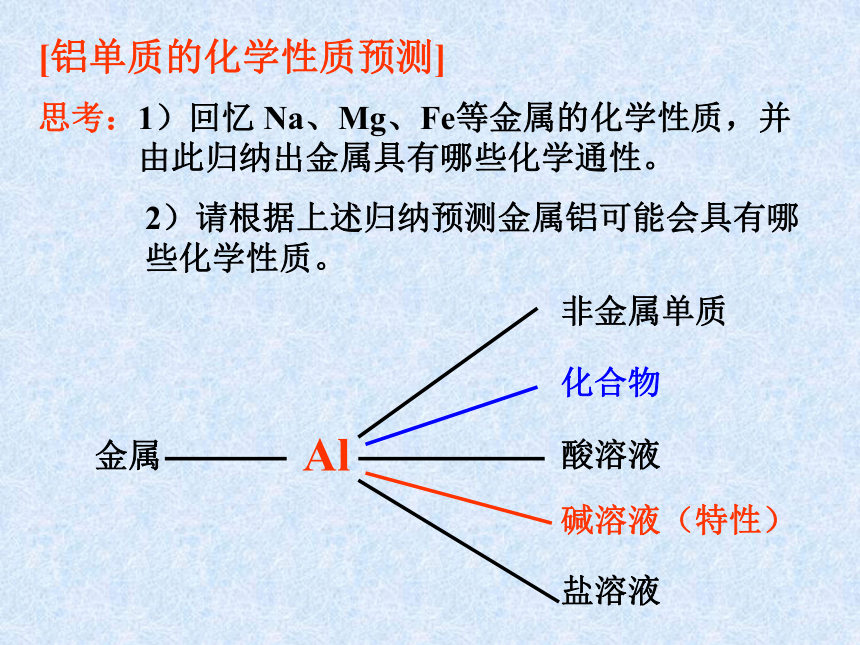
[铝单质的化学性质预测]
思考:
1)回忆 Na、Mg、Fe等金属的化学性质,并由此归纳出金属具有哪些化学通性。
2)请根据上述归纳预测金属铝可能会具有哪些化学性质。
金属
Al
化合物
碱溶液(特性)
非金属单质
酸溶液
盐溶液
[实验探究验证]
实验探究1、铝与非金属的反应
1)常温下,铝与空气中的氧气反应形成一层致密的氧化物薄膜,因此铝具有抗腐蚀性。
2)铝在氧气中燃烧
4Al+3O2
2Al2O3
现象:铝箔剧烈燃烧,发出耀眼的白光,
放出大量的热,生成白色固体。
应用:制造燃烧弹、信号弹、火箭推进剂等
实验探究2:铝与氧化物的反应
问 题:
1)根据Mg 与CO2发生的氧化还原反应,推断Al能否与Fe2O3发生反应
2)若能反应可能会生成哪些物质?
剧烈反应,从漏斗上方产生美丽的焰火,纸漏斗底部被烧穿,并有熔融物落入沙中
现象:
2Al + Fe2O3
2Fe+ Al2O3
反应原理:
迁移:
Al+ Fe3O4
应用:焊接钢轨,冶炼钒、铬、锰等难熔金属。
9Fe+ 4Al2O3
8
3
10Al+3V2O5
5Al2O3+6V
实验内容 实验现象 实验结论及化学方程式
铝与盐酸反应
铝与NaOH溶液反应
铝与CuSO4溶液反应
实验探究3:铝与酸、碱、盐溶液的反应
2Al+2 NaOH+6H2O=2Na[Al(OH)4]+3H2
铝条溶解,有无色气体逸出
铝条溶解,有无色气体逸出
铝条表面上附着红色的铜溶液有蓝色变为无色
2Al+6HCl=2AlCl3+3H2
2Al+3CuSO4=Al2(SO4)3+3Cu
四羟基合铝酸钠
本节课,我们从生活实际出发讨论了金属铝的物理性质。通过化学实验探究了铝的化学性质。
本节课的重点是: 铝与非金属单质、金属氧化物、酸、碱、盐溶液的反应。
通过上述所有化学反应,表现了铝具有强还原性。
知识整合:
Al
化合物
碱溶液
非金属单质
酸溶液
盐溶液
2Al+2 NaOH+6H2O=2Na[Al(OH)4]+3H2
2Al+6HCl=2AlCl3+3H2
2Al+3CuSO4=Al2(SO4)3+3Cu
2Al + Fe2O3
2Fe+ Al2O3
4Al+3O2
2Al2O3
1.除去镁粉中混有的少量铝粉,可选
用下列溶液中的:
A 盐酸 B 硝酸
C 浓氢氧化钾溶液 D 氨水
2. 下列有关厨房铝制品的使用中,你认为合理的是
A. 烧煮开水 B盛放食醋
C.用金属丝擦表面的污垢 D.用碱水洗涤
1、生活中,你或许有这样的经验:铝制器具不能用来盛放醋、酸梅汤或碱水等物质,如果长时间放置的话,铝制器具有可能被腐蚀,请分析其中的原因。
2、铝在人体中积累可使人慢性中毒,1998年世界卫生组织正式将铝确定为食品污染源之一而加以控制。铝在下列场合使用无需加以控制的是( )
1)制易拉罐 5)明矾净水
2)糖果香烟内包装 6)制氢氧化铝胶囊(内服)
3)电线电缆 7)制炊具和餐具
4)牙膏皮 8)制防锈漆
各位老师和同学辛苦了!
再见!
拓展延伸:
1、判断铝与下列酸溶液能否反应,若反应,分别生成什么物质?
1)浓盐酸 2)稀盐酸 3)浓硫酸 4)稀硫酸
5)浓硝酸 6)稀硝酸 7)醋酸
根据以上判断,归纳出铝与酸反应的各种情况
A、与非强氧化性的酸反应,一般生成盐和氢气
B、与强氧化性的酸反应,一般不生成氢气
C、常温下,铝遇冷的浓硫酸、浓硝酸钝化
第二节 铝 金属材料(第一课时)
含量:O>Si >Al >Fe
金属元素在地壳中的含量
铝
导线
炊具
航空航天材料
铝箔
建筑材料
涂料
医疗器械
铝热剂
一、铝单质的物理性质
银白色有金属光泽的固体,熔沸点较高,密度较小,有良好的导电性、导热性和延展性。
二、铝单质的化学性质
[铝单质的化学性质预测]
思考:
1)回忆 Na、Mg、Fe等金属的化学性质,并由此归纳出金属具有哪些化学通性。
2)请根据上述归纳预测金属铝可能会具有哪些化学性质。
金属
Al
化合物
碱溶液(特性)
非金属单质
酸溶液
盐溶液
[实验探究验证]
实验探究1、铝与非金属的反应
1)常温下,铝与空气中的氧气反应形成一层致密的氧化物薄膜,因此铝具有抗腐蚀性。
2)铝在氧气中燃烧
4Al+3O2
2Al2O3
现象:铝箔剧烈燃烧,发出耀眼的白光,
放出大量的热,生成白色固体。
应用:制造燃烧弹、信号弹、火箭推进剂等
实验探究2:铝与氧化物的反应
问 题:
1)根据Mg 与CO2发生的氧化还原反应,推断Al能否与Fe2O3发生反应
2)若能反应可能会生成哪些物质?
剧烈反应,从漏斗上方产生美丽的焰火,纸漏斗底部被烧穿,并有熔融物落入沙中
现象:
2Al + Fe2O3
2Fe+ Al2O3
反应原理:
迁移:
Al+ Fe3O4
应用:焊接钢轨,冶炼钒、铬、锰等难熔金属。
9Fe+ 4Al2O3
8
3
10Al+3V2O5
5Al2O3+6V
实验内容 实验现象 实验结论及化学方程式
铝与盐酸反应
铝与NaOH溶液反应
铝与CuSO4溶液反应
实验探究3:铝与酸、碱、盐溶液的反应
2Al+2 NaOH+6H2O=2Na[Al(OH)4]+3H2
铝条溶解,有无色气体逸出
铝条溶解,有无色气体逸出
铝条表面上附着红色的铜溶液有蓝色变为无色
2Al+6HCl=2AlCl3+3H2
2Al+3CuSO4=Al2(SO4)3+3Cu
四羟基合铝酸钠
本节课,我们从生活实际出发讨论了金属铝的物理性质。通过化学实验探究了铝的化学性质。
本节课的重点是: 铝与非金属单质、金属氧化物、酸、碱、盐溶液的反应。
通过上述所有化学反应,表现了铝具有强还原性。
知识整合:
Al
化合物
碱溶液
非金属单质
酸溶液
盐溶液
2Al+2 NaOH+6H2O=2Na[Al(OH)4]+3H2
2Al+6HCl=2AlCl3+3H2
2Al+3CuSO4=Al2(SO4)3+3Cu
2Al + Fe2O3
2Fe+ Al2O3
4Al+3O2
2Al2O3
1.除去镁粉中混有的少量铝粉,可选
用下列溶液中的:
A 盐酸 B 硝酸
C 浓氢氧化钾溶液 D 氨水
2. 下列有关厨房铝制品的使用中,你认为合理的是
A. 烧煮开水 B盛放食醋
C.用金属丝擦表面的污垢 D.用碱水洗涤
1、生活中,你或许有这样的经验:铝制器具不能用来盛放醋、酸梅汤或碱水等物质,如果长时间放置的话,铝制器具有可能被腐蚀,请分析其中的原因。
2、铝在人体中积累可使人慢性中毒,1998年世界卫生组织正式将铝确定为食品污染源之一而加以控制。铝在下列场合使用无需加以控制的是( )
1)制易拉罐 5)明矾净水
2)糖果香烟内包装 6)制氢氧化铝胶囊(内服)
3)电线电缆 7)制炊具和餐具
4)牙膏皮 8)制防锈漆
各位老师和同学辛苦了!
再见!
拓展延伸:
1、判断铝与下列酸溶液能否反应,若反应,分别生成什么物质?
1)浓盐酸 2)稀盐酸 3)浓硫酸 4)稀硫酸
5)浓硝酸 6)稀硝酸 7)醋酸
根据以上判断,归纳出铝与酸反应的各种情况
A、与非强氧化性的酸反应,一般生成盐和氢气
B、与强氧化性的酸反应,一般不生成氢气
C、常温下,铝遇冷的浓硫酸、浓硝酸钝化
