2011年上海市光明中学高二学业水平考试模拟卷(化学)
文档属性
| 名称 | 2011年上海市光明中学高二学业水平考试模拟卷(化学) |  | |
| 格式 | zip | ||
| 文件大小 | 207.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | |||
| 科目 | 化学 | ||
| 更新时间 | 2011-06-27 17:25:14 | ||
图片预览



文档简介
2011年上海市光明中学高中学业水平考试卷化学
(考试时间90分钟,满分100分)
相对原子质量:H-1 C-12 O-16 S-32 Cl-35.5 K-39 Na-23 Cu-64
一、选择题(每题只有一个正确的选项。每小题2分,共44分)
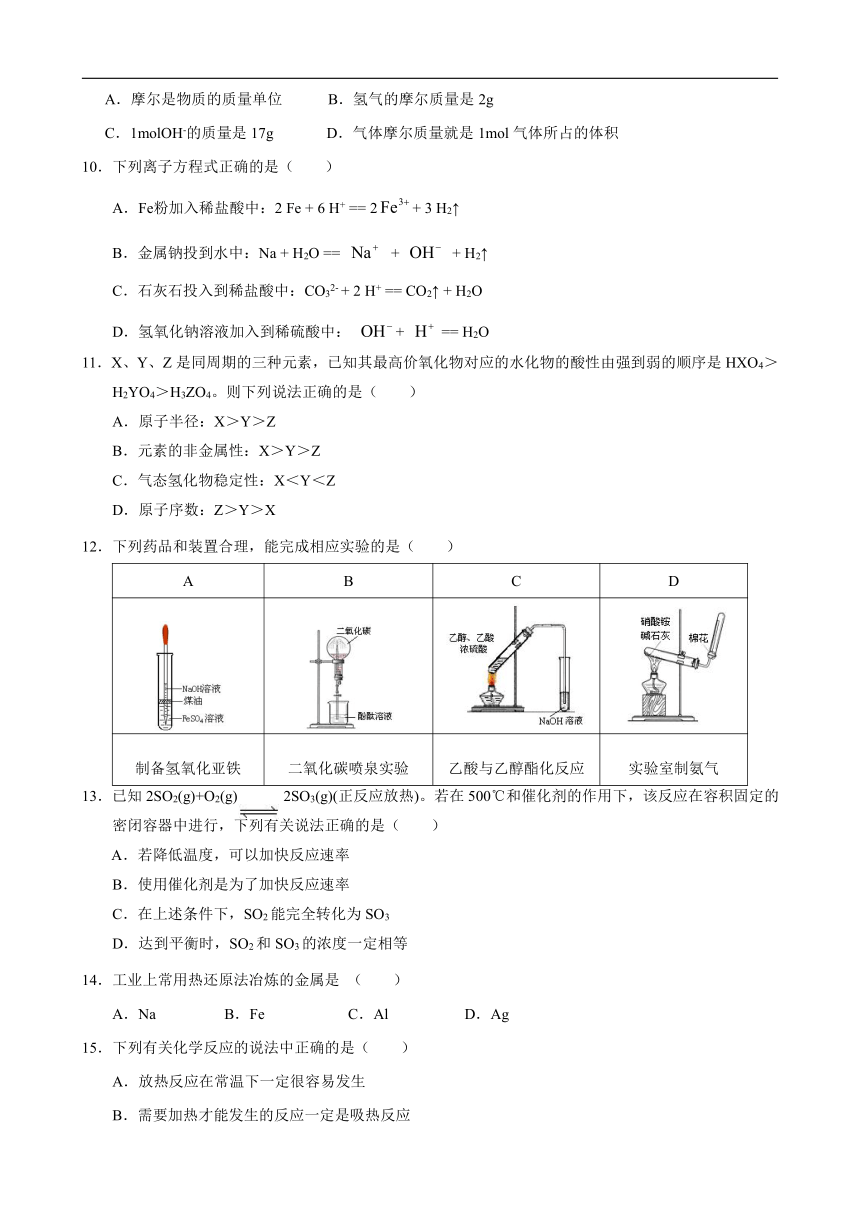
1.实验室盛装浓硫酸的试剂瓶应贴有的安全使用标识是( )
A B C D
2.下列物质既能与盐酸反应放出气体,又能与氢氧化钠溶液反应放出气体的是( )
A.Al(OH)3 B. Al2O3 C. Al D. NaHCO3
3.C是确定NA标准的原子,C原子核内中子数是( )
A.12 B.6 C.18 D.4
4.下列各图所示的分子结构模型中,分子式为CH4的是( )
A B C D
5.下列物质中,属于电解质的是( )
A.液氨 B.蔗糖 C.稀硫酸 D.固体氯化钠
6.下列关于氯气的物理性质描述不正确的是( )
A.黄绿色 B.有刺激性气味 C. 密度比空气大 D.无毒
7.下列反应属于氧化还原反应的是( )
A.H2SO4+2NaOH Na2SO4+2H2O
B.MnO2 + 4HClMnCl2 + Cl2↑+ 2H2O
C.NH3 + HCl NH4Cl
D.2NaHCO3 Na2CO3 + CO2↑ + H2O
8.下列反应属于吸热反应的是( )
A.生石灰与水的反应 B.水变成水蒸气
C.天然气与氧气的反应 D.Ba(OH)2·8H2O与NH4Cl的反应
9.下列说法正确的是( )
A.摩尔是物质的质量单位 B.氢气的摩尔质量是2g
C.1molOH-的质量是17g D.气体摩尔质量就是1mol气体所占的体积
10.下列离子方程式正确的是( )
A.Fe粉加入稀盐酸中:2 Fe + 6 H+ == 2+ 3 H2↑
B.金属钠投到水中:Na + H2O == + + H2↑
C.石灰石投入到稀盐酸中:CO32- + 2 H+ == CO2↑ + H2O
D.氢氧化钠溶液加入到稀硫酸中: + == H2O
11.X、Y、Z是同周期的三种元素,已知其最高价氧化物对应的水化物的酸性由强到弱的顺序是HXO4>H2YO4>H3ZO4。则下列说法正确的是( )
A.原子半径:X>Y>Z
B.元素的非金属性:X>Y>Z
C.气态氢化物稳定性:X<Y<Z
D.原子序数:Z>Y>X
12.下列药品和装置合理,能完成相应实验的是( )
A B C D
制备氢氧化亚铁 二氧化碳喷泉实验 乙酸与乙醇酯化反应 实验室制氨气
13.已知2SO2(g)+O2(g) 2SO3(g)(正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是( )
A.若降低温度,可以加快反应速率
B.使用催化剂是为了加快反应速率
C.在上述条件下,SO2能完全转化为SO3
D.达到平衡时,SO2和SO3的浓度一定相等
14.工业上常用热还原法冶炼的金属是 ( )
A.Na B.Fe C.Al D.Ag
15.下列有关化学反应的说法中正确的是( )
A.放热反应在常温下一定很容易发生
B.需要加热才能发生的反应一定是吸热反应
C.根据能量守恒定律,贮存在物质中的化学能在化学反应前后是不变的
D.化学反应是吸热还是放热必须看反应物和生成物所具有的总能量的相对大小
16.关于右图所示装置的说法中,不正确的是( )
A.铜片上发生氧化反应
B.电子由锌片通过导线流向铜片
C.该装置能将化学能转化为电能
D.锌片是该装置的负极
17.在一定条件下,密闭容器中发生可逆反应:N2(g) + 3H2(g) 2NH3(g) 。下列说法中,表明这一反应已经达到化学平衡状态的是 ( )
A. N2、H2、NH3的浓度不再变化 B. N2、H2、NH3的浓度相等
C.N2、H2、NH3在密闭容器中共存 D.反应停止,正、逆反应速率都等于零
18.实验室里需要480mL 0.10mol/L的CuSO4溶液,以下操作正确的是( )
A.称取12.5g胆矾(CuSO4·5 H2O),溶于500mL水配成溶液
B.称取12.0g胆矾(CuSO4·5 H2O),配成500mL溶液
C.称取1.0g CuSO4,配成500mL溶液
D.称取12.5g胆矾(CuSO4·5 H2O),配成500mL溶液
19.下列分离或提纯物质所用的方法不正确的是( )
A.用加热的方法除去Na2CO3中混有的NaHCO3
B.用分液的方法分离乙醛和水的混合物
C.用萃取的方法提取碘水中的碘
D.用结晶的方法分离氯化钠和硝酸钾的混合物
20.完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3三溶液中的Cl-,消耗等物质的量浓度的AgNO3溶液的体积比为3︰2︰1,则上述三溶液的体积比为( )
A.1︰1︰1 B.3︰2︰1 C.6︰3︰2 D.9︰3︰1
21.下列说法中正确的是 ( )
A.H2的摩尔质量是2 g
B.1.8 g H2O中含有电子的物质的量是0.1 mol
C.1mol O2和1molN2所占有的体积均约是22.4 L
D.N2和N2O混合气体中含有2mol N,则混合气的物质的量是1mol
22.实验室里需要480mL 0.10mol/L的CuSO4溶液,以下操作正确的是
A.称取12.5g胆矾(CuSO4·5 H2O),溶于500mL水配成溶液
B.称取12.0g胆矾(CuSO4·5 H2O),配成500mL溶液
C.称取1.0g CuSO4,配成500mL溶液
D.称取12.5g胆矾(CuSO4·5 H2O),配成500mL溶液
答题卡
题号 1 2 3 4 5 6 7 8 9 10
答案
题号 11 12 13 14 15 16 17 18 19 20
答案
题号 21 22
答案
二、填空题
23.(3分)氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。该反应中氧化剂是___________,若反应中转移了3mol电子,则生成了 ___________molN2。工作人员通过能否看到白烟判断管道是否漏气,请结合上述反应,写出生成白烟的化学方程式 。
24.(4分)现有下列四种物质:① SiO2、② NH3、③ Na2CO3、④ Al2(SO4)3。其中,俗称为“苏打”的是____(填序号,下同),极易溶于水的气体是____,向其溶液中,逐滴加入氢氧化钠溶液,先产生白色沉淀,后沉淀溶解的是____,为石英主要成份的是____。
25.(4分)对于钠、铝两种金属单质。请回答:
(1)两种元素都为周期表中的第____周期元素,根据周期表中的位置,可判断钠的金属性比铝____(填“强”或“弱”)。
(2)硫酸铝和碳酸氢钠是常见的两种盐,其中焰色反应为黄色的是____(填化学式)。
(3)将铝单质放入氢氧化钠溶液,会产生氢气,其反应的化学方程式为:
_____________________________________。
26.(6分)实验室利用4HCl(浓)+MnO2Cl2↑+MnCl2+2H2O反应制备少量的氯气,该反应中氧化剂是______________,生成标准状况下2.24L的Cl2时,参加反应的HCl的物质的量是_________mol,其中被还原的HCl的物质的量是________mol。铁在氯气中燃烧的化学方程式是__________________________________;将产物溶于水,向该溶液中滴加KSCN溶液,观察到溶液变为__________,说明溶液中有______(填“+2价”或“+3价”)铁离子。
27.(8分)X、Y、Z三种元素位于元素周期表的不同短周期内,X与Z属于同主族元素,Z元素的焰色反应为黄色。X单质与Y单质相互化合可以得到X2Y和X2Y2两种液体化合物,Z单质与Y单质相互化合可以得到Z2Y与Z2Y2两种固体化合物,其中Z、Z2Y、Z2Y2都能与X2Y反应生成一种能使无色酚酞变红的ZYX溶液。
(1)试推测X、Y所代表的元素分别为X 、Y (填
元素符号);
(2)写出Z单质与X2Y反应的离子方程式
;
(3)写出Z2Y2与X2Y反应的化学方程式
。
28.(9分)(1)实验室利用右图来制备氨气,该反应的化学方程
式是_______________________________________________,
可以用____________________法收集氨气;氨气能使湿润的酚酞试纸变红,氨气与水反应的方程式是___________________________________。
(2)下列物质含有少量杂质,请在空格中填上适宜的试剂将杂质除去,并写出相应的方程式(是离子反应的写离子方程式)。
物质 杂质 试剂 化学(离子)方程式
①CO2 HCl
②Fe(OH)3 Al(OH)3
③CH4 CH2 =CH2
29.(4分)下列四种有机物:
② CH2=CH—CH2 —CH3
③ CH4 ④
(1)用系统命名法命名:
①的名称 _________________________ ;②的名称 ____________________________。
(2)互为同系物的是 _____________(填序号,下同);互为同分异构体的是 ____________。
30.(8分)对于下列有机物,回答问题:
①CH2=CH-CH2COOH ②C2H5OH
(1)写出①中官能团的名称 ____________________;____________________。
(2)能在一定条件下起加聚反应的烃是________(填序号,下同),能与醇反应生成酯的是 ____________,能发生银镜反应的是________,能发生消去反应的是________。
(3)能在一定条件下发生消去反应的是___________。写出①发生加聚反应的方程式:
______________________________________________________。
三、计算题:
31.(4分)”摇头丸”是严厉查禁的毒品.食用该毒品后会使头颈摇摆不停,严重破坏中枢神经,已知某摇头丸的主要成分为M,M分子中含碳80.0%,氢9.63%,氮10.37%,它的蒸汽密度是氢气的67.5倍。求:
(1)M的相对分子质量________;(2)M的分子式________ 。
32.向100mL含HCl的AlCl3溶液中逐滴加入0.1 mol·L-1的NaOH溶液,加入NaOH溶液的体积V(mL)与产生Al(OH)3沉淀的物质的量n(mol)的关系如图:
试计算:
(1)原溶液中HCl的物质的量浓度。
(2)原溶液中AlCl3的物质的量浓度。
2011年光明中学高中学业水平考试卷参考答案
一、选择题(共44分)
题号 1 2 3 4 5 6 7 8 9 10
答案 A C B A D D B B C D
题号 11 12 13 14 15 16 17 18 19 20
答案 B A B B D A A D C D
题号 21 22
答案 D D
二、填空题
23.(3分,每空1分)Cl2 ;0.5 ;NH3+HCl=NH4Cl
24.(4分,每空1分)③;② ;④ ;①
25.(4分,每空1分)
(1)三;强
(2)NaHCO3
(3)2Al + 2NaOH + 2H2O === 2NaAlO2 + 3H2↑
26.(6分,每空1分)MnO2 ,0.4 mol ,0.2mol 。2Fe+3Cl22FeCl3 ,红色,+3价
27.(8分,每空2分)
(1) H;O
(2)2Na + 2H2O = 2Na+ + 2OH— + H2↑
(3)2Na2O2 + 2H2O = 4NaOH + O2↑
28.(9分,每空1分)
(1)2NH4Cl+Ca(OH)2===2NH3↑+2H2O+CaCl2 ,向下排气集气法,NH3 + H2O = NH3· H2O
(2)
试剂 离子/化学方程式
NaHCO3溶液 HCO3—+H+=CO2↑+H2O
NaOH溶液 Al(OH)3 +OH—=AlO2—+ 2H2O
溴水 CH2 =CH2+Br2 →CH2 BrCH2 Br
29.(4分,每空1分)
(1) 2—甲基丁烷 ; 2—丁烯
(2) ①和③ ; ②和④
30.(8分,每空1分)
(1)碳碳双键;羧基
(2)④;①;③;②③
(3)③;加聚反应方程式。
三、计算题
31.(4分,每空2分)
(1)135
(2)C9H13N
32.(6分,每空3分)
(1)0.05mol/L
(2)0.05mol/L
CH3
CH3—CH2—CH—CH3
CH3
CH3—C=CH2
④ CH2=C-CH-C-CH3
CH3
CH3
CH3
CH3
③ CH3-CH-CHO
OH
(考试时间90分钟,满分100分)
相对原子质量:H-1 C-12 O-16 S-32 Cl-35.5 K-39 Na-23 Cu-64
一、选择题(每题只有一个正确的选项。每小题2分,共44分)
1.实验室盛装浓硫酸的试剂瓶应贴有的安全使用标识是( )
A B C D
2.下列物质既能与盐酸反应放出气体,又能与氢氧化钠溶液反应放出气体的是( )
A.Al(OH)3 B. Al2O3 C. Al D. NaHCO3
3.C是确定NA标准的原子,C原子核内中子数是( )
A.12 B.6 C.18 D.4
4.下列各图所示的分子结构模型中,分子式为CH4的是( )
A B C D
5.下列物质中,属于电解质的是( )
A.液氨 B.蔗糖 C.稀硫酸 D.固体氯化钠
6.下列关于氯气的物理性质描述不正确的是( )
A.黄绿色 B.有刺激性气味 C. 密度比空气大 D.无毒
7.下列反应属于氧化还原反应的是( )
A.H2SO4+2NaOH Na2SO4+2H2O
B.MnO2 + 4HClMnCl2 + Cl2↑+ 2H2O
C.NH3 + HCl NH4Cl
D.2NaHCO3 Na2CO3 + CO2↑ + H2O
8.下列反应属于吸热反应的是( )
A.生石灰与水的反应 B.水变成水蒸气
C.天然气与氧气的反应 D.Ba(OH)2·8H2O与NH4Cl的反应
9.下列说法正确的是( )
A.摩尔是物质的质量单位 B.氢气的摩尔质量是2g
C.1molOH-的质量是17g D.气体摩尔质量就是1mol气体所占的体积
10.下列离子方程式正确的是( )
A.Fe粉加入稀盐酸中:2 Fe + 6 H+ == 2+ 3 H2↑
B.金属钠投到水中:Na + H2O == + + H2↑
C.石灰石投入到稀盐酸中:CO32- + 2 H+ == CO2↑ + H2O
D.氢氧化钠溶液加入到稀硫酸中: + == H2O
11.X、Y、Z是同周期的三种元素,已知其最高价氧化物对应的水化物的酸性由强到弱的顺序是HXO4>H2YO4>H3ZO4。则下列说法正确的是( )
A.原子半径:X>Y>Z
B.元素的非金属性:X>Y>Z
C.气态氢化物稳定性:X<Y<Z
D.原子序数:Z>Y>X
12.下列药品和装置合理,能完成相应实验的是( )
A B C D
制备氢氧化亚铁 二氧化碳喷泉实验 乙酸与乙醇酯化反应 实验室制氨气
13.已知2SO2(g)+O2(g) 2SO3(g)(正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是( )
A.若降低温度,可以加快反应速率
B.使用催化剂是为了加快反应速率
C.在上述条件下,SO2能完全转化为SO3
D.达到平衡时,SO2和SO3的浓度一定相等
14.工业上常用热还原法冶炼的金属是 ( )
A.Na B.Fe C.Al D.Ag
15.下列有关化学反应的说法中正确的是( )
A.放热反应在常温下一定很容易发生
B.需要加热才能发生的反应一定是吸热反应
C.根据能量守恒定律,贮存在物质中的化学能在化学反应前后是不变的
D.化学反应是吸热还是放热必须看反应物和生成物所具有的总能量的相对大小
16.关于右图所示装置的说法中,不正确的是( )
A.铜片上发生氧化反应
B.电子由锌片通过导线流向铜片
C.该装置能将化学能转化为电能
D.锌片是该装置的负极
17.在一定条件下,密闭容器中发生可逆反应:N2(g) + 3H2(g) 2NH3(g) 。下列说法中,表明这一反应已经达到化学平衡状态的是 ( )
A. N2、H2、NH3的浓度不再变化 B. N2、H2、NH3的浓度相等
C.N2、H2、NH3在密闭容器中共存 D.反应停止,正、逆反应速率都等于零
18.实验室里需要480mL 0.10mol/L的CuSO4溶液,以下操作正确的是( )
A.称取12.5g胆矾(CuSO4·5 H2O),溶于500mL水配成溶液
B.称取12.0g胆矾(CuSO4·5 H2O),配成500mL溶液
C.称取1.0g CuSO4,配成500mL溶液
D.称取12.5g胆矾(CuSO4·5 H2O),配成500mL溶液
19.下列分离或提纯物质所用的方法不正确的是( )
A.用加热的方法除去Na2CO3中混有的NaHCO3
B.用分液的方法分离乙醛和水的混合物
C.用萃取的方法提取碘水中的碘
D.用结晶的方法分离氯化钠和硝酸钾的混合物
20.完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3三溶液中的Cl-,消耗等物质的量浓度的AgNO3溶液的体积比为3︰2︰1,则上述三溶液的体积比为( )
A.1︰1︰1 B.3︰2︰1 C.6︰3︰2 D.9︰3︰1
21.下列说法中正确的是 ( )
A.H2的摩尔质量是2 g
B.1.8 g H2O中含有电子的物质的量是0.1 mol
C.1mol O2和1molN2所占有的体积均约是22.4 L
D.N2和N2O混合气体中含有2mol N,则混合气的物质的量是1mol
22.实验室里需要480mL 0.10mol/L的CuSO4溶液,以下操作正确的是
A.称取12.5g胆矾(CuSO4·5 H2O),溶于500mL水配成溶液
B.称取12.0g胆矾(CuSO4·5 H2O),配成500mL溶液
C.称取1.0g CuSO4,配成500mL溶液
D.称取12.5g胆矾(CuSO4·5 H2O),配成500mL溶液
答题卡
题号 1 2 3 4 5 6 7 8 9 10
答案
题号 11 12 13 14 15 16 17 18 19 20
答案
题号 21 22
答案
二、填空题
23.(3分)氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。该反应中氧化剂是___________,若反应中转移了3mol电子,则生成了 ___________molN2。工作人员通过能否看到白烟判断管道是否漏气,请结合上述反应,写出生成白烟的化学方程式 。
24.(4分)现有下列四种物质:① SiO2、② NH3、③ Na2CO3、④ Al2(SO4)3。其中,俗称为“苏打”的是____(填序号,下同),极易溶于水的气体是____,向其溶液中,逐滴加入氢氧化钠溶液,先产生白色沉淀,后沉淀溶解的是____,为石英主要成份的是____。
25.(4分)对于钠、铝两种金属单质。请回答:
(1)两种元素都为周期表中的第____周期元素,根据周期表中的位置,可判断钠的金属性比铝____(填“强”或“弱”)。
(2)硫酸铝和碳酸氢钠是常见的两种盐,其中焰色反应为黄色的是____(填化学式)。
(3)将铝单质放入氢氧化钠溶液,会产生氢气,其反应的化学方程式为:
_____________________________________。
26.(6分)实验室利用4HCl(浓)+MnO2Cl2↑+MnCl2+2H2O反应制备少量的氯气,该反应中氧化剂是______________,生成标准状况下2.24L的Cl2时,参加反应的HCl的物质的量是_________mol,其中被还原的HCl的物质的量是________mol。铁在氯气中燃烧的化学方程式是__________________________________;将产物溶于水,向该溶液中滴加KSCN溶液,观察到溶液变为__________,说明溶液中有______(填“+2价”或“+3价”)铁离子。
27.(8分)X、Y、Z三种元素位于元素周期表的不同短周期内,X与Z属于同主族元素,Z元素的焰色反应为黄色。X单质与Y单质相互化合可以得到X2Y和X2Y2两种液体化合物,Z单质与Y单质相互化合可以得到Z2Y与Z2Y2两种固体化合物,其中Z、Z2Y、Z2Y2都能与X2Y反应生成一种能使无色酚酞变红的ZYX溶液。
(1)试推测X、Y所代表的元素分别为X 、Y (填
元素符号);
(2)写出Z单质与X2Y反应的离子方程式
;
(3)写出Z2Y2与X2Y反应的化学方程式
。
28.(9分)(1)实验室利用右图来制备氨气,该反应的化学方程
式是_______________________________________________,
可以用____________________法收集氨气;氨气能使湿润的酚酞试纸变红,氨气与水反应的方程式是___________________________________。
(2)下列物质含有少量杂质,请在空格中填上适宜的试剂将杂质除去,并写出相应的方程式(是离子反应的写离子方程式)。
物质 杂质 试剂 化学(离子)方程式
①CO2 HCl
②Fe(OH)3 Al(OH)3
③CH4 CH2 =CH2
29.(4分)下列四种有机物:
② CH2=CH—CH2 —CH3
③ CH4 ④
(1)用系统命名法命名:
①的名称 _________________________ ;②的名称 ____________________________。
(2)互为同系物的是 _____________(填序号,下同);互为同分异构体的是 ____________。
30.(8分)对于下列有机物,回答问题:
①CH2=CH-CH2COOH ②C2H5OH
(1)写出①中官能团的名称 ____________________;____________________。
(2)能在一定条件下起加聚反应的烃是________(填序号,下同),能与醇反应生成酯的是 ____________,能发生银镜反应的是________,能发生消去反应的是________。
(3)能在一定条件下发生消去反应的是___________。写出①发生加聚反应的方程式:
______________________________________________________。
三、计算题:
31.(4分)”摇头丸”是严厉查禁的毒品.食用该毒品后会使头颈摇摆不停,严重破坏中枢神经,已知某摇头丸的主要成分为M,M分子中含碳80.0%,氢9.63%,氮10.37%,它的蒸汽密度是氢气的67.5倍。求:
(1)M的相对分子质量________;(2)M的分子式________ 。
32.向100mL含HCl的AlCl3溶液中逐滴加入0.1 mol·L-1的NaOH溶液,加入NaOH溶液的体积V(mL)与产生Al(OH)3沉淀的物质的量n(mol)的关系如图:
试计算:
(1)原溶液中HCl的物质的量浓度。
(2)原溶液中AlCl3的物质的量浓度。
2011年光明中学高中学业水平考试卷参考答案
一、选择题(共44分)
题号 1 2 3 4 5 6 7 8 9 10
答案 A C B A D D B B C D
题号 11 12 13 14 15 16 17 18 19 20
答案 B A B B D A A D C D
题号 21 22
答案 D D
二、填空题
23.(3分,每空1分)Cl2 ;0.5 ;NH3+HCl=NH4Cl
24.(4分,每空1分)③;② ;④ ;①
25.(4分,每空1分)
(1)三;强
(2)NaHCO3
(3)2Al + 2NaOH + 2H2O === 2NaAlO2 + 3H2↑
26.(6分,每空1分)MnO2 ,0.4 mol ,0.2mol 。2Fe+3Cl22FeCl3 ,红色,+3价
27.(8分,每空2分)
(1) H;O
(2)2Na + 2H2O = 2Na+ + 2OH— + H2↑
(3)2Na2O2 + 2H2O = 4NaOH + O2↑
28.(9分,每空1分)
(1)2NH4Cl+Ca(OH)2===2NH3↑+2H2O+CaCl2 ,向下排气集气法,NH3 + H2O = NH3· H2O
(2)
试剂 离子/化学方程式
NaHCO3溶液 HCO3—+H+=CO2↑+H2O
NaOH溶液 Al(OH)3 +OH—=AlO2—+ 2H2O
溴水 CH2 =CH2+Br2 →CH2 BrCH2 Br
29.(4分,每空1分)
(1) 2—甲基丁烷 ; 2—丁烯
(2) ①和③ ; ②和④
30.(8分,每空1分)
(1)碳碳双键;羧基
(2)④;①;③;②③
(3)③;加聚反应方程式。
三、计算题
31.(4分,每空2分)
(1)135
(2)C9H13N
32.(6分,每空3分)
(1)0.05mol/L
(2)0.05mol/L
CH3
CH3—CH2—CH—CH3
CH3
CH3—C=CH2
④ CH2=C-CH-C-CH3
CH3
CH3
CH3
CH3
③ CH3-CH-CHO
OH
同课章节目录
