浙江省各地2018—2020年中考科学试题分类汇编--专题十一 酸碱盐
文档属性
| 名称 | 浙江省各地2018—2020年中考科学试题分类汇编--专题十一 酸碱盐 |  | |
| 格式 | zip | ||
| 文件大小 | 751.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-07-28 22:08:32 | ||
图片预览



文档简介
专题十一
酸碱盐
一、单选题
1.(2020·台州)盛石灰水的试剂瓶存放久了,内壁常附有一层白膜,除去这层白膜最合适的试剂是(
??)
A.?蒸馏水??????????????????????????B.?稀盐酸??????????????????????????C.?硫酸铜溶液??????????????????????????D.?氢氧化钠溶液
2.(2020·湖州)除去下列物质中混有的少量杂质,下列方案不可行的是(???
)
选项
物质
杂质
方案
A
Cu粉
Zn粉
加入足量CuCl2溶液后过滤、洗涤、干燥
B
CO气体
CO2气体
通过足量的氢氧化钠溶液后干燥
C
NaCl固体
Na2CO3固体
加入足量的稀盐酸后蒸发
D
BaCO3固体
BaCl2固体
加水溶解再通入足量的二氧化碳后蒸发
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
3.(2020·宁波)某锥形瓶内盛有盐酸和氯化铜的混合溶液100g,向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。下列说法错误的是(
?)
A.?反应至A点时,所加NaOH溶液的质量为40g
B.?反应至A点时,溶液中的溶质有CuCl2和NaCl
C.?反应至B点时,锥形瓶内溶液的质量为280.4g
D.?反应至B点时,锥形瓶内溶液中NaCl的质量为23.4g
4.(2020·温州)新鲜果汁是常见的饮料,下列四种饮料呈弱碱性的是(???
)
A.?柠檬汁(pH:2~3)
????????????????????????B.?苹果汁(pH:3~4)
C.?西瓜汁(pH:5~6)
?????????????????????????D.?玉米汁(pH:7~8)
5.(2020·嘉兴)学习了物质分类与转化规律后,某同学绘制了部分物质间相互反应的关系图。图中阴影部分表示相邻两类物质的反应,其中不能用于制取ZnCl2的是(
?)
A.?①?????????????????????????????????????????B.?②?????????????????????????????????????????C.?③?????????????????????????????????????????D.?④
6.(2020·杭州)小金完成了图示实验①②③,下列判断正确的是(???
)
A.?实验①中石灰水有剩余???????????????????????????????????????B.?实验②中有气泡产生
C.?实验③中没有明显现象???????????????????????????????????????D.?实验③所得溶液中一定含CaCl2和NaCl
7.(2019·台州)某同学对Fe2O3做了如图探究活动,已知氯气在水溶液中能将Fe2+转变为Fe3+
,
且每一步都充分反应。下列分析正确的是(??
)
A.?无色气体可以使澄清石灰水变浑浊??????????????????????B.?黑色粉末是Fe3O4
C.?①过程Fe2O3中的氧元素全部转人无色气体????????D.?②过程有置换反应发生
8.(2019·杭州)在①氧化铁②金属锌③氢氧化铜④氯化铜溶液四种物质中,跟稀硫酸、稀盐酸都能发生反应且均反应中表现了“酸的通性”的组合是(??
)
A.?①②③④???????????????????????????????B.?①②③???????????????????????????????C.?①③④???????????????????????????????D.?②③④
9.(2019·杭州)下列实验中,实验原理和主要操作方法都符合实验目的的是验目的(??
)
实验目的
实验原理
主要操作方法
A
除去粗盐中的泥沙
各成分的溶解性差异
蒸发
B
分离水与酒精的混合物
各成分的密度差异
蒸馏
C
鉴别稀盐酸和稀硫酸
酸根离子的化学性质差异
加碳酸钠溶液,观察产生气泡快慢
D
除去FeSO4、CuSO4混合溶液中的CuSO4
金属活动性差异
加过量铁粉,充分反应后过滤
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
10.(2019·湖州)等质量的氢氧化钠溶液和稀盐酸混合后,若所得溶液pH=7,则(??
)
A.?所用氢氧化钠溶液和稀盐酸的溶质质量分数相等?????B.?混合溶液中钠离子与氯离子个数相等
C.?混合前后水分子总数不变????????????????????????????????????????D.?混合前后阳离子总数不变
11.(2019·衢州)室温时,在氢氧化钠溶液与盐酸反应中,测得溶液的pH随滴入溶液体积变化情况如图。下列说法错误的是(??
)
A.?所得溶液的pH随加入溶液体积的变化是不均匀的
B.?该实验是将盐酸逐滴加入一定量的氢氧化钠溶液中
C.?当滴入溶液体积为5mL时,所得溶液中含有两种溶质
D.?当滴入溶液体积为20mL时,所得溶液能使酚酞试液变红色
12.(2019·衢州)1784年,科学家卡文迪什演示了“人工空气”的燃烧,发现燃烧产物只有水。据此判断“人工空气”是(??
)
A.?氢气??????????????????????????????????B.?氮气??????????????????????????????????C.?二氧化碳??????????????????????????????????D.?氧气
13.(2018·宁波)向盛有20g10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于溶液总质量或溶液pH随盐酸质量变化的关系图(Q点表示恰好完全反应)。其中正确的是(???
)
A.?B.?C.???D.?
14.(2018·杭州)测量是一个把待测的量与公认的标准进行比较的过程。下列实验过程中没有用到这一科学原理的是(??
)
A.?用天平测出某物体的质量????????????????????????????????????B.?用弹簧秤测出测出某物体的重力
C.?用光学显微镜观察小鱼尾鳍内的血液流动???????????D.?用pH试纸测出某溶液的pH
15.(2018·台州)某固体由Ba2+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子构成,取一定质量的该固体样品,进行如下实验:
①将固体溶于水得无色透明溶液,加入足量BaCl2溶液,过滤后得到5克白色沉淀。
②在沉淀中加入过量稀硝酸,仍有3克白色沉淀。
③在滤液中滴加AgNO3溶液,产生白色沉淀。则该固体中一定含有(???
)
A.?Na+、CO32-、SO42-?????????????????????????????????????????B.?Cu2+、CO32-、SO42-
C.?Cl-、CO32-、SO42-???????????????????????????????????????????D.?Na+、Ba2+、Cl-
16.(2018·湖州)在科学实验和生活中,有许多涉及操作上的“先”“后”问题,如果顺序颠倒,就会影响实验效果或导致事故的发生。下列描述的操作中,先后顺序正确的是(???
)
A.?探究温度对唾液淀粉酶催化作用的影响时,先将唾液和淀粉溶液混合并等分为若干份,然后分别在不同温度下水浴??????????B.?氢气还原氧化铜时,先对装有氧化铜的试管加热,然后通入氢气
C.?稀释浓硫酸时,先在烧杯中倒入适量水,然后将浓硫酸沿烧杯壁缓缓倒入水中并用玻璃棒搅拌??????????D.?发现有人接触漏电的家用电器而发生触电事故时,先用手迅速将触电者拉离电器,然后切断电源进行维修
17.(2018·湖州)现有4种试剂:①紫色石蕊试液;②稀硫酸;③碳酸钾溶液;④氯化钡溶液。能用来一次性鉴别稀盐酸、氢氧化钡溶液、碳酸钠溶液的试剂有(???
)
A.?②????????????????????????????????????B.?②③????????????????????????????????????C.?①②③????????????????????????????????????D.?②③④
18.(2018·衢州)小柯给校园里植梾綏小、叶色发黄的植物施用尿素CO(NH2)2
,
尿素是一种(???
)
A.?复合肥????????????????????????????????????B.?氮肥????????????????????????????????????C.?磷肥????????????????????????????????????D.?钾肥
二、填空题
19.(2020·台州)厨房里有两瓶白色固体,分别为食盐(NaCl)
和纯碱(Na2CO3)。
(1)可用于腌制肉类和蔬菜,使食物不易腐败的是________。
(2)为鉴别这两种物质,某同学取少量白色固体,进行如下实验。
方案一:分别滴加少量食醋,有气泡产生的是________。
方案二:加水溶解,分别滴加________溶液,有沉淀产生的是纯碱。
20.(2020·嘉兴)根据物质的特征反应进行物质的鉴别是一种常用的科学方法。现有两瓶失去标签的氯化钠溶液和碳酸钠溶液,分别标为A和B。鉴别试剂有无色酚酞试液、稀盐酸和硝酸银溶液。某同学选用无色酚酞试液进行鉴别,发现A溶液不变色,由此可确定A是________溶液。他还可以选择上述试剂中的________进行鉴别。
21.(2019·台州)物质的酸碱性与我们的生活密切相关。
(1)酸性是因为物质能电离出________,可以使紫色石蕊试液变________色。
(2)酸碱性强弱可用pH表示,通常洗衣粉、香皂呈碱性,即pH________7.
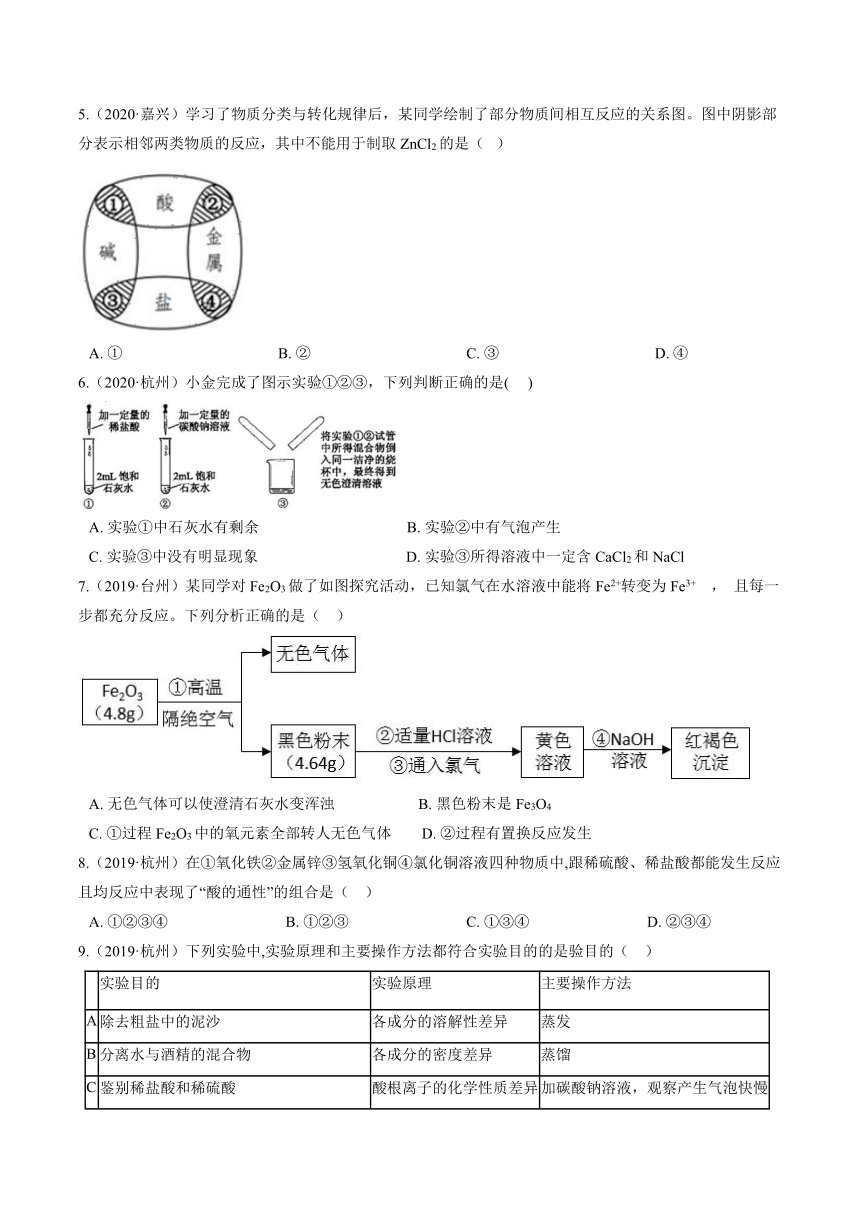
22.(2019·宁波)某气体可能由CO、H2、水蒸气中的一种或几种组成。小科利用下图的装置探究其成分,已知无水硫酸铜遇水会变蓝色。
(1)甲装置中盛放的液体是________?。
(2)实验过程中观察到无水硫酸铜不变色,澄清石灰水变浑浊,则原气体中一定含有________?(填化学式),同时乙装置中黑色固体变________色。
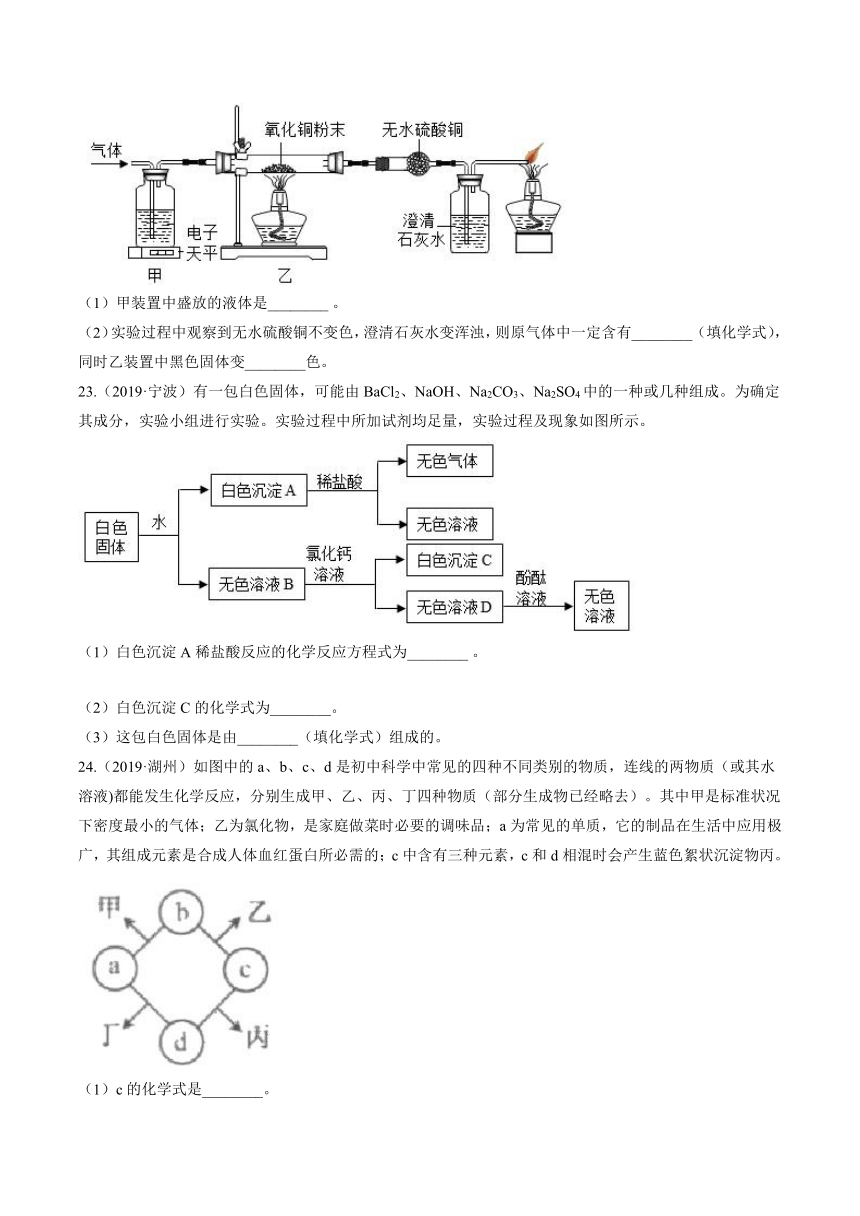
23.(2019·宁波)有一包白色固体,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,实验小组进行实验。实验过程中所加试剂均足量,实验过程及现象如图所示。
(1)白色沉淀A稀盐酸反应的化学反应方程式为________?。
(2)白色沉淀C的化学式为________。
(3)这包白色固体是由________(填化学式)组成的。
24.(2019·湖州)如图中的a、b、c、d是初中科学中常见的四种不同类别的物质,连线的两物质(或其水溶液)都能发生化学反应,分别生成甲、乙、丙、丁四种物质(部分生成物已经略去)。其中甲是标准状况下密度最小的气体;乙为氯化物,是家庭做菜时必要的调味品;a为常见的单质,它的制品在生活中应用极广,其组成元素是合成人体血红蛋白所必需的;c中含有三种元素,c和d相混时会产生蓝色絮状沉淀物丙。
(1)c的化学式是________。
(2)a与b反应的化学方程式是________。
(3)c与d反应的基本类型属于________。
25.(2019·金华)有一包白色固体样品,可能含氢氧化钠、硝酸钠、碳酸钠、硫酸钠、氯化钡中的一种或几种。
小金同学为探究其成分完成了以下实验:
①取少量白色固体溶于水,得到无色溶液,等分为两份;
②往一份无色溶液中加人稀硫酸,产生沉淀质量与所加稀硫酸质量关系如图所示;
③往另一份无色溶液中通入适量的CO2
,
产生白色沉淀。
请回答:
(1)仅根据②推测原样品中一定不存在的物质是________;
(2)原样品的所有可能组成是________。
26.(2019·金华)A、B、C为初中科学常见的三种无机物,它们之间有如图所示的转化关系(“→”表示某一种物质经一步反应可转化为另一种物质,部分反应物、生成物及反应条件已略去)。请回答:
(1)若C是气体,它能使带火星的木条复燃,A、B所属的物质类别和组成元素都相同,则A→B的化学方程式为________;
(2)若A为光合作用的原料之一,A与B属于不同物质类别,B和C属于同种物质类别,A、B、C三种物质中都含有相同的两种元素,则C可能的物质类别是________。
27.(2018·杭州)某化工厂利用含有1%-2%BaCO3的废料制取BaCl2(废料中其他物质不溶于水和稀盐酸、且不与稀盐酸反应)。其部分流程如下:
滤渣必须经过充分洗涤,确保其中Ba2+含量达到规定标准才能作为固体废弃物处理,检验Ba2+的试剂可用________,洗涤滤渣的主要目的是________。
28.(2018·绍兴)有一固体物质可能含有硫酸钾、硝酸铵、氯化钡中的一种或几种.现需要对此物质成分进行检侧。甲同学向固体中加入足量的水,形成无色溶液;乙同学向固体中加入足量氢氧化钡溶液,产生白色沉淀,放出刺激性气体。
(1)该气体为________(写化学式)。
(2)根据两同学的实验现象可推定此物质的组成是________。
29.(2018·金华)A,B,C,D是初中科学常见的四种物质,其中A,B属于相同物质类别的化合物,C,D物质类别不同,它们之间的转化和反应关系如图。图中“→”表示某一种物质经一步反
应可转化为另一种物质,“一”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去,请回答:
(1)若C是二氧化碳,B是氢氧化钙,则B→A的化学方程式是________;
(2)若C是锌,A和B都属于酸,写出D可能的化学式________(物质类别不同的两种即可)
30.(2018·金华)有一包白色固体可能含有碳酸钠、硫酸钠、硝酸钡、氢氧化钠中的一种或几种.某个科学兴趣小组为探究其成分做了以下实验:
①取少量固体于烧杯中,加足量的水溶解,烧杯内有固体残留并得到无色溶液甲;
②取少量无色溶液甲于试管中,滴加酚酞溶液,溶液不变色;
③继续向①的烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸质量的变化如图所示。
?
(1)仅通过①可以得出的结论是:原白色固体中一定有________;
(2)无色溶液甲中一定不存在的物质是(???
)(填字母)
A.碳酸钠
B.硫酸钠
C.硝酸钡
D.氢氧化钠
三、解答题
31.(2020·湖州)有一包白色粉末,可能含氯化钠、氢氧化钠、碳酸钠中的一种或几种。为了确定其组成,小明称取了9.3克粉末,向其中加人100克7.3%的稀盐酸充分反应,生成的二氧化碳气体完全逸出(忽略其他物质逸出),所得溶液的质量为107.1克。用pH试纸检测溶液呈中性。
(1)产生二氧化碳气体的化学反应方程式为________。
(2)这包白色粉末的成分为________。
(3)求所得溶液中溶质的质量分数。(写出计算过程,结果保留一位小数)
32.(2020·绍兴)将12.9克NaCl和Na2CO3固体混合物完全溶于水中形成溶液,再将75克CaCl2溶液分5次加入到该溶液中,充分反应,测得的实验数据如下表。
实验序号
1
2
3
4
5
加入CaCl2溶液质量/克
15
15
15
15
15
生成沉淀的总质量/克
3
m
9
10
10
求:
(1)表格中m的数值是________。
(2)溶液中Na2CO3完全反应是在第________次实验。
(3)固体混合物Na2CO3的质量分数。(精确到0.1%)
(4)请画出上述过程中溶液中NaCl质量的变化图。
33.(2020·嘉兴)复方碳酸氢钠片是一种常用的抗酸剂药物,口服后能迅速中和胃酸,用于缓解胃酸过多引起的胃痛等症状。复方碳酸氢钠片的主要成分是碳酸氢钠(其他成分可溶于水但不参与反应),碳酸氢钠与盐酸反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑。
某科学兴趣小组为了测定药片中碳酸氢钠的含量做了以下实验:先将复方碳酸氢钠片制成粉末,取10克分多次放入盛有100克稀盐酸的烧杯中充分反应。测出加入的粉末质量和反应后的溶液质量,两者质量关系如图所示。
(1)实验后,兴趣小组又往烧杯中加入少量粉末,观察到________,说明上述实验结束时稀盐酸过量。
(2)计算复方碳酸氢钠片中碳酸氢钠的含量。
(3)计算10克粉末与稀盐酸反应后所得氯化钠溶液的溶质质量分数。(计算结果精确到0.1%)
34.(2019·绍兴)为了探究氢氧化钡溶液和硫酸钠溶液反应后所得滤液X的成分,同学们做了以下实验;取50克滤液于烧杯中,天向烧杯中滴加溶质质量分数为6%的硫酸镁溶液20克,接着烧杯中滴加稀硫酸。加入溶液的质量与烧杯内沉淀的质量关系如图所示。
(1)滤液X的pH________7(选填“大于”、“等于”或“小于”)
(2)CD段发生反应的化学方程式为________。
(3)滤液X中含有的溶质是________。
(4)滴加入30克稀硫酸时,烧杯中沉淀的质量m2的值为多少?(写出计算过程)
35.(2019·衢州)某KCl固体样品中含有少量CaCl2杂质,实验室提纯氯化钾的流程如下。(氯化钾溶解度受温度影响较小)
(1)沉淀a是________。
(2)操作Ⅰ是________?。
①冷却热饱和溶液②蒸发结晶
(3)若KCl固体样品中还含有少量杂质K2SO4
,
小科认为提纯该样品只要在上述方案基础上增加一步实验:在“加入过量K2CO3溶液”与“过滤”操作之间,加过量的硝酸钡溶液。小江认为这种方案不合理,会导致所得KCl固体中含有新的杂质,新杂质是________?。
36.(2018·杭州)用“盐酸—硫化钡法”生产BaCl2会放出有毒气体H2S(其水溶液有酸性)可用
NaOH吸收H2S制取Na2S进行处理。下表为H2S回收工艺的各项生产成本:
项目
单价(元/吨)
NaOH
2500
Na2S
5000
辅助费用(以处理1吨H2S计)
1114
(1)工业处理尾气需考虑经济效益和社会效益,根据上述资料分析,单从经济效益考虑这种处理H2S的方法是________(选填“盈利”或“亏损”)的。
(2)若某化工厂每天要处理10吨H2S,需消耗NaOH多少吨?(写出计算过程,结果保留1位小数)
37.(2018·绍兴)实验室有甲乙两瓶久置的氢氧化钠固体,某学习小组为了研究其变质情况,进行了如下实验:(电子秤示数单位为克)
(1)滴入紫色石蕊试液后溶液为红色,说明反应后溶液呈________性。
(2)上述实验中产生的二氧化碳气体质量为________克.
(3)计算甲瓶固体样品中碳酸钠的质量分数。
(4)某同学另取10克乙瓶中的固体样品,用100克15%的稀硫酸按同样方法进行实验,他认为不管固体样品变质程度如何,稀硫酸加人入后,都不需要使用石蕊试液,请计算说明他做出此判断的原因.
38.(2018·金华)某拓展性学习小组在学校科学实验创新比赛中,做了一个有趣的实验,装置如图。
实验设计:三颈烧瓶中充满二氧化碳气体,A颈、B颈分别连接充满氢氧化钠溶液和盐酸的注射器,C有两端开口的玻璃导管(伸入瓶内的一端连有小气球),装置气密性良好。
实验操作:先通过A颈往瓶内注人氢氧化钠溶液,观察到小气球的形状发生了变化;过一段时间后再通过B颈往瓶中注入盐酸,发现小气球的形状又发生了改变。
请描述小气球形状的变化情况,井对此作出合理的解释。
四、实验探究题
39.(2020·台州)某同学要在一块空地上种植作物,于是对这块空地的土壤酸碱度进行测定。
(1)在空地上确定5~6个位置进行取样测定壤酸碱度。以下三种取样位置设定合理的是________。
(2)将采集到的土样进行处理后,用玻璃棒蘸取土壤浸出液,滴在________上,将其呈现的颜色与标准比色卡比色.确定了空地土壤的pH约为7.查阅资料,常见作物最适宜生长的土壤pH范围如下表,则这块空地上适合种植的作物有________。
作物
大蒜
丝瓜
茄子
沙枣
最适pH范围
5.6~6.0
6.0~6.5
6.8~7.3
8.0~8.7
40.(2020·湖州)小明在实验室做镁条和稀盐酸反应的实验时,发现试管中产生大量气体、试管壁发烫。放置较长时间后,管底部有沉淀生成。针对这一现象,小明进行了探究:
(1)小明最初认为试管底部的沉淀可能是镁与稀盐酸反应生成大量的MgCl2不能完全溶于水所致。但随后小明通过实验证实了沉淀不是MgCl2。你认为小明的实验操作是
________。
(2)小明查阅资料知道镁与水在加热的条件下能生成氢氧化镁(难溶性物质)和氢气。于是,他进行了实验验证:将去除氧化膜的镁条和水放在试管中加热,发现镁条表面有少量气泡生成。停止加热后,却始终没有观察到沉淀。请对“没有观察到沉淀”这一结果作出合理的解释。________。
(3)镁与水反应没有观察到沉淀,而镁与稀盐酸混合却有沉淀。小明经过思考,认为沉淀的产生与氯离子有关。后来查阅资料得知,沉淀的主要成分是一种可溶于稀硝酸,并生成氯化镁、硝酸镁和水的碱式氯化镁[Mg(OH)Cl]。请你设计实验验证沉淀中含有氯元素。________。
41.(2020·宁波)在“探究稀盐酸和稀硫酸的化学性质”实验中,小科发现镁带与稀盐酸反应后的试管内出现了灰白沉淀。
【提出问题】灰白色沉淀是什么物质?
【提出猜想】小科在老师指导下,猜想灰白色沉淀是下列物质中的一种或几种:
①镁;②氯化镁;③氢氧化镁;④碱式氯化镁[Mg(OH)Cl]。
老师肯定了小科的猜想,并鼓励他继续进行实验探究。
【实验探究】步骤一:将上述镁带与稀盐酸反应后试管内的物质过滤,得到滤液和灰白色滤渣。
步骤二:取滤液于试管中,加入适量的氯化镁粉末,粉末全部溶解。
步骤三:取少量灰白色滤渣于试管中,加入适量稀盐酸,沉淀全部溶解,无其他现象。
步骤四:将剩余滤渣用蒸馏水充分洗涤。取洗涤后的滤渣于试管中,加入过量稀硝酸,滤渣全部溶解,再加入硝酸银溶液,有白色沉淀产生。
【实验反思及结论】
(1)从步骤二可知,灰白色沉淀不可能是氯化镁,因为滤液是氯化镁的________(填“饱和”或“不饱和”)溶液。
(2)从步骤三可知,该沉淀中没有________。
(3)步骤四中将滤渣用蒸馏水充分洗涤是为了________。
(4)根据实验探究可知,该反应产生的灰白色沉淀中一定含有________。
42.(2020·绍兴)做酸碱实验时,小敏将稀盐酸逐滴加到氢氧化钡溶液中(如图),发现一直无明显现象,突然想起忘记加无色酚酞试液,为探究反应的进程,过程如下:(已知BaCl2溶液呈中性)
(1)【建立猜想】①氢氧化钡过量②盐酸过量③________
(2)【实验设计】步骤一:取少量反应后的溶液于试管中,滴入几滴无色酚酞试液,溶液不变色,得出猜想①错误。
步骤二:继续探究
实验方案
实验操作
实验现象
实验结论
Ⅰ
重新取样,滴加少量AgNO3溶液
白色沉淀
猜想②正确
Ⅱ
重新取样,滴加足量Na2CO3溶液
???
▲??
猜想②正确
白色沉淀
猜想③正确
①对方案Ⅰ的结论进行评价:________。
②表格空白处的实验现象是:________。
(3)【表达交流】为确定猜想②是否正确,还可以选择的试剂有
_________。
A.紫色石蕊试液
B.铜片
C.铁锈
43.(2020·杭州)一种制备氢氧化镁的生产流程如图所示,MgCl2和NaOH按恰好完全反应的比例加料
(1)写出步骤c中发生反应的化学方程式:________
(2)x=________
(3)过滤得到的粗产品还要经过洗涤,洗涤时主要除去的杂质是________。
(4)上述流程中若用下列物质代替氢氧化钠,也能制得氢氧化镁的是________
①盐酸???????
②氯化钙???????
③氨水???????????
④碗酸镁
44.(2019·杭州)某兴趣小组做了如下实验
①在止水夹K1、K2处于关闭状态时,将针筒A中溶液挤入试管B,A滴有酚酞的中,接着打开止水夹K1,发现D氧化钠溶液中的部分溶液被吸入试管B中充分反应后,试管B留下的溶液也显红色
②打开止水夹K2
,
风哨振动鸣叫,。C中的部分溶液被吸入B和D中,反应后B、D中溶液都变为无色。
回答
(1)步骤①中,充分反应后,试管B里的CO2最终转化为________(填化学式)和水
(2)解释步骤②中“风哨振动鸣叫”的原因________。
(3)实验开始时C、D中两种溶液中溶质质量分数大小关系为:a%________b%(选填“>”
“=”
“<”)
45.(2019·金华)某兴趣小组在实验室相对封闭的装置内燃烧某种含碳、氢、氧元素的垃圾,对产生的废气成分(不考虑气态有机物)按如图所示的装置进行检验。
【实验研究】
拉动注射器,让废气依次通过装置。
【实验分析】
(1)能证明废气中有水蒸气存在的现象是________;
(2)F处的大号注射器,可以引导气体流向,其另一个主要作用是________;
(3)【反思评价】小金认为,仅根据E中澄清石灰水变浑浊,无法确定一氧化碳的存在,其理由是________;
(4)小金根据D中的粉末由黑色变为红色,得出废气中存在一氧化碳。小丽认为该结论不够严密,若废气中存在氢气也会出现该现象。要使上述结论更加严密,还应添加的一个实验装置及位置是________。
【实验结果】经检验,废气中存在CO2、CO、H2O。
46.(2018·衢州)为探究一瓶久置的氢氧化钠固体样品是否全部变质,小柯取少量样品配制成溶液,再取少量溶液分别装入两支试管中,进行了如甲、乙两图所示实验。(注:BaCl2溶液呈中性)
(1)小柯认为“甲图实验说明了氢氧化钠固体部分变质”。你认为小柯的观点是否正确,并说明理由。
(2)分析乙图实验的现象,可以确定样品的变质情况为________。
(3)进一步探究:另取少量样品溶液,加入一定质量分数的稀盐酸,直至过量。请在丙图中画出“生成CO2的质量随加入稀盐酸质量变化”的大致图像。
答案解析部分
一、单选题
1.
B
2.
D
3.
D
4.
D
5.
C
6.
D
7.
B
8.
B
9.
D
10.
B
11.
B
12.
A
13.B
14.C
15.A
16.C
17.B
18.B
二、填空题
19.
(1)食盐(NaCl)
(2)纯碱(Na2CO3);CaCl2
(Ba2+、Ca2+的可溶性盐或碱均可)
20.
氯化钠;稀盐酸
21.
(1)H+(或“氢离子”);红
(2)>(或“大于”)
22.
(1)浓硫酸(或浓H2SO4)
(2)CO;红
23.
(1)BaCO3+2HCl=BaCl2+H2O+CO2↑
(2)CacO3
(3)BaCl2、Na2CO3
24.
(1)NaOH
(2)Fe+2HCl=FeCl2+H2↑
(3)复分解反应
25.
(1)Na2CO3和Na2SO4
(2)BaC2、NaOH;BaCl2、NaOH、NaNO3
26.
(1)2H2O2=
=2H2O+O2↑
(2)酸或碱或盐
27.
稀硫酸
;防止固体废弃物中可溶性钡盐对环境的污染
28.
(1)NH3
(2)硫酸钾、硝酸铵
29.
(1)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(2)Na2CO3
,
CuO,NaOH
30.
(1)Ba(NO3)2
(2)A,B,D
三、解答题
31.
(1)2HCl+Na2CO3=2NaCl+CO2↑+H2O
(2)氢氧化钠和碳酸钠
(3)解:设固体粉末中含碳酸钠x克,与碳酸钠反应消耗HCl
y克,
同时生成NaCl
z克:
2HCl+
Na2CO3=
2NaCl+
CO2↑+H2O
36.5×2
106
58.5×2
44
y
x
z
100+9.3-107.1
解得:x=5.3(克)
y=3.65(克)
z=5.85(克)
设固体粉末中含氢氧化钠a克,与盐酸反应后生成NaCl
b克
HCl+
NaOH=
NaCl+H2O
36.5
40
58.5
100×7.3%-3.65
a
b
解得:a=4(克)
b=5.85(克)
因为固体总质量为9.3克,等于碳酸钠与氢氧化钠的质量和,所以固体中无氯化钠。所以,所得溶液中溶质的质量分数=
×100%=10.9%
32.
(1)6
(2)4
(3)解:设固体混合物中Na2CO3质量为x
Na2CO3+CaCl2=2NaCl+
CaCO3↓
106
100
x
10克
求得x=10.6克
Na2CO3%=(10.6克/12.9克)×100%=82.2%
(4)
33.
(1)有气泡产生
(2)解:
m
CO2=100g+10g-105.6g=4.4g
设复方碳酸氢钠片中碳酸氢钠的质量为
x。
NaHCO3+HCl=NaCl+H2O+
CO2↑
84
44
x
4.4g
=
x
=8.4g????
NaHCO3%=
×100%=84%
答:
碳酸氢钠的含量为
84%。
(3)解:设反应生成的氯化钠质量为
y
NaHCO3+HCl=
NaCl+H2O+
CO2↑
58.5
44
y
4.4g
=
y=5.85g
NaCl%=
×100%=5.5%
答:
氯化钠溶液的质量分数为
5.5%。
34.
(1)大于
(2)Mg(OH)2+H2SO4=MgSO4+2H20
(3)Ba(OH)2和NaOH
(4)解:设加入20克硫酸镁溶液时,生成Mg(OH)2沉淀的质量为x。
Ba(OH)2+
MgSO4=BaSO4↓+
Mg(OH)2↓
120
58
20克×6%
x
120:58=1.2克:x??
解得x=0.58克
M2=4.66克+0.58克=5.24克
35.
(1)碳酸钙(CaCO3)
(2)②
(3)硝酸钾和硝酸钡
36.
(1)盈利
(2)解:设需消耗NaOH的质量为x。
2NaOH+
H2S=Na2S
+
2H2O
80
34
x
10t
解得:x≈23.5t
答:需消耗
NaOH
的质量为
23.5
吨。
37.
(1)酸
(2)2.2
(3)设该样品中碳酸钠的质量为x,则
Na2CO3+2HCl=2NaCl+H2O+
CO2↑
106
44
x
2.2克
106:x=44:2.2克,x=5.3克
Na2CO3%=5.3克/10克=53%
(4)假设10克固体样品全部为氢氧化钠,则需要消耗的稀硫酸质量为y
2NaOH+
H2SO4=Na2SO4+2H2O
80
98
10克
y×15%
80:10克=98:(y×15%)
y=81.7克<100克
假设10克固体样品全部变质,则需要消耗的稀硫酸质量为Z
Na2CO3+
H2SO4===Na2SO4+H2O+CO2↑
106
98
10克
z×15
106:10克=98:(z×15%)????
z=61.6克<100克
所以用100克15%的稀硫酸进行此实验,稀硫酸一定过量,故稀硫酸加入后不需要加石蕊试液。
38.
实验现象:小气球“先膨胀,后变瘪”(或“先变大,后变小)
从NaOH吸收CO2
,
HCl与Na2CO3反应生成CO2及导致瓶内气压变化三方面进行:
①2NaOH+CO2=Na2CO3+H2O;
②NaOH溶液吸收CO2
,
使瓶内气压减小,导致气球膨胀;
③Na2CO3+2HCl=2NaCl+H2O+CO2↑;
④HCl与Na2CO3反应生成CO2
,
使瓶内气压增大,导致气球变瘪
四、实验探究题
39.
(1)B
(2)pH试纸;茄子
40.
(1)取少量沉淀于试管中,加入水。
(2)镁和水反应,生成的氢氧化镁覆盖在镁条表面阻止了反应的进行。
(3)取沉淀洗涤干净后,加稀硝酸溶解,再加硝酸银,若有白色沉淀则证明沉淀中含有氯元素。
41.
(1)不饱和
(2)Mg
(3)洗去滤渣表面的氯化镁,防止氯化镁干扰后续实验
(4)Mg(OH)Cl
42.
(1)两者恰好完全反应
(2)该实验结论错误,因为盐酸和氢氧化钡反应会生成氯化钡,无论盐酸是否过量,都会有白色沉淀生成;先出现气泡,后出现白色沉淀
(3)A,C
43.
(1)MgCl2+2NaOH=Mg(OH)2↓+2NaCl
(2)280
(3)氯化钠(或NaCl)
(4)③
44.
(1)Na2CO3
(2)B中CO2气体跟氢氧化钠溶液反应使装置内气压下降,小于外部气压,气流从风哨进入
(3)>
45.
(1)A中的固体由白色变蓝色
(2)收集尾气(或储气)
(3)CO2不一定来自CO和CuO的反应,可能是原来的CO2在B装置没有除尽
(4)在DE之间连接盛有无水硫酸铜的U型管(或在DE之间连接A装置)
46.
(1)不正确,无论氢氧化纳是否全部变质,都能让无色酚酞变红色
(2)部分变质
(3)
酸碱盐
一、单选题
1.(2020·台州)盛石灰水的试剂瓶存放久了,内壁常附有一层白膜,除去这层白膜最合适的试剂是(
??)
A.?蒸馏水??????????????????????????B.?稀盐酸??????????????????????????C.?硫酸铜溶液??????????????????????????D.?氢氧化钠溶液
2.(2020·湖州)除去下列物质中混有的少量杂质,下列方案不可行的是(???
)
选项
物质
杂质
方案
A
Cu粉
Zn粉
加入足量CuCl2溶液后过滤、洗涤、干燥
B
CO气体
CO2气体
通过足量的氢氧化钠溶液后干燥
C
NaCl固体
Na2CO3固体
加入足量的稀盐酸后蒸发
D
BaCO3固体
BaCl2固体
加水溶解再通入足量的二氧化碳后蒸发
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
3.(2020·宁波)某锥形瓶内盛有盐酸和氯化铜的混合溶液100g,向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。下列说法错误的是(
?)
A.?反应至A点时,所加NaOH溶液的质量为40g
B.?反应至A点时,溶液中的溶质有CuCl2和NaCl
C.?反应至B点时,锥形瓶内溶液的质量为280.4g
D.?反应至B点时,锥形瓶内溶液中NaCl的质量为23.4g
4.(2020·温州)新鲜果汁是常见的饮料,下列四种饮料呈弱碱性的是(???
)
A.?柠檬汁(pH:2~3)
????????????????????????B.?苹果汁(pH:3~4)
C.?西瓜汁(pH:5~6)
?????????????????????????D.?玉米汁(pH:7~8)
5.(2020·嘉兴)学习了物质分类与转化规律后,某同学绘制了部分物质间相互反应的关系图。图中阴影部分表示相邻两类物质的反应,其中不能用于制取ZnCl2的是(
?)
A.?①?????????????????????????????????????????B.?②?????????????????????????????????????????C.?③?????????????????????????????????????????D.?④
6.(2020·杭州)小金完成了图示实验①②③,下列判断正确的是(???
)
A.?实验①中石灰水有剩余???????????????????????????????????????B.?实验②中有气泡产生
C.?实验③中没有明显现象???????????????????????????????????????D.?实验③所得溶液中一定含CaCl2和NaCl
7.(2019·台州)某同学对Fe2O3做了如图探究活动,已知氯气在水溶液中能将Fe2+转变为Fe3+
,
且每一步都充分反应。下列分析正确的是(??
)
A.?无色气体可以使澄清石灰水变浑浊??????????????????????B.?黑色粉末是Fe3O4
C.?①过程Fe2O3中的氧元素全部转人无色气体????????D.?②过程有置换反应发生
8.(2019·杭州)在①氧化铁②金属锌③氢氧化铜④氯化铜溶液四种物质中,跟稀硫酸、稀盐酸都能发生反应且均反应中表现了“酸的通性”的组合是(??
)
A.?①②③④???????????????????????????????B.?①②③???????????????????????????????C.?①③④???????????????????????????????D.?②③④
9.(2019·杭州)下列实验中,实验原理和主要操作方法都符合实验目的的是验目的(??
)
实验目的
实验原理
主要操作方法
A
除去粗盐中的泥沙
各成分的溶解性差异
蒸发
B
分离水与酒精的混合物
各成分的密度差异
蒸馏
C
鉴别稀盐酸和稀硫酸
酸根离子的化学性质差异
加碳酸钠溶液,观察产生气泡快慢
D
除去FeSO4、CuSO4混合溶液中的CuSO4
金属活动性差异
加过量铁粉,充分反应后过滤
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
10.(2019·湖州)等质量的氢氧化钠溶液和稀盐酸混合后,若所得溶液pH=7,则(??
)
A.?所用氢氧化钠溶液和稀盐酸的溶质质量分数相等?????B.?混合溶液中钠离子与氯离子个数相等
C.?混合前后水分子总数不变????????????????????????????????????????D.?混合前后阳离子总数不变
11.(2019·衢州)室温时,在氢氧化钠溶液与盐酸反应中,测得溶液的pH随滴入溶液体积变化情况如图。下列说法错误的是(??
)
A.?所得溶液的pH随加入溶液体积的变化是不均匀的
B.?该实验是将盐酸逐滴加入一定量的氢氧化钠溶液中
C.?当滴入溶液体积为5mL时,所得溶液中含有两种溶质
D.?当滴入溶液体积为20mL时,所得溶液能使酚酞试液变红色
12.(2019·衢州)1784年,科学家卡文迪什演示了“人工空气”的燃烧,发现燃烧产物只有水。据此判断“人工空气”是(??
)
A.?氢气??????????????????????????????????B.?氮气??????????????????????????????????C.?二氧化碳??????????????????????????????????D.?氧气
13.(2018·宁波)向盛有20g10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于溶液总质量或溶液pH随盐酸质量变化的关系图(Q点表示恰好完全反应)。其中正确的是(???
)
A.?B.?C.???D.?
14.(2018·杭州)测量是一个把待测的量与公认的标准进行比较的过程。下列实验过程中没有用到这一科学原理的是(??
)
A.?用天平测出某物体的质量????????????????????????????????????B.?用弹簧秤测出测出某物体的重力
C.?用光学显微镜观察小鱼尾鳍内的血液流动???????????D.?用pH试纸测出某溶液的pH
15.(2018·台州)某固体由Ba2+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子构成,取一定质量的该固体样品,进行如下实验:
①将固体溶于水得无色透明溶液,加入足量BaCl2溶液,过滤后得到5克白色沉淀。
②在沉淀中加入过量稀硝酸,仍有3克白色沉淀。
③在滤液中滴加AgNO3溶液,产生白色沉淀。则该固体中一定含有(???
)
A.?Na+、CO32-、SO42-?????????????????????????????????????????B.?Cu2+、CO32-、SO42-
C.?Cl-、CO32-、SO42-???????????????????????????????????????????D.?Na+、Ba2+、Cl-
16.(2018·湖州)在科学实验和生活中,有许多涉及操作上的“先”“后”问题,如果顺序颠倒,就会影响实验效果或导致事故的发生。下列描述的操作中,先后顺序正确的是(???
)
A.?探究温度对唾液淀粉酶催化作用的影响时,先将唾液和淀粉溶液混合并等分为若干份,然后分别在不同温度下水浴??????????B.?氢气还原氧化铜时,先对装有氧化铜的试管加热,然后通入氢气
C.?稀释浓硫酸时,先在烧杯中倒入适量水,然后将浓硫酸沿烧杯壁缓缓倒入水中并用玻璃棒搅拌??????????D.?发现有人接触漏电的家用电器而发生触电事故时,先用手迅速将触电者拉离电器,然后切断电源进行维修
17.(2018·湖州)现有4种试剂:①紫色石蕊试液;②稀硫酸;③碳酸钾溶液;④氯化钡溶液。能用来一次性鉴别稀盐酸、氢氧化钡溶液、碳酸钠溶液的试剂有(???
)
A.?②????????????????????????????????????B.?②③????????????????????????????????????C.?①②③????????????????????????????????????D.?②③④
18.(2018·衢州)小柯给校园里植梾綏小、叶色发黄的植物施用尿素CO(NH2)2
,
尿素是一种(???
)
A.?复合肥????????????????????????????????????B.?氮肥????????????????????????????????????C.?磷肥????????????????????????????????????D.?钾肥
二、填空题
19.(2020·台州)厨房里有两瓶白色固体,分别为食盐(NaCl)
和纯碱(Na2CO3)。
(1)可用于腌制肉类和蔬菜,使食物不易腐败的是________。
(2)为鉴别这两种物质,某同学取少量白色固体,进行如下实验。
方案一:分别滴加少量食醋,有气泡产生的是________。
方案二:加水溶解,分别滴加________溶液,有沉淀产生的是纯碱。
20.(2020·嘉兴)根据物质的特征反应进行物质的鉴别是一种常用的科学方法。现有两瓶失去标签的氯化钠溶液和碳酸钠溶液,分别标为A和B。鉴别试剂有无色酚酞试液、稀盐酸和硝酸银溶液。某同学选用无色酚酞试液进行鉴别,发现A溶液不变色,由此可确定A是________溶液。他还可以选择上述试剂中的________进行鉴别。
21.(2019·台州)物质的酸碱性与我们的生活密切相关。
(1)酸性是因为物质能电离出________,可以使紫色石蕊试液变________色。
(2)酸碱性强弱可用pH表示,通常洗衣粉、香皂呈碱性,即pH________7.
22.(2019·宁波)某气体可能由CO、H2、水蒸气中的一种或几种组成。小科利用下图的装置探究其成分,已知无水硫酸铜遇水会变蓝色。
(1)甲装置中盛放的液体是________?。
(2)实验过程中观察到无水硫酸铜不变色,澄清石灰水变浑浊,则原气体中一定含有________?(填化学式),同时乙装置中黑色固体变________色。
23.(2019·宁波)有一包白色固体,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,实验小组进行实验。实验过程中所加试剂均足量,实验过程及现象如图所示。
(1)白色沉淀A稀盐酸反应的化学反应方程式为________?。
(2)白色沉淀C的化学式为________。
(3)这包白色固体是由________(填化学式)组成的。
24.(2019·湖州)如图中的a、b、c、d是初中科学中常见的四种不同类别的物质,连线的两物质(或其水溶液)都能发生化学反应,分别生成甲、乙、丙、丁四种物质(部分生成物已经略去)。其中甲是标准状况下密度最小的气体;乙为氯化物,是家庭做菜时必要的调味品;a为常见的单质,它的制品在生活中应用极广,其组成元素是合成人体血红蛋白所必需的;c中含有三种元素,c和d相混时会产生蓝色絮状沉淀物丙。
(1)c的化学式是________。
(2)a与b反应的化学方程式是________。
(3)c与d反应的基本类型属于________。
25.(2019·金华)有一包白色固体样品,可能含氢氧化钠、硝酸钠、碳酸钠、硫酸钠、氯化钡中的一种或几种。
小金同学为探究其成分完成了以下实验:
①取少量白色固体溶于水,得到无色溶液,等分为两份;
②往一份无色溶液中加人稀硫酸,产生沉淀质量与所加稀硫酸质量关系如图所示;
③往另一份无色溶液中通入适量的CO2
,
产生白色沉淀。
请回答:
(1)仅根据②推测原样品中一定不存在的物质是________;
(2)原样品的所有可能组成是________。
26.(2019·金华)A、B、C为初中科学常见的三种无机物,它们之间有如图所示的转化关系(“→”表示某一种物质经一步反应可转化为另一种物质,部分反应物、生成物及反应条件已略去)。请回答:
(1)若C是气体,它能使带火星的木条复燃,A、B所属的物质类别和组成元素都相同,则A→B的化学方程式为________;
(2)若A为光合作用的原料之一,A与B属于不同物质类别,B和C属于同种物质类别,A、B、C三种物质中都含有相同的两种元素,则C可能的物质类别是________。
27.(2018·杭州)某化工厂利用含有1%-2%BaCO3的废料制取BaCl2(废料中其他物质不溶于水和稀盐酸、且不与稀盐酸反应)。其部分流程如下:
滤渣必须经过充分洗涤,确保其中Ba2+含量达到规定标准才能作为固体废弃物处理,检验Ba2+的试剂可用________,洗涤滤渣的主要目的是________。
28.(2018·绍兴)有一固体物质可能含有硫酸钾、硝酸铵、氯化钡中的一种或几种.现需要对此物质成分进行检侧。甲同学向固体中加入足量的水,形成无色溶液;乙同学向固体中加入足量氢氧化钡溶液,产生白色沉淀,放出刺激性气体。
(1)该气体为________(写化学式)。
(2)根据两同学的实验现象可推定此物质的组成是________。
29.(2018·金华)A,B,C,D是初中科学常见的四种物质,其中A,B属于相同物质类别的化合物,C,D物质类别不同,它们之间的转化和反应关系如图。图中“→”表示某一种物质经一步反
应可转化为另一种物质,“一”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去,请回答:
(1)若C是二氧化碳,B是氢氧化钙,则B→A的化学方程式是________;
(2)若C是锌,A和B都属于酸,写出D可能的化学式________(物质类别不同的两种即可)
30.(2018·金华)有一包白色固体可能含有碳酸钠、硫酸钠、硝酸钡、氢氧化钠中的一种或几种.某个科学兴趣小组为探究其成分做了以下实验:
①取少量固体于烧杯中,加足量的水溶解,烧杯内有固体残留并得到无色溶液甲;
②取少量无色溶液甲于试管中,滴加酚酞溶液,溶液不变色;
③继续向①的烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸质量的变化如图所示。
?
(1)仅通过①可以得出的结论是:原白色固体中一定有________;
(2)无色溶液甲中一定不存在的物质是(???
)(填字母)
A.碳酸钠
B.硫酸钠
C.硝酸钡
D.氢氧化钠
三、解答题
31.(2020·湖州)有一包白色粉末,可能含氯化钠、氢氧化钠、碳酸钠中的一种或几种。为了确定其组成,小明称取了9.3克粉末,向其中加人100克7.3%的稀盐酸充分反应,生成的二氧化碳气体完全逸出(忽略其他物质逸出),所得溶液的质量为107.1克。用pH试纸检测溶液呈中性。
(1)产生二氧化碳气体的化学反应方程式为________。
(2)这包白色粉末的成分为________。
(3)求所得溶液中溶质的质量分数。(写出计算过程,结果保留一位小数)
32.(2020·绍兴)将12.9克NaCl和Na2CO3固体混合物完全溶于水中形成溶液,再将75克CaCl2溶液分5次加入到该溶液中,充分反应,测得的实验数据如下表。
实验序号
1
2
3
4
5
加入CaCl2溶液质量/克
15
15
15
15
15
生成沉淀的总质量/克
3
m
9
10
10
求:
(1)表格中m的数值是________。
(2)溶液中Na2CO3完全反应是在第________次实验。
(3)固体混合物Na2CO3的质量分数。(精确到0.1%)
(4)请画出上述过程中溶液中NaCl质量的变化图。
33.(2020·嘉兴)复方碳酸氢钠片是一种常用的抗酸剂药物,口服后能迅速中和胃酸,用于缓解胃酸过多引起的胃痛等症状。复方碳酸氢钠片的主要成分是碳酸氢钠(其他成分可溶于水但不参与反应),碳酸氢钠与盐酸反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑。
某科学兴趣小组为了测定药片中碳酸氢钠的含量做了以下实验:先将复方碳酸氢钠片制成粉末,取10克分多次放入盛有100克稀盐酸的烧杯中充分反应。测出加入的粉末质量和反应后的溶液质量,两者质量关系如图所示。
(1)实验后,兴趣小组又往烧杯中加入少量粉末,观察到________,说明上述实验结束时稀盐酸过量。
(2)计算复方碳酸氢钠片中碳酸氢钠的含量。
(3)计算10克粉末与稀盐酸反应后所得氯化钠溶液的溶质质量分数。(计算结果精确到0.1%)
34.(2019·绍兴)为了探究氢氧化钡溶液和硫酸钠溶液反应后所得滤液X的成分,同学们做了以下实验;取50克滤液于烧杯中,天向烧杯中滴加溶质质量分数为6%的硫酸镁溶液20克,接着烧杯中滴加稀硫酸。加入溶液的质量与烧杯内沉淀的质量关系如图所示。
(1)滤液X的pH________7(选填“大于”、“等于”或“小于”)
(2)CD段发生反应的化学方程式为________。
(3)滤液X中含有的溶质是________。
(4)滴加入30克稀硫酸时,烧杯中沉淀的质量m2的值为多少?(写出计算过程)
35.(2019·衢州)某KCl固体样品中含有少量CaCl2杂质,实验室提纯氯化钾的流程如下。(氯化钾溶解度受温度影响较小)
(1)沉淀a是________。
(2)操作Ⅰ是________?。
①冷却热饱和溶液②蒸发结晶
(3)若KCl固体样品中还含有少量杂质K2SO4
,
小科认为提纯该样品只要在上述方案基础上增加一步实验:在“加入过量K2CO3溶液”与“过滤”操作之间,加过量的硝酸钡溶液。小江认为这种方案不合理,会导致所得KCl固体中含有新的杂质,新杂质是________?。
36.(2018·杭州)用“盐酸—硫化钡法”生产BaCl2会放出有毒气体H2S(其水溶液有酸性)可用
NaOH吸收H2S制取Na2S进行处理。下表为H2S回收工艺的各项生产成本:
项目
单价(元/吨)
NaOH
2500
Na2S
5000
辅助费用(以处理1吨H2S计)
1114
(1)工业处理尾气需考虑经济效益和社会效益,根据上述资料分析,单从经济效益考虑这种处理H2S的方法是________(选填“盈利”或“亏损”)的。
(2)若某化工厂每天要处理10吨H2S,需消耗NaOH多少吨?(写出计算过程,结果保留1位小数)
37.(2018·绍兴)实验室有甲乙两瓶久置的氢氧化钠固体,某学习小组为了研究其变质情况,进行了如下实验:(电子秤示数单位为克)
(1)滴入紫色石蕊试液后溶液为红色,说明反应后溶液呈________性。
(2)上述实验中产生的二氧化碳气体质量为________克.
(3)计算甲瓶固体样品中碳酸钠的质量分数。
(4)某同学另取10克乙瓶中的固体样品,用100克15%的稀硫酸按同样方法进行实验,他认为不管固体样品变质程度如何,稀硫酸加人入后,都不需要使用石蕊试液,请计算说明他做出此判断的原因.
38.(2018·金华)某拓展性学习小组在学校科学实验创新比赛中,做了一个有趣的实验,装置如图。
实验设计:三颈烧瓶中充满二氧化碳气体,A颈、B颈分别连接充满氢氧化钠溶液和盐酸的注射器,C有两端开口的玻璃导管(伸入瓶内的一端连有小气球),装置气密性良好。
实验操作:先通过A颈往瓶内注人氢氧化钠溶液,观察到小气球的形状发生了变化;过一段时间后再通过B颈往瓶中注入盐酸,发现小气球的形状又发生了改变。
请描述小气球形状的变化情况,井对此作出合理的解释。
四、实验探究题
39.(2020·台州)某同学要在一块空地上种植作物,于是对这块空地的土壤酸碱度进行测定。
(1)在空地上确定5~6个位置进行取样测定壤酸碱度。以下三种取样位置设定合理的是________。
(2)将采集到的土样进行处理后,用玻璃棒蘸取土壤浸出液,滴在________上,将其呈现的颜色与标准比色卡比色.确定了空地土壤的pH约为7.查阅资料,常见作物最适宜生长的土壤pH范围如下表,则这块空地上适合种植的作物有________。
作物
大蒜
丝瓜
茄子
沙枣
最适pH范围
5.6~6.0
6.0~6.5
6.8~7.3
8.0~8.7
40.(2020·湖州)小明在实验室做镁条和稀盐酸反应的实验时,发现试管中产生大量气体、试管壁发烫。放置较长时间后,管底部有沉淀生成。针对这一现象,小明进行了探究:
(1)小明最初认为试管底部的沉淀可能是镁与稀盐酸反应生成大量的MgCl2不能完全溶于水所致。但随后小明通过实验证实了沉淀不是MgCl2。你认为小明的实验操作是
________。
(2)小明查阅资料知道镁与水在加热的条件下能生成氢氧化镁(难溶性物质)和氢气。于是,他进行了实验验证:将去除氧化膜的镁条和水放在试管中加热,发现镁条表面有少量气泡生成。停止加热后,却始终没有观察到沉淀。请对“没有观察到沉淀”这一结果作出合理的解释。________。
(3)镁与水反应没有观察到沉淀,而镁与稀盐酸混合却有沉淀。小明经过思考,认为沉淀的产生与氯离子有关。后来查阅资料得知,沉淀的主要成分是一种可溶于稀硝酸,并生成氯化镁、硝酸镁和水的碱式氯化镁[Mg(OH)Cl]。请你设计实验验证沉淀中含有氯元素。________。
41.(2020·宁波)在“探究稀盐酸和稀硫酸的化学性质”实验中,小科发现镁带与稀盐酸反应后的试管内出现了灰白沉淀。
【提出问题】灰白色沉淀是什么物质?
【提出猜想】小科在老师指导下,猜想灰白色沉淀是下列物质中的一种或几种:
①镁;②氯化镁;③氢氧化镁;④碱式氯化镁[Mg(OH)Cl]。
老师肯定了小科的猜想,并鼓励他继续进行实验探究。
【实验探究】步骤一:将上述镁带与稀盐酸反应后试管内的物质过滤,得到滤液和灰白色滤渣。
步骤二:取滤液于试管中,加入适量的氯化镁粉末,粉末全部溶解。
步骤三:取少量灰白色滤渣于试管中,加入适量稀盐酸,沉淀全部溶解,无其他现象。
步骤四:将剩余滤渣用蒸馏水充分洗涤。取洗涤后的滤渣于试管中,加入过量稀硝酸,滤渣全部溶解,再加入硝酸银溶液,有白色沉淀产生。
【实验反思及结论】
(1)从步骤二可知,灰白色沉淀不可能是氯化镁,因为滤液是氯化镁的________(填“饱和”或“不饱和”)溶液。
(2)从步骤三可知,该沉淀中没有________。
(3)步骤四中将滤渣用蒸馏水充分洗涤是为了________。
(4)根据实验探究可知,该反应产生的灰白色沉淀中一定含有________。
42.(2020·绍兴)做酸碱实验时,小敏将稀盐酸逐滴加到氢氧化钡溶液中(如图),发现一直无明显现象,突然想起忘记加无色酚酞试液,为探究反应的进程,过程如下:(已知BaCl2溶液呈中性)
(1)【建立猜想】①氢氧化钡过量②盐酸过量③________
(2)【实验设计】步骤一:取少量反应后的溶液于试管中,滴入几滴无色酚酞试液,溶液不变色,得出猜想①错误。
步骤二:继续探究
实验方案
实验操作
实验现象
实验结论
Ⅰ
重新取样,滴加少量AgNO3溶液
白色沉淀
猜想②正确
Ⅱ
重新取样,滴加足量Na2CO3溶液
???
▲??
猜想②正确
白色沉淀
猜想③正确
①对方案Ⅰ的结论进行评价:________。
②表格空白处的实验现象是:________。
(3)【表达交流】为确定猜想②是否正确,还可以选择的试剂有
_________。
A.紫色石蕊试液
B.铜片
C.铁锈
43.(2020·杭州)一种制备氢氧化镁的生产流程如图所示,MgCl2和NaOH按恰好完全反应的比例加料
(1)写出步骤c中发生反应的化学方程式:________
(2)x=________
(3)过滤得到的粗产品还要经过洗涤,洗涤时主要除去的杂质是________。
(4)上述流程中若用下列物质代替氢氧化钠,也能制得氢氧化镁的是________
①盐酸???????
②氯化钙???????
③氨水???????????
④碗酸镁
44.(2019·杭州)某兴趣小组做了如下实验
①在止水夹K1、K2处于关闭状态时,将针筒A中溶液挤入试管B,A滴有酚酞的中,接着打开止水夹K1,发现D氧化钠溶液中的部分溶液被吸入试管B中充分反应后,试管B留下的溶液也显红色
②打开止水夹K2
,
风哨振动鸣叫,。C中的部分溶液被吸入B和D中,反应后B、D中溶液都变为无色。
回答
(1)步骤①中,充分反应后,试管B里的CO2最终转化为________(填化学式)和水
(2)解释步骤②中“风哨振动鸣叫”的原因________。
(3)实验开始时C、D中两种溶液中溶质质量分数大小关系为:a%________b%(选填“>”
“=”
“<”)
45.(2019·金华)某兴趣小组在实验室相对封闭的装置内燃烧某种含碳、氢、氧元素的垃圾,对产生的废气成分(不考虑气态有机物)按如图所示的装置进行检验。
【实验研究】
拉动注射器,让废气依次通过装置。
【实验分析】
(1)能证明废气中有水蒸气存在的现象是________;
(2)F处的大号注射器,可以引导气体流向,其另一个主要作用是________;
(3)【反思评价】小金认为,仅根据E中澄清石灰水变浑浊,无法确定一氧化碳的存在,其理由是________;
(4)小金根据D中的粉末由黑色变为红色,得出废气中存在一氧化碳。小丽认为该结论不够严密,若废气中存在氢气也会出现该现象。要使上述结论更加严密,还应添加的一个实验装置及位置是________。
【实验结果】经检验,废气中存在CO2、CO、H2O。
46.(2018·衢州)为探究一瓶久置的氢氧化钠固体样品是否全部变质,小柯取少量样品配制成溶液,再取少量溶液分别装入两支试管中,进行了如甲、乙两图所示实验。(注:BaCl2溶液呈中性)
(1)小柯认为“甲图实验说明了氢氧化钠固体部分变质”。你认为小柯的观点是否正确,并说明理由。
(2)分析乙图实验的现象,可以确定样品的变质情况为________。
(3)进一步探究:另取少量样品溶液,加入一定质量分数的稀盐酸,直至过量。请在丙图中画出“生成CO2的质量随加入稀盐酸质量变化”的大致图像。
答案解析部分
一、单选题
1.
B
2.
D
3.
D
4.
D
5.
C
6.
D
7.
B
8.
B
9.
D
10.
B
11.
B
12.
A
13.B
14.C
15.A
16.C
17.B
18.B
二、填空题
19.
(1)食盐(NaCl)
(2)纯碱(Na2CO3);CaCl2
(Ba2+、Ca2+的可溶性盐或碱均可)
20.
氯化钠;稀盐酸
21.
(1)H+(或“氢离子”);红
(2)>(或“大于”)
22.
(1)浓硫酸(或浓H2SO4)
(2)CO;红
23.
(1)BaCO3+2HCl=BaCl2+H2O+CO2↑
(2)CacO3
(3)BaCl2、Na2CO3
24.
(1)NaOH
(2)Fe+2HCl=FeCl2+H2↑
(3)复分解反应
25.
(1)Na2CO3和Na2SO4
(2)BaC2、NaOH;BaCl2、NaOH、NaNO3
26.
(1)2H2O2=
=2H2O+O2↑
(2)酸或碱或盐
27.
稀硫酸
;防止固体废弃物中可溶性钡盐对环境的污染
28.
(1)NH3
(2)硫酸钾、硝酸铵
29.
(1)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(2)Na2CO3
,
CuO,NaOH
30.
(1)Ba(NO3)2
(2)A,B,D
三、解答题
31.
(1)2HCl+Na2CO3=2NaCl+CO2↑+H2O
(2)氢氧化钠和碳酸钠
(3)解:设固体粉末中含碳酸钠x克,与碳酸钠反应消耗HCl
y克,
同时生成NaCl
z克:
2HCl+
Na2CO3=
2NaCl+
CO2↑+H2O
36.5×2
106
58.5×2
44
y
x
z
100+9.3-107.1
解得:x=5.3(克)
y=3.65(克)
z=5.85(克)
设固体粉末中含氢氧化钠a克,与盐酸反应后生成NaCl
b克
HCl+
NaOH=
NaCl+H2O
36.5
40
58.5
100×7.3%-3.65
a
b
解得:a=4(克)
b=5.85(克)
因为固体总质量为9.3克,等于碳酸钠与氢氧化钠的质量和,所以固体中无氯化钠。所以,所得溶液中溶质的质量分数=
×100%=10.9%
32.
(1)6
(2)4
(3)解:设固体混合物中Na2CO3质量为x
Na2CO3+CaCl2=2NaCl+
CaCO3↓
106
100
x
10克
求得x=10.6克
Na2CO3%=(10.6克/12.9克)×100%=82.2%
(4)
33.
(1)有气泡产生
(2)解:
m
CO2=100g+10g-105.6g=4.4g
设复方碳酸氢钠片中碳酸氢钠的质量为
x。
NaHCO3+HCl=NaCl+H2O+
CO2↑
84
44
x
4.4g
=
x
=8.4g????
NaHCO3%=
×100%=84%
答:
碳酸氢钠的含量为
84%。
(3)解:设反应生成的氯化钠质量为
y
NaHCO3+HCl=
NaCl+H2O+
CO2↑
58.5
44
y
4.4g
=
y=5.85g
NaCl%=
×100%=5.5%
答:
氯化钠溶液的质量分数为
5.5%。
34.
(1)大于
(2)Mg(OH)2+H2SO4=MgSO4+2H20
(3)Ba(OH)2和NaOH
(4)解:设加入20克硫酸镁溶液时,生成Mg(OH)2沉淀的质量为x。
Ba(OH)2+
MgSO4=BaSO4↓+
Mg(OH)2↓
120
58
20克×6%
x
120:58=1.2克:x??
解得x=0.58克
M2=4.66克+0.58克=5.24克
35.
(1)碳酸钙(CaCO3)
(2)②
(3)硝酸钾和硝酸钡
36.
(1)盈利
(2)解:设需消耗NaOH的质量为x。
2NaOH+
H2S=Na2S
+
2H2O
80
34
x
10t
解得:x≈23.5t
答:需消耗
NaOH
的质量为
23.5
吨。
37.
(1)酸
(2)2.2
(3)设该样品中碳酸钠的质量为x,则
Na2CO3+2HCl=2NaCl+H2O+
CO2↑
106
44
x
2.2克
106:x=44:2.2克,x=5.3克
Na2CO3%=5.3克/10克=53%
(4)假设10克固体样品全部为氢氧化钠,则需要消耗的稀硫酸质量为y
2NaOH+
H2SO4=Na2SO4+2H2O
80
98
10克
y×15%
80:10克=98:(y×15%)
y=81.7克<100克
假设10克固体样品全部变质,则需要消耗的稀硫酸质量为Z
Na2CO3+
H2SO4===Na2SO4+H2O+CO2↑
106
98
10克
z×15
106:10克=98:(z×15%)????
z=61.6克<100克
所以用100克15%的稀硫酸进行此实验,稀硫酸一定过量,故稀硫酸加入后不需要加石蕊试液。
38.
实验现象:小气球“先膨胀,后变瘪”(或“先变大,后变小)
从NaOH吸收CO2
,
HCl与Na2CO3反应生成CO2及导致瓶内气压变化三方面进行:
①2NaOH+CO2=Na2CO3+H2O;
②NaOH溶液吸收CO2
,
使瓶内气压减小,导致气球膨胀;
③Na2CO3+2HCl=2NaCl+H2O+CO2↑;
④HCl与Na2CO3反应生成CO2
,
使瓶内气压增大,导致气球变瘪
四、实验探究题
39.
(1)B
(2)pH试纸;茄子
40.
(1)取少量沉淀于试管中,加入水。
(2)镁和水反应,生成的氢氧化镁覆盖在镁条表面阻止了反应的进行。
(3)取沉淀洗涤干净后,加稀硝酸溶解,再加硝酸银,若有白色沉淀则证明沉淀中含有氯元素。
41.
(1)不饱和
(2)Mg
(3)洗去滤渣表面的氯化镁,防止氯化镁干扰后续实验
(4)Mg(OH)Cl
42.
(1)两者恰好完全反应
(2)该实验结论错误,因为盐酸和氢氧化钡反应会生成氯化钡,无论盐酸是否过量,都会有白色沉淀生成;先出现气泡,后出现白色沉淀
(3)A,C
43.
(1)MgCl2+2NaOH=Mg(OH)2↓+2NaCl
(2)280
(3)氯化钠(或NaCl)
(4)③
44.
(1)Na2CO3
(2)B中CO2气体跟氢氧化钠溶液反应使装置内气压下降,小于外部气压,气流从风哨进入
(3)>
45.
(1)A中的固体由白色变蓝色
(2)收集尾气(或储气)
(3)CO2不一定来自CO和CuO的反应,可能是原来的CO2在B装置没有除尽
(4)在DE之间连接盛有无水硫酸铜的U型管(或在DE之间连接A装置)
46.
(1)不正确,无论氢氧化纳是否全部变质,都能让无色酚酞变红色
(2)部分变质
(3)
同课章节目录
