化学反应速率
图片预览






文档简介
(共17张PPT)
化学反应速率
宁波四中 王洪见
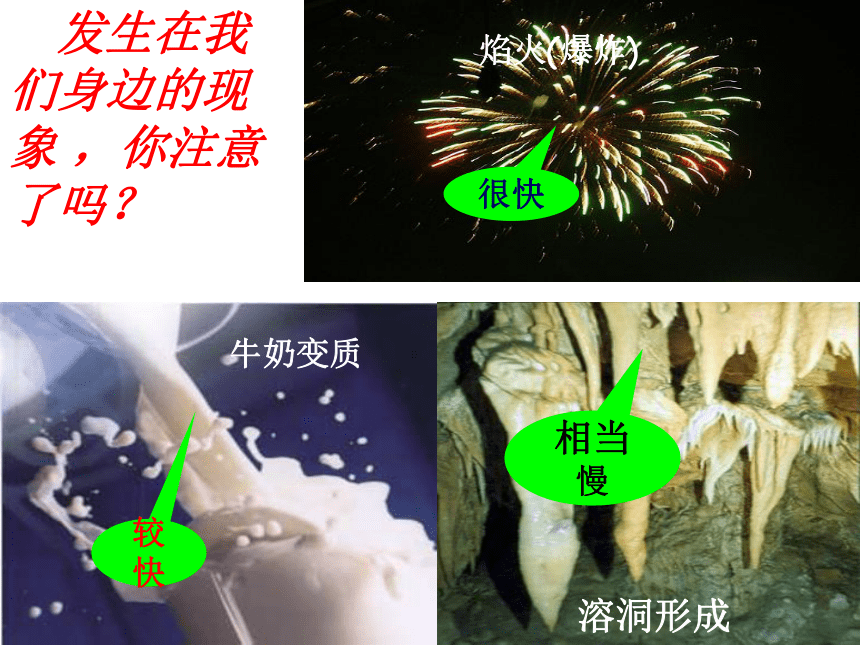
溶洞形成
牛奶变质
焰火(爆炸)
发生在我们身边的现象 ,你注意了吗?
很快
相当慢
较快
实验一:
1、取两只大小相同的试管,分别加入约1克的镁粉和铁粉(注意:先把试管横放,用纸槽将药品送入试管,再把试管慢慢的竖起来)
2、分别加入1ml(约20滴)的稀盐酸(注意:同时加入),对比观察现象。
实验与探究一:
镁粉
铁粉
盐酸
盐酸
观察与思考1:
① . 你是通过什么现象来判断该反应进行的快慢?
② .在化学实验过程中,我们还可以借助
哪些现象来比较反应的快慢?
判断化学反应进行快慢的方法:
1、产生气泡快慢;
2、固体质量变化快慢;
3、温度变化快慢;
4、颜色变化快慢
5、产生沉淀快慢; ……
只能粗略的估计化学反应进行的快慢
(定性角度)
思考2:如何准 确度量化学反应的快慢?
需要统一的定量标准
例1:在一定条件下, 一份双氧水样品经过2h, H2O2的浓度从 5×10-2 mol·L-1 下降到 3×10-2 mol·L-1 .那么,该双氧水在这 2h中分解的平均速率约是 ___________ mol·(L·min)-1
解:起始浓度( mol ·L-1 ):
2h后浓度( mol ·L-1 ):
变化浓度( mol ·L-1 ):
5×10-2 mol ·L-1 - 3×10-2 mol ·L-1
V (H2O2)= ————————————
2×60 min
= 1.67×10-4 mol·(L·min)-1
思考3:1.67×10-4 mol·(L·min)-1这个结果是怎样算出来的?
课本P30中间第二段:
5×10-2
3×10-2
2×10-2
等量的镁粉和铁粉分别与等量同浓度的盐酸反应,为什么反应速率不同?
思考4:结合生活实际和所学知识,大家大胆猜想一下,对于一个确定的反应会有哪些因素影响化学反应速率?你能举例说明吗?
小问题
实验与探究二:影响双氧水分解速率的因素
试剂:
1 、根据以上提供的化学试剂,请分析在H2O2分解过程中,可能有哪些因素会影响到气体生成的快慢?
4%H2O2
12%H2O2
MnO2粉末
热水
冷水
2、在设计H2O2分解对比实验的过程中,要控制好只有一个变量。
3、在实验报告中简要书写所选择的试剂和操作步骤,并大胆猜想可能观察到的实验现象。
4、以小组为单位进行汇报。(汇报内容:①所选择的试剂②操作步骤
③你的猜想现象 )
实验前的准备---讨论与设计
动动脑、动动手
你来动动手:
实验目的:影响双氧水分解速率的因素
温度
催化剂
浓度
3、将两支试管分别同时放到两只烧杯中,对比观察现象。
2、取2支大小相同的试管,各滴入1ml(约20滴)12%的H2O2溶液。
1、取两只100ml的烧杯,在一只中倒入半杯热水,在另一只中倒入半杯冷水。
探究温度对化学反应速率的影响
温馨提示:
1 、请大家严格控制药品的用量。
2、请大家相互协作做对比实验,可同时操作同时观察实验中气泡产生速率的差别。
3、希望大家:仔细观察,发现别人不能发现 的;开动脑筋,想到别人想不到的。
操作步骤:
你来动动手:
1、取两支试管,各加1ml(约20滴)12%H2O2溶液。
2、用纸槽向其中的一支试管中加入少量的MnO2粉末。对比观察现象。
探究催化剂对化学反应速率的影响
温馨提示:
1 、请严格控制药品的用量。
2 、加MnO2粉末时,先将试管倾斜约30度。用纸槽将药品送入试管,再把试管慢慢的竖起来
操作步骤:
你来动动手:
1、取两支试管,分别加入1ml(约20滴) 4%的H2O2, 1ml(约20滴) 12%的H2O2溶液。
2、两人分别同时用纸槽向两支试管中加入少量的MnO2粉末。对比观察现象。
探究浓度对化学反应速率的影响
温馨提示:
1 、请严格控制药品的用量。
2 、黑色胶头滴管加12%的H2O2,红色胶头滴管加4%的H2O2。
3 、加MnO2粉末时,先将试管倾斜约30度。用纸槽将药品送入试管,再把试管慢慢的竖起来
操作步骤:
你来动动手:
我们来总结:影响化学反应速率的因素
歌诀:
要想反应加快速,升温加压增浓度;
催化增大接触面,反应快似骑赤兔。
内因:反应物的性质,越活泼越快。
外因:1、浓度:越大越快;
2、温度:越高越快;
3、催化剂:正催化剂能显著增大反应
的速率。负催化剂能减缓反应速率。
4、压强:对气体来说,越大越快;
5、其它:如反应物接触面的大小、固体颗粒的大小等也会影响反应速率
工业上用氮气和氢气合成氨要使用催化剂
一小块白磷(着火点低)露置于空气中,一段时间后会发现突然燃烧
燃烧含硫矿石(如黄铁矿)制备SO2气体时,要把矿石粉碎成颗粒状,在沸腾炉内鼓入强大空气流,把矿粒吹得剧烈翻腾。
氢气能在氧气中安静地燃
烧,点燃氢气 和氧气的混
合气体,为什么会发生爆炸
如何影响
影响速率的因素
实例
反应物的
接触面积
增大了反应物的表面积,进而增大了与空气的接触面积
催化剂
反应物的接触面积↑ v ↑
反应物的接触面积↑ v ↑
加入催化剂
v↑
温度
T↑,v↑
1.应用化学反应速率的有关知识解释下列问题
你来动动脑
2、为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制如图曲线。请分析讨论以下问题。
(1)在0~t1、t1~t2、t2~t3各相同的时间段里,收集到气体最多的是_________时间段,反应速率最大(即单位时间内气体体积变化最大)的是__________时间段 。
(2)试根据影响化学反应速率的因素分析三个时间段里,反应速率不同的可能原因(该反应是放热反应)。
(3)在t4后,为什么收集到的气体的体积不再增加?(试从反应物的量及影响反应速率的因素分析)
在这节课的学习过程中,你遇到了什么问题?解决了什么问题?还存在什么问题?你认为老师还应该做哪些改进?
了解家里存放各种食物的方法,比较其优点和不足,分析可能存在的问题,与家长讨论可行的改进措施并付诸实施。
化学反应速率
宁波四中 王洪见
溶洞形成
牛奶变质
焰火(爆炸)
发生在我们身边的现象 ,你注意了吗?
很快
相当慢
较快
实验一:
1、取两只大小相同的试管,分别加入约1克的镁粉和铁粉(注意:先把试管横放,用纸槽将药品送入试管,再把试管慢慢的竖起来)
2、分别加入1ml(约20滴)的稀盐酸(注意:同时加入),对比观察现象。
实验与探究一:
镁粉
铁粉
盐酸
盐酸
观察与思考1:
① . 你是通过什么现象来判断该反应进行的快慢?
② .在化学实验过程中,我们还可以借助
哪些现象来比较反应的快慢?
判断化学反应进行快慢的方法:
1、产生气泡快慢;
2、固体质量变化快慢;
3、温度变化快慢;
4、颜色变化快慢
5、产生沉淀快慢; ……
只能粗略的估计化学反应进行的快慢
(定性角度)
思考2:如何准 确度量化学反应的快慢?
需要统一的定量标准
例1:在一定条件下, 一份双氧水样品经过2h, H2O2的浓度从 5×10-2 mol·L-1 下降到 3×10-2 mol·L-1 .那么,该双氧水在这 2h中分解的平均速率约是 ___________ mol·(L·min)-1
解:起始浓度( mol ·L-1 ):
2h后浓度( mol ·L-1 ):
变化浓度( mol ·L-1 ):
5×10-2 mol ·L-1 - 3×10-2 mol ·L-1
V (H2O2)= ————————————
2×60 min
= 1.67×10-4 mol·(L·min)-1
思考3:1.67×10-4 mol·(L·min)-1这个结果是怎样算出来的?
课本P30中间第二段:
5×10-2
3×10-2
2×10-2
等量的镁粉和铁粉分别与等量同浓度的盐酸反应,为什么反应速率不同?
思考4:结合生活实际和所学知识,大家大胆猜想一下,对于一个确定的反应会有哪些因素影响化学反应速率?你能举例说明吗?
小问题
实验与探究二:影响双氧水分解速率的因素
试剂:
1 、根据以上提供的化学试剂,请分析在H2O2分解过程中,可能有哪些因素会影响到气体生成的快慢?
4%H2O2
12%H2O2
MnO2粉末
热水
冷水
2、在设计H2O2分解对比实验的过程中,要控制好只有一个变量。
3、在实验报告中简要书写所选择的试剂和操作步骤,并大胆猜想可能观察到的实验现象。
4、以小组为单位进行汇报。(汇报内容:①所选择的试剂②操作步骤
③你的猜想现象 )
实验前的准备---讨论与设计
动动脑、动动手
你来动动手:
实验目的:影响双氧水分解速率的因素
温度
催化剂
浓度
3、将两支试管分别同时放到两只烧杯中,对比观察现象。
2、取2支大小相同的试管,各滴入1ml(约20滴)12%的H2O2溶液。
1、取两只100ml的烧杯,在一只中倒入半杯热水,在另一只中倒入半杯冷水。
探究温度对化学反应速率的影响
温馨提示:
1 、请大家严格控制药品的用量。
2、请大家相互协作做对比实验,可同时操作同时观察实验中气泡产生速率的差别。
3、希望大家:仔细观察,发现别人不能发现 的;开动脑筋,想到别人想不到的。
操作步骤:
你来动动手:
1、取两支试管,各加1ml(约20滴)12%H2O2溶液。
2、用纸槽向其中的一支试管中加入少量的MnO2粉末。对比观察现象。
探究催化剂对化学反应速率的影响
温馨提示:
1 、请严格控制药品的用量。
2 、加MnO2粉末时,先将试管倾斜约30度。用纸槽将药品送入试管,再把试管慢慢的竖起来
操作步骤:
你来动动手:
1、取两支试管,分别加入1ml(约20滴) 4%的H2O2, 1ml(约20滴) 12%的H2O2溶液。
2、两人分别同时用纸槽向两支试管中加入少量的MnO2粉末。对比观察现象。
探究浓度对化学反应速率的影响
温馨提示:
1 、请严格控制药品的用量。
2 、黑色胶头滴管加12%的H2O2,红色胶头滴管加4%的H2O2。
3 、加MnO2粉末时,先将试管倾斜约30度。用纸槽将药品送入试管,再把试管慢慢的竖起来
操作步骤:
你来动动手:
我们来总结:影响化学反应速率的因素
歌诀:
要想反应加快速,升温加压增浓度;
催化增大接触面,反应快似骑赤兔。
内因:反应物的性质,越活泼越快。
外因:1、浓度:越大越快;
2、温度:越高越快;
3、催化剂:正催化剂能显著增大反应
的速率。负催化剂能减缓反应速率。
4、压强:对气体来说,越大越快;
5、其它:如反应物接触面的大小、固体颗粒的大小等也会影响反应速率
工业上用氮气和氢气合成氨要使用催化剂
一小块白磷(着火点低)露置于空气中,一段时间后会发现突然燃烧
燃烧含硫矿石(如黄铁矿)制备SO2气体时,要把矿石粉碎成颗粒状,在沸腾炉内鼓入强大空气流,把矿粒吹得剧烈翻腾。
氢气能在氧气中安静地燃
烧,点燃氢气 和氧气的混
合气体,为什么会发生爆炸
如何影响
影响速率的因素
实例
反应物的
接触面积
增大了反应物的表面积,进而增大了与空气的接触面积
催化剂
反应物的接触面积↑ v ↑
反应物的接触面积↑ v ↑
加入催化剂
v↑
温度
T↑,v↑
1.应用化学反应速率的有关知识解释下列问题
你来动动脑
2、为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制如图曲线。请分析讨论以下问题。
(1)在0~t1、t1~t2、t2~t3各相同的时间段里,收集到气体最多的是_________时间段,反应速率最大(即单位时间内气体体积变化最大)的是__________时间段 。
(2)试根据影响化学反应速率的因素分析三个时间段里,反应速率不同的可能原因(该反应是放热反应)。
(3)在t4后,为什么收集到的气体的体积不再增加?(试从反应物的量及影响反应速率的因素分析)
在这节课的学习过程中,你遇到了什么问题?解决了什么问题?还存在什么问题?你认为老师还应该做哪些改进?
了解家里存放各种食物的方法,比较其优点和不足,分析可能存在的问题,与家长讨论可行的改进措施并付诸实施。
