沉淀溶解平衡
图片预览




文档简介
(共16张PPT)
吉林省吉林市官马溶洞
在祖国的大好河山中广泛分布着美丽的溶洞,如何形成的
呢?这和我们正在学习的化学平衡又有什么关系?
湖南张家界溶洞
研究对象
学习方法
温故知新
讨论推理
归纳小结
实验探究
巩固训练
宁波三中 张健翔
温故知新
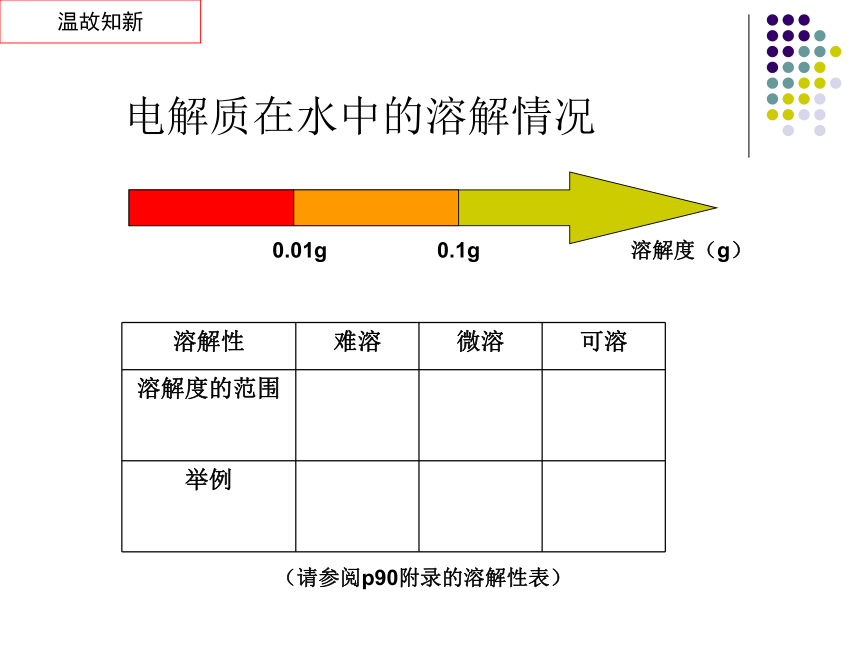
电解质在水中的溶解情况
溶解性 难溶 微溶 可溶
溶解度的范围
举例
0.01g
0.1g
溶解度(g)
(请参阅p90附录的溶解性表)
你所举例的难溶物在水中真的完全不能溶解吗?自然界中有完全不能溶解的电解质吗?
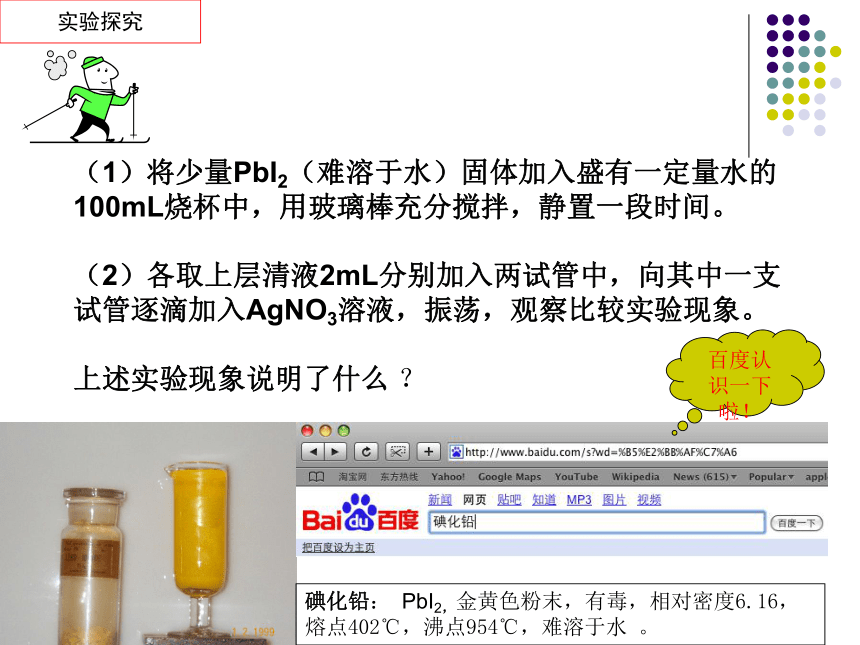
(1)将少量PbI2(难溶于水)固体加入盛有一定量水的 100mL烧杯中,用玻璃棒充分搅拌,静置一段时间。
(2)各取上层清液2mL分别加入两试管中,向其中一支试管逐滴加入AgNO3溶液,振荡,观察比较实验现象。
上述实验现象说明了什么 ?
实验探究
碘化铅: PbI2,金黄色粉末,有毒,相对密度6.16,熔点402℃,沸点954℃,难溶于水 。
百度认识一下啦!
水分子作用下
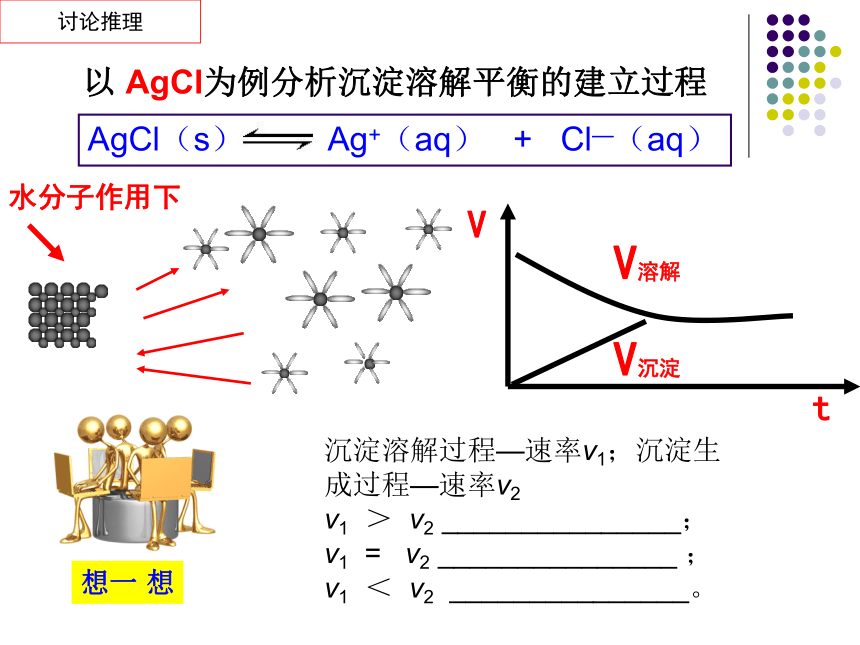
以 AgCl为例分析沉淀溶解平衡的建立过程
讨论推理
V
V溶解
V沉淀
t
沉淀溶解过程—速率v1;沉淀生成过程—速率v2
v1 > v2 _______________;
v1 = v2 _______________ ;
v1 < v2 _______________。
想一 想
AgCl(s) Ag+(aq) + Cl—(aq)
沉淀溶解平衡作为又一种化学平衡,它具备怎样的特征呢?请结合学过的化学平衡5个特征的有关知识加以小结。
想一想
巩固训练
例1:下列对沉淀溶解平衡的描述正确的是 ( )
A、沉淀溶解反应开始时,溶液中各离子浓度一定相等。
B、沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C、沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,
且保持不变。
D、沉淀溶解达到平衡时,如果再加入难溶性的该
沉淀物,溶解度增大。
B
请阅读课文p82,通过书写AgCl和PbI2的平衡常数推理溶度积的一般表达式,完成下表。
AmBn(s) mAn+(aq)+ nBm-(aq)
溶度积
符号 表达式
有何意义 请解读p82表3-14的含义?
温故知新
溶液未饱和,无沉淀析出,若加入过量难溶电解质,沉淀溶解直至饱和。
溶度积规则
Qc> Ksp,
Qc= Ksp,
Qc< Ksp,
溶液过饱和,平衡向生成沉淀方向移动,有沉淀析出。
溶液饱和,沉淀与溶解平衡。
若用Qc表示某电解质溶液某一时刻的离子积,
下面三个关系式分别能得出哪些结论呢?
想一想
例2: 250C下在AgCl固体的饱和溶液中存在
AgCl(s) Ag+(aq)+Cl-(aq),ΔH>0
进行下列操作后有什么变化?
c(Ag+) c(Cl-) 平衡移动方向 离子积
Qc 溶度积 Ksp
升温
加水
加AgNO3
加盐酸
加NH3·H2O
不变
不变
不变
不变
影
响
沉
淀
溶
解
平
衡
的
外
部
因
素
?
温馨提示:Ag++2NH3 =[Ag(NH3)2]+
湖南张家界溶洞
现在你能用我们今天学习的知识加以解释吗?
虽然溶洞都是十分坚硬的碳酸盐质岩石,但由于长期沉浸在地下水中被溶解,特别是当水中含有二氧化碳时,其溶解速度更加迅速。这样一年又一年,坚硬的岩层就会被溶蚀出一个个洞穴。当溶有石灰质的地下水再次滴入洞中时,由于环境中压力、温度的变化,使水中的二氧化碳逸出,从而降低了水对石灰质的溶解力,这样原本溶解在水中的部分石灰质,会因为过于饱和而沉淀析出,长时间的累积就会形成一根根形态各异的石钟乳、石柱和石笋
温馨提示:CaCO3 (s) Ca2+(aq)+CO32-(aq)
CO32-+CO2+H2O=2HCO3-
一、沉淀溶解平衡
1、概念:
2、特征:逆、等、动、定、变
3、平衡常数——溶度积(Ksp)
表达式:
AmBn(s) mAn+(aq)+nBm-(aq)
(1)Ksp的意义
4、影响沉淀溶解平衡的外界因素:浓度、温度
(2)溶度积规则:
拓展研究
含氟牙膏的重要功能就是防治蛀牙,你知道其中原理吗?
请用我们学过的知识加以解释,最好能写一片关于含氟牙膏
的小论文,为下节课的学习作好充分的准备。
吉林省吉林市官马溶洞
在祖国的大好河山中广泛分布着美丽的溶洞,如何形成的
呢?这和我们正在学习的化学平衡又有什么关系?
湖南张家界溶洞
研究对象
学习方法
温故知新
讨论推理
归纳小结
实验探究
巩固训练
宁波三中 张健翔
温故知新
电解质在水中的溶解情况
溶解性 难溶 微溶 可溶
溶解度的范围
举例
0.01g
0.1g
溶解度(g)
(请参阅p90附录的溶解性表)
你所举例的难溶物在水中真的完全不能溶解吗?自然界中有完全不能溶解的电解质吗?
(1)将少量PbI2(难溶于水)固体加入盛有一定量水的 100mL烧杯中,用玻璃棒充分搅拌,静置一段时间。
(2)各取上层清液2mL分别加入两试管中,向其中一支试管逐滴加入AgNO3溶液,振荡,观察比较实验现象。
上述实验现象说明了什么 ?
实验探究
碘化铅: PbI2,金黄色粉末,有毒,相对密度6.16,熔点402℃,沸点954℃,难溶于水 。
百度认识一下啦!
水分子作用下
以 AgCl为例分析沉淀溶解平衡的建立过程
讨论推理
V
V溶解
V沉淀
t
沉淀溶解过程—速率v1;沉淀生成过程—速率v2
v1 > v2 _______________;
v1 = v2 _______________ ;
v1 < v2 _______________。
想一 想
AgCl(s) Ag+(aq) + Cl—(aq)
沉淀溶解平衡作为又一种化学平衡,它具备怎样的特征呢?请结合学过的化学平衡5个特征的有关知识加以小结。
想一想
巩固训练
例1:下列对沉淀溶解平衡的描述正确的是 ( )
A、沉淀溶解反应开始时,溶液中各离子浓度一定相等。
B、沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C、沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,
且保持不变。
D、沉淀溶解达到平衡时,如果再加入难溶性的该
沉淀物,溶解度增大。
B
请阅读课文p82,通过书写AgCl和PbI2的平衡常数推理溶度积的一般表达式,完成下表。
AmBn(s) mAn+(aq)+ nBm-(aq)
溶度积
符号 表达式
有何意义 请解读p82表3-14的含义?
温故知新
溶液未饱和,无沉淀析出,若加入过量难溶电解质,沉淀溶解直至饱和。
溶度积规则
Qc> Ksp,
Qc= Ksp,
Qc< Ksp,
溶液过饱和,平衡向生成沉淀方向移动,有沉淀析出。
溶液饱和,沉淀与溶解平衡。
若用Qc表示某电解质溶液某一时刻的离子积,
下面三个关系式分别能得出哪些结论呢?
想一想
例2: 250C下在AgCl固体的饱和溶液中存在
AgCl(s) Ag+(aq)+Cl-(aq),ΔH>0
进行下列操作后有什么变化?
c(Ag+) c(Cl-) 平衡移动方向 离子积
Qc 溶度积 Ksp
升温
加水
加AgNO3
加盐酸
加NH3·H2O
不变
不变
不变
不变
影
响
沉
淀
溶
解
平
衡
的
外
部
因
素
?
温馨提示:Ag++2NH3 =[Ag(NH3)2]+
湖南张家界溶洞
现在你能用我们今天学习的知识加以解释吗?
虽然溶洞都是十分坚硬的碳酸盐质岩石,但由于长期沉浸在地下水中被溶解,特别是当水中含有二氧化碳时,其溶解速度更加迅速。这样一年又一年,坚硬的岩层就会被溶蚀出一个个洞穴。当溶有石灰质的地下水再次滴入洞中时,由于环境中压力、温度的变化,使水中的二氧化碳逸出,从而降低了水对石灰质的溶解力,这样原本溶解在水中的部分石灰质,会因为过于饱和而沉淀析出,长时间的累积就会形成一根根形态各异的石钟乳、石柱和石笋
温馨提示:CaCO3 (s) Ca2+(aq)+CO32-(aq)
CO32-+CO2+H2O=2HCO3-
一、沉淀溶解平衡
1、概念:
2、特征:逆、等、动、定、变
3、平衡常数——溶度积(Ksp)
表达式:
AmBn(s) mAn+(aq)+nBm-(aq)
(1)Ksp的意义
4、影响沉淀溶解平衡的外界因素:浓度、温度
(2)溶度积规则:
拓展研究
含氟牙膏的重要功能就是防治蛀牙,你知道其中原理吗?
请用我们学过的知识加以解释,最好能写一片关于含氟牙膏
的小论文,为下节课的学习作好充分的准备。
