苏教版高一化学必修1专题2第一单元 氯、溴、碘及其化合物(共20张PPT)
文档属性
| 名称 | 苏教版高一化学必修1专题2第一单元 氯、溴、碘及其化合物(共20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-30 12:44:59 | ||
图片预览





文档简介
(共20张PPT)
氯气的生产原理
◆◆◆.氯气的生产原理◆◆◆
1.氯气能使湿润的淀粉KI试纸变蓝
2.氯气和NaOH反应生成能溶于水的物质
1.电源正极和(
)棒相连,电源的负极和(
)棒相连。
2.湿润的淀粉KI试纸放在何处?
3.U型管两端的氯化钠溶液中滴加了什么物质?
◆◆◆
氯气的生产原理◆◆◆
阅读教材【观察与思考】回答下列问题:
信息
两极均产生气泡
通电后有新的气体物质生成
将铁棒上方收集到的气体靠近火焰,有轻微的爆鸣声
有氢气生成
黄绿色、刺激性气味的气体产生,湿润的淀粉碘化钾试纸变蓝
有氯气生成
铁棒周围的颜色变红
有碱性物质生成
◆◆◆
氯气的生产原理◆◆◆
实验现象
结论
1
2
3
4
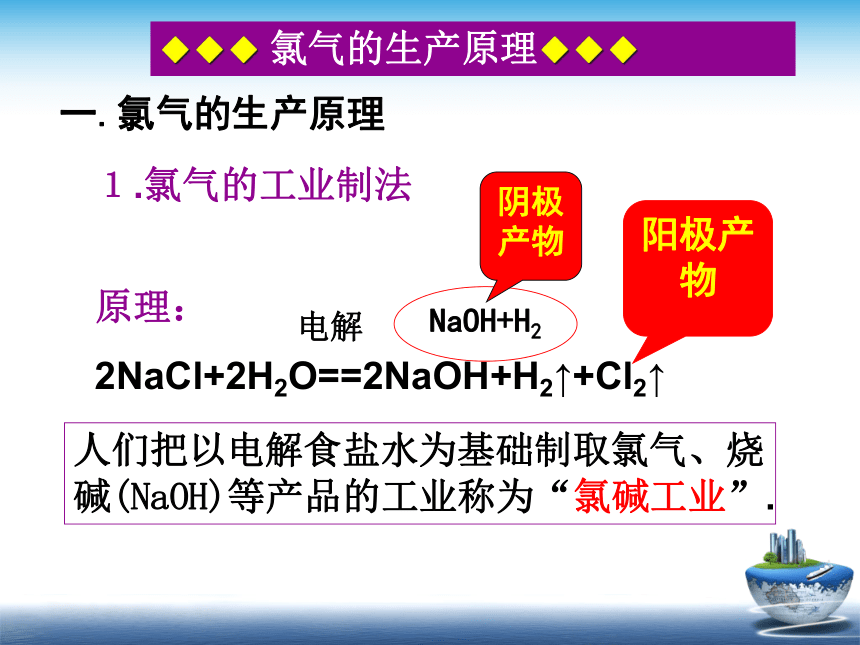
一.氯气的生产原理
1.氯气的工业制法
原理:
2NaCl+2H2O==2NaOH+H2↑+Cl2↑
电解
人们把以电解食盐水为基础制取氯气、烧碱(NaOH)等产品的工业称为“氯碱工业”.
阳极产物
NaOH+H2
阴极产物
◆◆◆
氯气的生产原理◆◆◆
18世纪,人们正致力于采矿事业,瑞典化学家舍勒
也把精力放在了对软锰矿(主要成分是二氧化锰)的研究上。1974年的一天当他把软锰矿粉末和浓盐酸混合加热时,惊奇的看到有一种令人窒息且黄绿气体冒出,但舍勒并未意识到自己发现了新元素,而且把它称为“脱燃素的盐酸”这种气体具有魔术般的本领
。直到1807年,英国化学家戴维对这种气体进行了细致的研究,并于1810年11月在英国皇家学会上正式定名确认上述黄绿色气体,是一种新元素,英文定名为“Chlorine”。
◆◆◆
氯气的生产原理◆◆◆
阅读【化学史话】
瑞典化学家舍勒
公元1742一1786
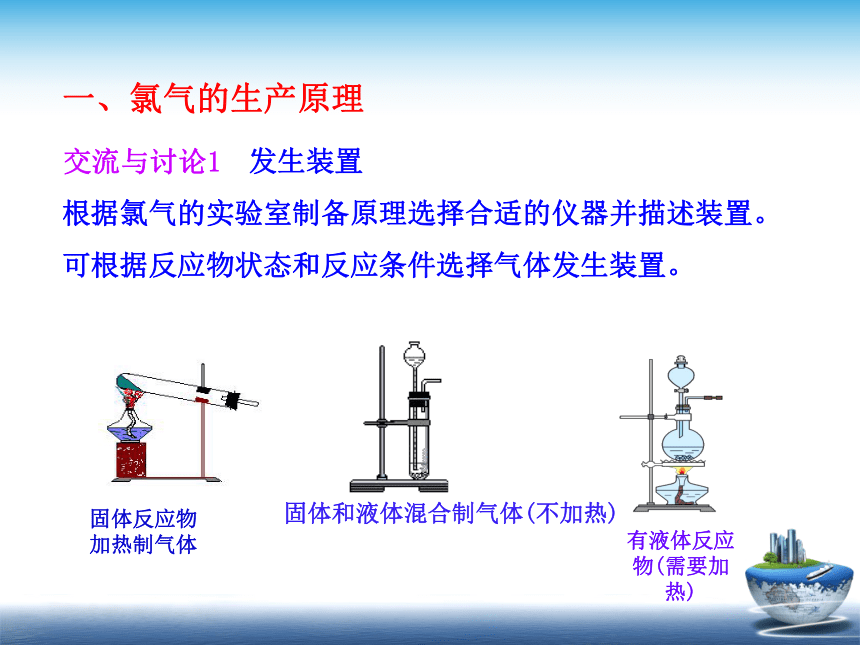
根据氯气的实验室制备原理选择合适的仪器并描述装置。
可根据反应物状态和反应条件选择气体发生装置。
发生装置
交流与讨论1
一、氯气的生产原理
有液体反应物(需要加热)
固体和液体混合制气体(不加热)
固体反应物加热制气体
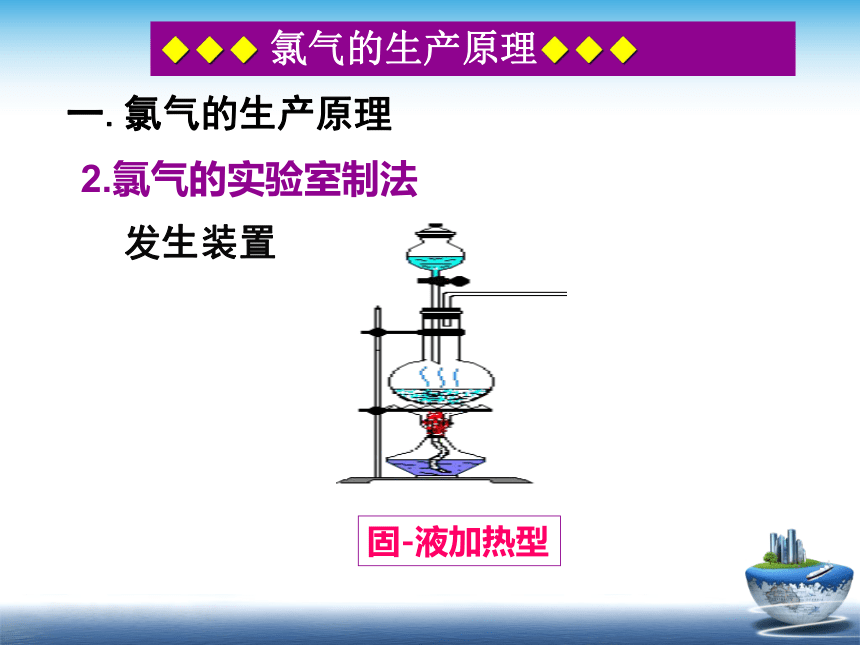
固-液加热型
◆◆◆
氯气的生产原理◆◆◆
一.氯气的生产原理
2.氯气的实验室制法
发生装置
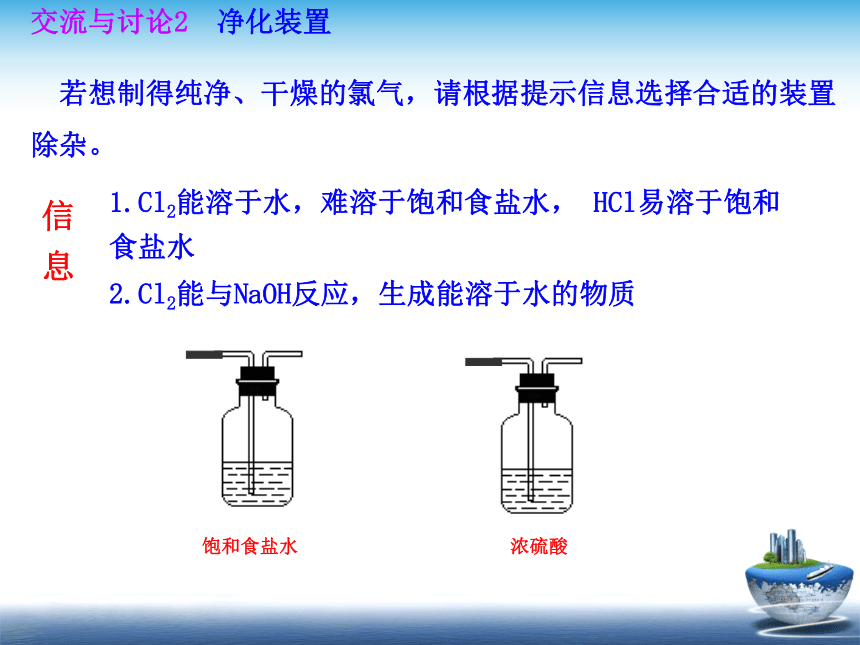
1.Cl2能溶于水,难溶于饱和食盐水,
HCl易溶于饱和食盐水
2.Cl2能与NaOH反应,生成能溶于水的物质
若想制得纯净、干燥的氯气,请根据提示信息选择合适的装置
除杂。
净化装置
交流与讨论2
信
息
饱和食盐水
浓硫酸
下面有四种常见的气体收集装置,请根据下列提示的Cl2的性质选择合适的装置(
)
1.Cl2有毒,且密度比空气大
2.Cl2能溶于水,难溶于饱和食盐水
A
B
可根据气体的密度和溶解度选择气体收集装置。
B
C
收集装置
饱和食盐水
C
交流与讨论2
信息
实验室制得的多余氯气可以直接排到空气中去吗?如果不可以,应如何处理?请选择合适的装置(
)
可根据气体的性质选择尾气吸收装置。
尾气处理装置
交流与讨论3
信
息
1.Cl2有毒
2.Cl2能与NaOH溶液反应,生成能溶于水的物质
3.Cl2不能燃烧
答案:D1
D2
2.氯气的实验室制法
②.药品:
一.氯气的生产原理
◆◆◆
氯气的生产原理◆◆◆
MnO2固体、浓HCl
③.反应原理
MnO2跟浓盐酸在共热的条件下才反应生成Cl2,稀盐酸不与MnO2反应。
◆◆◆
氯气的生产原理◆◆◆
对比两套试验装置哪个更好
发生装置
收集装置
尾气吸收装置
净化装置
除去HCl
除去水蒸气
氯气的实验室制法
原理:
MnO2+4HCl(浓)=MnCl2+Cl2+2H2O
装置:发生装置 净化(干燥)装置 收集装置 尾气吸收装置
小结:氯气的实验室制法
◆◆◆
氯气的生产原理◆◆◆
反馈练习:
1、电解饱和食盐水时,氯气产生于和电源(
)极相连的(
)棒,氢气产生于和电源
(
)极相连的(
)棒,碱产生(
)棒的周围。
正
碳
负
铁
铁
◆◆◆
氯气的生产原理◆◆◆
2、以下工业制备原理属于氧化还原反应的有(
)
A、氯碱工业
B、工业制CO2
(煅烧石灰石)
C、工业制H2(焦炭和水蒸气高温下反应)
D、工业制盐酸
(氯气和氢气燃烧)
ACD
◆◆◆
氯气的生产原理◆◆◆
①长颈漏斗应改成分液漏斗.②烧瓶下应垫石棉网.
③应用酒精灯加热. ④稀盐酸应改为浓盐酸.
⑤多余Cl2应通入NaOH溶液中
3、下图是实验室制备氯气的装置图,请指出其中的错误。
◆◆◆
氯气的生产原理◆◆◆
氯气的生产原理
一、氯气的工业制法
2NaCl
+
2H2O
===
H2↑+
Cl2↑+
2NaOH
验证:阳极
氯气
阴极
氢气
溶液中
碱液生成
二、氯气的实验室制备法:
实验原理:
MnO2
+
4HCl(浓)===
MnCl2
+
Cl2↑
+
2H2O
发生装置
固体+液体气体
净化装置
收集装置
向上排空气法
尾气处理
氢氧化钠溶液
氯气的生产原理
◆◆◆.氯气的生产原理◆◆◆
1.氯气能使湿润的淀粉KI试纸变蓝
2.氯气和NaOH反应生成能溶于水的物质
1.电源正极和(
)棒相连,电源的负极和(
)棒相连。
2.湿润的淀粉KI试纸放在何处?
3.U型管两端的氯化钠溶液中滴加了什么物质?
◆◆◆
氯气的生产原理◆◆◆
阅读教材【观察与思考】回答下列问题:
信息
两极均产生气泡
通电后有新的气体物质生成
将铁棒上方收集到的气体靠近火焰,有轻微的爆鸣声
有氢气生成
黄绿色、刺激性气味的气体产生,湿润的淀粉碘化钾试纸变蓝
有氯气生成
铁棒周围的颜色变红
有碱性物质生成
◆◆◆
氯气的生产原理◆◆◆
实验现象
结论
1
2
3
4
一.氯气的生产原理
1.氯气的工业制法
原理:
2NaCl+2H2O==2NaOH+H2↑+Cl2↑
电解
人们把以电解食盐水为基础制取氯气、烧碱(NaOH)等产品的工业称为“氯碱工业”.
阳极产物
NaOH+H2
阴极产物
◆◆◆
氯气的生产原理◆◆◆
18世纪,人们正致力于采矿事业,瑞典化学家舍勒
也把精力放在了对软锰矿(主要成分是二氧化锰)的研究上。1974年的一天当他把软锰矿粉末和浓盐酸混合加热时,惊奇的看到有一种令人窒息且黄绿气体冒出,但舍勒并未意识到自己发现了新元素,而且把它称为“脱燃素的盐酸”这种气体具有魔术般的本领
。直到1807年,英国化学家戴维对这种气体进行了细致的研究,并于1810年11月在英国皇家学会上正式定名确认上述黄绿色气体,是一种新元素,英文定名为“Chlorine”。
◆◆◆
氯气的生产原理◆◆◆
阅读【化学史话】
瑞典化学家舍勒
公元1742一1786
根据氯气的实验室制备原理选择合适的仪器并描述装置。
可根据反应物状态和反应条件选择气体发生装置。
发生装置
交流与讨论1
一、氯气的生产原理
有液体反应物(需要加热)
固体和液体混合制气体(不加热)
固体反应物加热制气体
固-液加热型
◆◆◆
氯气的生产原理◆◆◆
一.氯气的生产原理
2.氯气的实验室制法
发生装置
1.Cl2能溶于水,难溶于饱和食盐水,
HCl易溶于饱和食盐水
2.Cl2能与NaOH反应,生成能溶于水的物质
若想制得纯净、干燥的氯气,请根据提示信息选择合适的装置
除杂。
净化装置
交流与讨论2
信
息
饱和食盐水
浓硫酸
下面有四种常见的气体收集装置,请根据下列提示的Cl2的性质选择合适的装置(
)
1.Cl2有毒,且密度比空气大
2.Cl2能溶于水,难溶于饱和食盐水
A
B
可根据气体的密度和溶解度选择气体收集装置。
B
C
收集装置
饱和食盐水
C
交流与讨论2
信息
实验室制得的多余氯气可以直接排到空气中去吗?如果不可以,应如何处理?请选择合适的装置(
)
可根据气体的性质选择尾气吸收装置。
尾气处理装置
交流与讨论3
信
息
1.Cl2有毒
2.Cl2能与NaOH溶液反应,生成能溶于水的物质
3.Cl2不能燃烧
答案:D1
D2
2.氯气的实验室制法
②.药品:
一.氯气的生产原理
◆◆◆
氯气的生产原理◆◆◆
MnO2固体、浓HCl
③.反应原理
MnO2跟浓盐酸在共热的条件下才反应生成Cl2,稀盐酸不与MnO2反应。
◆◆◆
氯气的生产原理◆◆◆
对比两套试验装置哪个更好
发生装置
收集装置
尾气吸收装置
净化装置
除去HCl
除去水蒸气
氯气的实验室制法
原理:
MnO2+4HCl(浓)=MnCl2+Cl2+2H2O
装置:发生装置 净化(干燥)装置 收集装置 尾气吸收装置
小结:氯气的实验室制法
◆◆◆
氯气的生产原理◆◆◆
反馈练习:
1、电解饱和食盐水时,氯气产生于和电源(
)极相连的(
)棒,氢气产生于和电源
(
)极相连的(
)棒,碱产生(
)棒的周围。
正
碳
负
铁
铁
◆◆◆
氯气的生产原理◆◆◆
2、以下工业制备原理属于氧化还原反应的有(
)
A、氯碱工业
B、工业制CO2
(煅烧石灰石)
C、工业制H2(焦炭和水蒸气高温下反应)
D、工业制盐酸
(氯气和氢气燃烧)
ACD
◆◆◆
氯气的生产原理◆◆◆
①长颈漏斗应改成分液漏斗.②烧瓶下应垫石棉网.
③应用酒精灯加热. ④稀盐酸应改为浓盐酸.
⑤多余Cl2应通入NaOH溶液中
3、下图是实验室制备氯气的装置图,请指出其中的错误。
◆◆◆
氯气的生产原理◆◆◆
氯气的生产原理
一、氯气的工业制法
2NaCl
+
2H2O
===
H2↑+
Cl2↑+
2NaOH
验证:阳极
氯气
阴极
氢气
溶液中
碱液生成
二、氯气的实验室制备法:
实验原理:
MnO2
+
4HCl(浓)===
MnCl2
+
Cl2↑
+
2H2O
发生装置
固体+液体气体
净化装置
收集装置
向上排空气法
尾气处理
氢氧化钠溶液
