2020浙教版科学暑期培优第4讲:溶液的配制及物质的分离
文档属性
| 名称 | 2020浙教版科学暑期培优第4讲:溶液的配制及物质的分离 |  | |
| 格式 | doc | ||
| 文件大小 | 414.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-07-31 21:28:29 | ||
图片预览



文档简介
【复习回顾】
一、溶质的质量分数
概念:溶液中溶质的质量分数是指溶质质量与溶液质量的比值。
溶质的质量分数的计算公式:
公式的变换形式:m质=m液×溶质的质量分数;
m液=m质÷溶质的质量分数;
一定温度下,饱和溶液中的溶质的质量分数(P%)与溶解度(S)的关系:
P%= ×100%
二、有关溶液稀释问题的计算:
溶液稀释就是往浓溶液中加入溶剂或加入低浓度的较稀溶液变成稀溶液的过程。
溶液稀释问题的特点是:稀释前后溶液中溶质的质量保持不变,即:
浓溶液的质量×浓溶液中的溶质质量分数=稀溶液的质量×稀溶液中溶质的质量分数
由于液体称量比较麻烦,而用量筒量取体积比较方便,所以计算时有时会涉及到溶液的体积,这时要通过密度来进行换算。(ρ=m/V)
由于分子之间存在一定的间隔,所以两种不同液体混合溶解时,一般来说体积不能简单相加,因为混合后体积小于混合前两种液体体积之和。
三、有关溶液的浓缩问题的计算:
溶液的浓缩问题思考方法可以与稀释问题一样来考虑。溶液增浓的方法一般可以:加入溶质、蒸发溶剂、加入较高浓度的浓溶液。
加入溶质增浓的计算:
增浓后的溶质质量分数= ×100%
两种浓度的同种溶质的溶液混合后,所得的溶液中溶质的质量分数一定大于小浓度,小于大浓度的质量分数的值。
混合后溶质的质量分数= ×100%
四、配制一定溶质的质量分数的溶液:(以配制50克10%的氯化钠溶液为例)
实验步骤如下(主要是前3步):
计算:按配制要求计算所需的溶质和溶剂的量。
所需的氯化钠质量:50g×10%=5g
所需溶剂水的质量:50g-5g=45g,水的体积:V=m/ρ=45g/1g.cm-3=45ml
称量(或量取):用天平称取氯化钠5克,用量筒量取45ml的水。
溶解:将溶质和溶剂混合,搅拌至溶质全部溶解。
转移:将配制好的溶液移到指定容器内,贴上标签。
五、晶体的形成
晶体和非晶体的主要区别:
(1)晶体有固定的熔化温度(即熔点),而非晶体则没有固定的熔化温度;
(2)晶体有规则的几何外形,而非晶体则没有固定的几何外形。
晶体的形成:
(1)蒸发溶剂的方法:当饱和溶液蒸发溶剂后(温度不变),便会析出晶体。如我们吃的食盐就是通过海水的蒸发得到的。
具体方法:海水 食盐晶体
蒸发溶剂得到晶体这种方法一般用在溶解度受温度影响不大的固体物质,如得到食盐之类等。
(2)冷却热饱和溶液的方法:这种方法一般用来得到溶解度受温度影响较大的固体物质,如得到硫酸铜晶体、硝酸钾晶体等。
六、水的净化
防止水污染:
(1)在工农业生产和生活中会产生大量的污水。
①工业废水中常含有许多有毒物质;②农业废水中常含有农药、化肥等;
③生活污水中常含有微生物或有利于微生物生长的物质。
(2)污水排放流入湖泊和河流中会造成水污染。
(3)污水的作用会导致生活在河流和湖泊中的水生生物难以生存,甚至死亡,同时还会污染地下水源。
(4)被污水污染的水不能直接饮用和使用,必须经过污水的处理,除去说中的有毒有害物质。
污水的处理
(1)沉淀法:加入明矾或活性炭作凝聚剂,静置几分钟,可见泥沙沉到底,水变清。
(2)过滤法:过滤时应注意“一贴、二低、三靠”。过滤时,玻璃棒的作用是引流。
“一贴”指:滤纸紧贴漏斗内壁;
“二低”指:滤纸低于漏斗口、液体低于滤纸上沿;
“三靠”指:漏斗下端紧靠烧杯内壁、玻璃棒末端轻靠在有三层滤纸的一侧、上面烧杯嘴紧靠玻璃棒中下部。
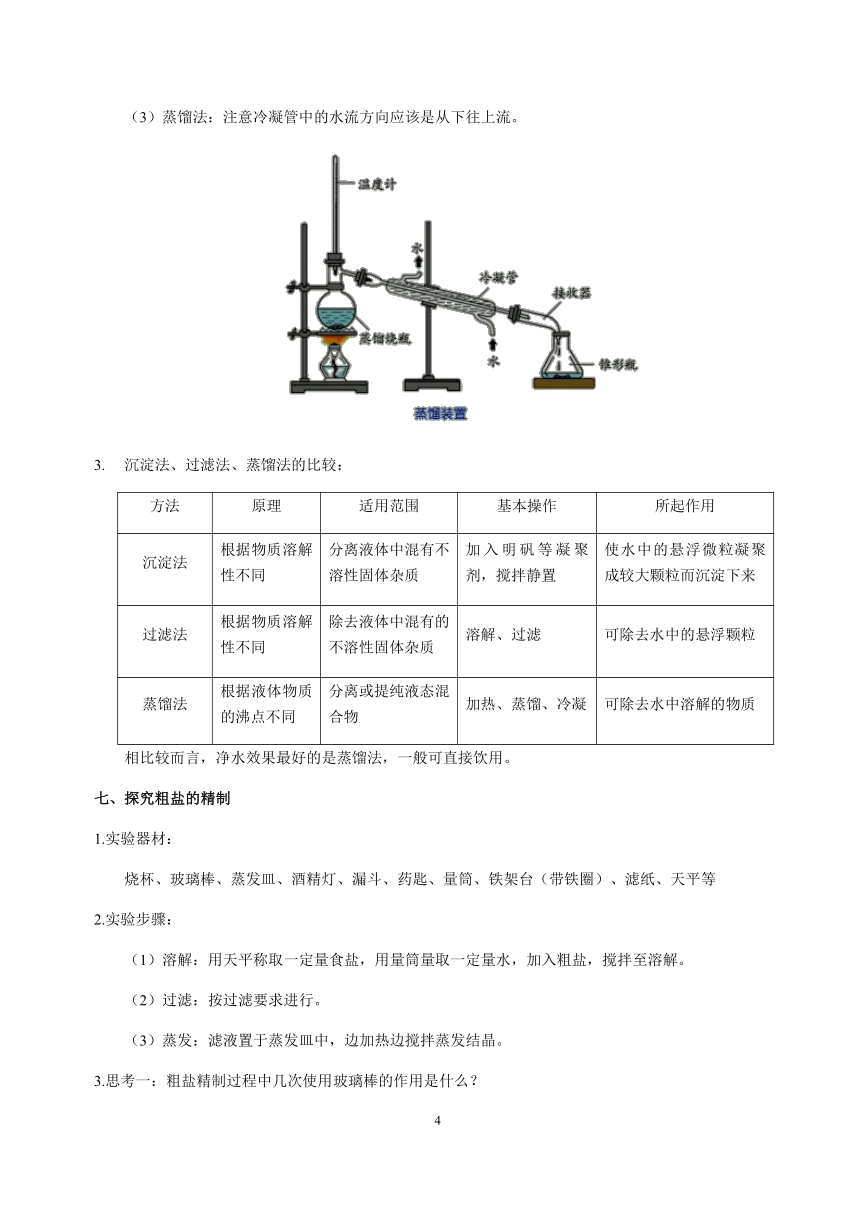
蒸馏法:注意冷凝管中的水流方向应该是从下往上流。
沉淀法、过滤法、蒸馏法的比较:
方法 原理 适用范围 基本操作 所起作用
沉淀法 根据物质溶解性不同 分离液体中混有不溶性固体杂质 加入明矾等凝聚剂,搅拌静置 使水中的悬浮微粒凝聚成较大颗粒而沉淀下来
过滤法 根据物质溶解性不同 除去液体中混有的不溶性固体杂质 溶解、过滤 可除去水中的悬浮颗粒
蒸馏法 根据液体物质的沸点不同 分离或提纯液态混合物 加热、蒸馏、冷凝 可除去水中溶解的物质
相比较而言,净水效果最好的是蒸馏法,一般可直接饮用。
七、探究粗盐的精制
1.实验器材:
烧杯、玻璃棒、蒸发皿、酒精灯、漏斗、药匙、量筒、铁架台(带铁圈)、滤纸、天平等
2.实验步骤:
(1)溶解:用天平称取一定量食盐,用量筒量取一定量水,加入粗盐,搅拌至溶解。
(2)过滤:按过滤要求进行。
(3)蒸发:滤液置于蒸发皿中,边加热边搅拌蒸发结晶。
3.思考一:粗盐精制过程中几次使用玻璃棒的作用是什么?
【答】在粗盐精制的过程中玻璃棒在三处要用到:在溶解时,所起的作用是加速粗盐的溶解;在过滤时,所起作用是引流;在滤液蒸发时,所起的作用是防止液体局部过热,致使液体飞溅。
4.思考二:在滤液蒸发的过程中,加热到什么时候为好?
【答】加热到出现多量固体时,应停止加热,可以利用余热将剩余水蒸发掉。
【经典例题】
【例1】农业上常用10%﹣15%的氯化钠溶液进行选种.将40g质量分数为20%的氯化钠,稀释成10%的氯化钠,需加水的质量为( )
A.80g B.40g C.20g D.12g
【例2】200g质量分数为20%的氯化钠溶液,倒出去溶液体积的一半后加水稀释至200g,再倒出稀释后的溶液体积的一半,加水稀释至200g,所得溶液中溶质的质量分数为( )
A.3% B.5% C.8% D.10%
【例3】浓度为a%的H2SO4溶液mg,若将它稀释到b%,需加水的质量是( )
A.g B.g C.g D.g
【例4】某同学在实验室进行有关浓硫酸的实验,观察到瓶上的标签如表所示.他从瓶中倒出300毫升用于配制稀硫酸.求:
浓硫酸 500毫升
溶质的质量分数 98%
密度 1.84克/厘米3
强腐蚀性,阴冷,密封储藏
(1)这300毫升浓硫酸的质量是多少克?其中含溶质硫酸多少克?
(2)欲配制1000毫升(密度为1.14克/厘米3)质量分数为19.6%的稀硫酸,需要这种浓硫酸和水各多少毫升?
【例5】溶液与人类的生活息息相关,溶液的配制是日常生活和化学实验中的常见操作.
(1)在农业上,常需要用质量分数为16%的氯化钠溶液来选种,现要配制200kg这种溶液,需要氯化钠的质量为 kg.
(2)化学实验室现有质量分数为98%的浓硫酸,但在实验中常用到较稀的硫酸,要把50g上述浓硫酸稀释为质量分数为20%(密度为1.14g/cm3)的硫酸,稀释后20%硫酸溶液体积为 mL(计算结果保留至0.1)
【例6】已知20%的硫酸溶液密度为1.14g/mL,98%的浓硫酸密度为1.84g/mL,水的密度为1g/mL.请计算:
(1)欲配制100g的20%硫酸溶液,需要98%的浓硫酸质量是多少?
(2)欲配制100mL的20%硫酸溶液,需要98%的浓硫酸质量是多少?
(3)100mL98%的浓硫酸可稀释成20%硫酸溶液的体积是多少,加入水的体积是多少?
【例7】如图是某试剂瓶标签上的内容.
(1)要把10g这种浓硫酸稀释为20%的硫酸,需要水的质量为 g.
(2)取10mL该硫酸可配制成9.8%的硫酸 g.
(3)要配置100g质量分数为10%的稀硫酸需要这种浓硫酸的质量是 .
【例8】若用配好的6%的氯化钠溶液(密度约为1.04g/cm3)配制50g质量分数为3%的氯化钠溶液,需6%的氯化钠溶液和水各多少毫升?
【例9】工人师傅用50mL溶质质量分数为98%的浓硫酸(密度为1.84g/cm3)稀释成20%的稀硫酸(密度为1.14g/cm3),可得到多少毫升稀硫酸?需要加水多少毫升?
【例10】某工厂欲用2%的稀硫酸测定本厂排放的废水中氢氧化钾的含量(废水中的其他物质不与稀硫酸反应).试计算用40%的浓硫酸(密度为1.30g/cm3)10ml配制2%的稀硫酸,需加水多少毫升?(密度为1.0g/cm3)
【例11】0.3%的过氧乙酸喷洒液是一种常用的消毒剂,可杀灭多种病原微生物.为配制得到这种喷洒液,可向100mL溶质质量分数为15%的过氧乙酸原液中(工业用过氧乙酸溶液,密度为1.15g/mL)加入多少mL的水?
【例12】配制500mL溶质质量分数为20%的稀硫酸,需要98%的浓硫酸和水各多少毫升?(已知:98%浓硫酸的密度为1.84g/cm3,20%的稀硫酸密度为1.14g/cm3,水的密度为1.0g/cm3)
【例13】蓄电池中需要用到溶质质量分数为30%(密度为1.22g/mL)的硫酸溶液,若要配制5L该硫酸溶液,需要98%的浓硫酸(密度为1.84g/mL) mL浓硫酸稀释时需加水 g.
【例14】如图所示.
(1)该图进行的是 操作.
(2)在此操作中玻璃棒的作用是 ,滤纸的边缘要 液面(填“高于”或“低于”),这主要是因为 .
(3)该操作用于净水,可除水中 杂质,如需要进一步使水净化,则可继续进行 (填“吸附”或“蒸馏”).
(4)我们在生活中可以用 和 代替滤纸和玻璃棒来完成此操作.
(5)过滤后,滤液仍然浑浊,其原因有哪些? .
【课堂演练】
1.用溶质质量分数为98%的浓硫酸10ml(密度为1.84g?ml﹣1)配制溶质质量分数为10%的硫酸溶液,需要量取水的体积是( )
A.180ml B.170ml C.162ml D.88ml
2.化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用较稀的硫酸,要把40g上述浓硫酸稀释为质量分数为20%的稀硫酸,需要水的质量是( )
A.196g B.156g C.155.2g D.8.16g
3.现有质量分数为98%的浓硫酸100g,将上述浓硫酸稀释成质量分数为20%的稀硫酸.需要加入水的质量是多少( )
A.290g B.400g C.390g D.500g
4.用密度为1.84g/cm3质量分数为98%的浓硫酸,配制200ml密度为1.14g/cm3质量分数为20%的稀硫酸,需要98%的浓硫酸( )
A.25.3ml B.40.8ml C.45.6ml D.46.5ml
5.小李同学昨晚与父母到小肥羊吃火锅,吃到一半儿,小王发现汤太咸了,妈妈说,加点开水可冲淡些,加水后,汤内盐的质量分数如何变化?在此过程溶液中溶质的质量分数(a%)与加入水的质量的变化关系如下图所示,其中正确的是( )
A.B. C. D.
6.某溶液溶质的质量分数为20%,蒸发掉40g水后变为40%.蒸发后溶液中溶质的质量是( )
A.8g B.40g C.80g D.16g
7.实验室用密度为1.84g/cm3、质量分数为98%的浓硫酸和蒸馏水,配制400g质量分数为20%的稀硫酸,需要用多少毫升的量筒量取多少毫升的浓硫酸( )
A.100mL 44.47mL B.50mL 44.47mL C.100mL 44.4mL D.50mL 44.4mL
8.向200g40%的氢氧化钠溶液中加入200g水,稀释后溶液中溶质的质量分数是( )
A.10% B.20% C.40% D.5%
9.质量分数为10%的盐酸5g,加水稀释至250g后取出10g,则此10g溶液中溶质的质量分数是( )
A.0.2% B.0.5% C.1% D.2%
10.20℃时,将硝酸钾饱和溶液100克和200克,分别加热蒸发掉20克水后,冷却到原来的温度,各析出了晶体a克和b克,则a和b的关系是( )
A.a<b B.2a=b C.2b=a D.a=b
11.20℃时,恒温蒸发某硝酸钾溶液,第一次蒸发掉10克水,没有晶体析出;第二次又蒸发掉10克水,析出3克晶体;第三次再蒸发掉10克水,析出m克晶体( )
A.m<3 B.m≤3 C.m>3 D.m≥3
12.在温度不变的情况下,将不含结晶水的某物质的溶液甲经历如下的变化:
甲溶液乙溶液丙溶液,据此,下列结论正确的是( )
A.若将甲溶液一次性蒸发20g水,则析出晶体10g
B.若将丙溶液再蒸发10g水,则析出的晶体质量一定大于5g
C.乙溶液和丙溶液中,溶质质量分数不可能相同
D.若乙溶液是饱和溶液,甲溶液加入5g晶体即达到饱和状态
13.溶液在生命活动和生产、生活中起着十分重要的作用.
(1)农业生产常用溶质的质量分数10%~20%的氯化钠溶液来选种.现将300g25%的氯化钠稀释为15%的氯化钠溶液 需要氯化钠和水的质量比为
(2)甲、乙两种固体物质的溶解度曲线如图Ⅰ所示.常温下,分别向装有适量甲、乙物质的两支试管里加入等量的蒸馏水,充分振荡后,两支试管底部均有未溶解的固体;再将两支试管放入盛有冰水混合物的烧杯里,如图Ⅱ所示.
①t1℃时,乙物质的饱和溶液的溶质质量分数 25%(填“>”、“<”、“=”之一).
②若甲中含有少量的杂质乙,可采用 方法提纯甲.(填“蒸发结晶”、“降温结晶”之一)
③在图Ⅱ实验中看到的实验现象是甲试管中固体增多,乙两试管里固体减少.请你对此现象作出解释 .
④20摄氏度时,对甲试管中进行如下操作,最终甲试管中溶液的溶质质量分数一定发生变化的是 .
A.加少量水 B.加入少量甲物质 C.升温 D.蒸发部分溶剂,恢复到20摄氏度.
14.把15%的氯化钠水溶液40克,用水稀释至100克,则溶液中溶质的质量为 克,氯化钠的质量分数为 .
15.结合水和溶液的相关知识,回答下列问题:
(1)对于沉淀、过滤、吸附、蒸馏等净化水的操作,相对净化程度较高的是 .
(2)水是化学实验中常用的试剂,下列各组物质能用水鉴别的是 (填字母).
A.氢氧化钠和硝酸铵 B.食盐和蔗糖 C.高锰酸钾和碘
(3)欲配制100g溶质质量分数为10%的氯化钠溶液,完成此实验的正确操作顺序是 .
①溶解 ②把配好的溶液装入细口瓶 ③称量 ④计算 ⑤量取
(4)如图是a、b、c三种固体物质的溶解度曲线,回答下列问题:
①P点的含义是 .
②在t2℃时,向30克a物质中加入50克水,充分溶解后所得溶液的质量是 克.
③将t1℃时a、b、c三种物质的饱和溶液升温至t2℃,所得溶液中溶质质量分数大小关系是 .
④a物质中含有少量c物质,可用 方法提纯a物质(填“降温结晶”或“蒸发结晶”).
16.人类的日常生活和工农业生产都离不开水.请回答:
(1)净化水时,加入明矾所起的作用是 (填字母序号);
A.静置沉淀 B.吸附沉淀 C.蒸馏 D.过滤
(2)电解水实验中正极产生的气体用 检验;
(3)水是最常见的溶剂,甲和乙两种固体物质的溶解度曲线如右图所示,回答下列问题:
①在 ℃时,甲和乙两种物质的溶解度相等;
②将t1℃时等质量的甲乙两种物质的饱和溶液降温到0℃,析出固体质量较少的是 ;
③t2℃时,将60g甲物质放入100g 水中,充分搅拌,所得溶液的溶质质量分数w1与同温下乙物质的饱和溶液的溶质质量分数w2大小关系为:w1 w2.
17.如图所示,一物体悬挂在饱和的氯化钠溶液中,在恒温条件下向烧杯内溶液中分别加入下列物质(悬挂物不参与反应),说明弹簧秤示数变化情况(填“变大”、“不变”或“变小”):
(1)如果加入氯化钠晶体,弹簧秤示数 ;
(2)如果加入蒸馏水,弹簧秤示数 ;
(3)如果加入氯化钾晶体,弹簧秤示数 .
18.溶解是生活中常见的现象,不同物质在水中的溶解能力不同.
①下表是硝酸钾、食盐在不同温度下的溶解度(单位:g/100g水).
温度(℃) 0 20 40 60 80 100
硝酸钾 13.3 31.6 63.9 110 169 246
食盐 35.7 36.0 36.6 37.3 38.4 39.8
I.上表中的两种物质在40℃时, 的溶解度较大;请用相应的数据列式表示该温度是硝酸钾饱和溶液的质量分数 (不要求计算).
II.请写出一种将硝酸钾的不饱和溶液转化为饱和溶液的方法 .
III.20℃时,将20g 食盐放入50g水中,所得溶液的质量是 g.
IV.从食盐溶液中得到食盐晶体的方法是 .
②用硫酸铜进行如图所示的实验,完成下列填空(用编号表示).
所得三个溶液中:一定属于饱和溶液的是 ,溶液中溶剂质量的大小关系是 .
19.生产上要用质量分数为10%的硫酸溶液来清洗钢材.配置5000mL质量分数为10%的硫酸溶液(密度为1.06g/mL),需要质量分数为98%的硫酸溶液(密度为1.84g/mL)多少毫升?需水多少毫升?
20.依靠科学方法可以克制病情.如,对“非典”病人住过的病房需及时使用15%的过氧乙酸溶液熏蒸2h,或者按每立方米空间用8mL2%过氧乙酸溶液喷雾消毒,1h后通风换气.
(1)要配制1000g15%的过氧乙酸溶液,需要20%的过氧乙酸多少克?
(2)现要用2%的过氧乙酸溶液(密度为1.0g/cm3)对90m3的房间进行喷雾消毒,那么至少需要15%的过氧乙酸溶液多少克?配制时,量取所需的15%的过氧乙酸溶液(密度为A1.1g/cm3)应采用(填50mL、100mL、200mL)规格的量筒为宜.
21.汽车、电动车一般使用铅酸蓄电池.某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸.若用100g质量分数为98%的浓硫酸(密度为1.84g/cm3)配制该稀硫酸时,需要蒸馏水(密度为1g/cm3)的体积为多少ml?(精确到0.1)
22.某同学要将200g 40%的氯化钠溶液加水稀释成10%的溶液,需要加水的质量为多少?若他想将该溶液蒸发水分得到50%的溶液,则他要蒸发掉水的质量为多少?
23.稀释质量分数为98%(密度为1.84g/mL)的浓硫酸配制500mL质量分数为20%的稀硫酸(密度为1.14g/mL),求需浓硫酸多少mL?水多少mL?
【巩固练习】
1.将200g溶质质量分数为10%的蔗糖溶液,蒸发水变成溶质质量分数为20%的蔗糖溶液,需蒸发水的质量为( )
A.90g B.150g C.100g D.80g
2.今年6月份,强降雨给中国南方某地造成汛情和洪涝灾害,各地已采取积极措施防汛抗洪.为防止灾区疾病传染,需对灾区喷洒消毒剂,进行医疗卫生防疫.质量分数为0.2%~1%的过氧乙酸就是用于环境喷洒和用具浸泡的一种消毒剂.现有市售质量分数为20%的过氧乙酸,要配制1%的过氧乙酸10kg,需要市售过氧乙酸的质量为( )
A.0.5 g B.500 g C.100 g D.50 g
3.把400克质量分数为20%的食盐水稀释成质量分数为10%的溶液,需加水( )
A.100克 B.200克 C.400克 D.800克
4.现有40g溶质质量分数为5%的氯化钠溶液,若使该溶液的溶质质量分数变为20%,则需要蒸发掉的水(恒温蒸发)的质量为( )
A.15g B.20g C.25g D.30g
5.把100mL10%的氯化钠溶液稀释50倍,稀释后溶液中的溶质质量( )
A.减少50倍 B.增加50倍 C.不变 D.减少5倍
6.把20g溶质质量分数为95%的酒精,稀释为溶质质量分数为50%的酒精,根据需加水的体积 (水的密度为1g/cm3),为了减少实验误差,最好选用量筒的量程为( )
A.10mL B.50mL C.20mL D.100mL
7.“天地无情,人间有爱”,四川发生的地震灾难牵动着全国人民的心.某市紧急援助的浓度为25%的二氧化氯消毒液10吨,欲稀释成2%的溶液,需加水( )
A.250吨 B.100吨 C.125吨 D.115吨
8.实验室有溶质质量分数为30%的氯化钾溶液,李晓取出一部分溶液,向其中加入60g水后溶质质量分数变为10%,则李晓稀释后的溶液中溶质质量为( )
A.3g B.9g C.15g D.18g
9.某注射用药液的配制方法如下
(1)把1.0g药品溶于水配制成5.0mL溶液a;
(2)取0.1mL溶液a,加水稀释至1.0mL,得溶液b;
(3)取0.1mL溶液b,加水稀释至1.0mL,得溶液c;
(4)取0.2mL溶液c,加水稀释至1.0mL,得溶液d;
在整个配制过程中药液很稀,其密度可近似看做1g/cm3,则1.0g药品一共可配制溶液d的体积是( )
A.2000mL B.2500mL C.250mL D.1000mL
10.在做“估算高锰酸根离子大小”的实验时.取一颗体积为V的高锰酸钾小颗粒配制成10毫升溶液.从中取l毫升溶液加入9毫升水稀释,溶液颜色变浅:从稀释后的溶液中取1毫升溶液加人9毫升水稀释.溶液颜色变得更浅:再从第二次稀释后的溶液中取l毫升溶液加入9毫升水稀释.溶液略显紫红:再从第三次稀释后的溶液中取l毫升溶液加入9毫升水稀释,此时溶液无色.已知最后能看出略显紫红色的10毫升溶液中存在n个高锰酸根离子.则高锰酸根离子的体积大约为( )
A. B. C. D.
11.小明从冰箱冷藏室(温度为4℃)取出一杯4℃的澄清石灰水,盖上杯盖,在室温(温度为20℃)下放置一段时间后,发现杯底有少量晶体析出,下列说法正确的是( )
A.室温时该石灰水溶液一定是饱和溶液 B.4℃时该石灰水溶液一定是不饱和溶液
C.氢氧化钙的溶解度随温度升高而增大 D.室温时该石灰水溶液一定是不饱和溶液
12.下列关于结晶和晶体的说法,错误的是( )
A.饱和溶液降温析出晶体后的溶液仍然是饱和溶液
B.降低饱和溶液的温度不一定有晶体析出
C.从溶液中析出的晶体不一定有结晶水
D.把溶液的溶剂蒸发一些一定会有晶体析出
13.化学活动小组欲用溶质质量分数为98%的浓硫酸配制溶质质量分数为19.6%的稀硫酸,计算50g浓硫酸配制溶质质量分数为19.6%的稀硫酸时需加水 g.若浓硫酸敞口放置溶质的质量分数将 (填“变小”、“变大”或“不变”).
14.把1g药品溶于水制成4mL溶液a;取0.1mL溶液a,加水稀释至1mL得溶液b;取0.1g溶液b加水稀释至1mL得溶液c;取0.2ml溶液c,加水稀释至1mL得溶液d.(密度约为1g/cm3)问最终得到的药液(溶液d)中溶质的质量分数 .
15.若将1500g溶质质量分数为0.2%的某溶液稀释成溶质质量分数为0.1%的溶液,需加水的质量为
g;若将其浓缩为溶质质量分数为2%的溶液,需蒸发掉水的质量为 g.
16.汽车、电动车一般要使用铅酸蓄电池.某铅酸蓄电池用的酸溶液是溶质质量分数为28%的稀硫酸,若用1L溶质质量分数为98%的浓硫酸(密度为1.84g/cm3)配制该稀硫酸时,需要蒸馏水(密度为1g/cm3) L.
17.某花卉基地需要含硝酸钾的质量分数为7%的无土栽培营养液.若将质量分数为20%的硝酸钾溶液280kg加水稀释成该营养液,则稀释时需要水的质量 .
18.20℃时,将一杯物质R的溶液分四次蒸去世10克水(不过滤),每次蒸发后均恢复在20℃观察杯底固体物质的质量,得下表数据
每次蒸去水的质量 第一次 第二次 第三次 第四次
杯底固体物质的总质量 0 1 3 ?
则第四次蒸发水后杯底固体物质的质量为 ,物质R在20℃时的溶解度为 ,物质R的溶解性属于 ,第二次蒸发后所得溶液含R的质量分数为 .
19.实验室常用溶质质量分数为98%的浓硫酸(密度1.84g/cm3)来配制需要用的较稀的硫酸溶液.现要配制500mL溶质质量分数为20%(密度为1.14g/cm3)的硫酸溶液,需要多少毫升浓硫酸?需要加水多少毫升?
20.传染性非典型性肺炎(简称非典)是一种传染性很强的呼吸系统疾病.患者有发热、干咳,白细胞不升高.肺部X线检查有阴影等症状,严重者呼吸窘迫.由于目前还没有很有效的治疗药物,积极采取预防措施是控制非典流行的关键.请问:
过氧乙酸溶液(C2H4O3)是一种消毒剂.若用0.2%的过氧乙酸溶液对全校教室进行消毒,一次需50千克.问配制50千克0.2%的该溶液时需20%的过氧乙酸溶液多少千克?
长期卧床的病人,可用质量分数为50%的酒精溶液擦洗受伤的局部,以促进血液循环,防止褥疮,用市售酒精(质量分数为95%的酒精溶液)100g,配制50%的酒精溶液时,应加入多少克水?
工业生产上,有时要用溶质的质量分数为10%的稀硫酸来清洗钢材.把50kg溶质的质量分数为98%的浓硫酸稀释成溶质的质量分数为10%的稀硫酸,需要水多少千克?
市售的浓盐酸溶质的质量分数为37.6%,密度为1.18g?cm﹣3,现要配制50g溶质的质量分数为5%的盐酸溶液,需要这种浓盐酸多少毫升?需加水多少克?
【课后作业】
1.稀释质量分数为98%(密度为1.84g/mL)的浓硫酸配制500mL质量分数为20%的稀硫酸(密度为1.14g/mL),稀释时需用的水的体积约为( )
A.436.8 mL B.453.7 mL C.456.0 mL D.458.3 mL
2.把10mL溶质质量分数为35%的浓盐酸稀释100倍,则稀释后的溶液中所含溶质的质量( )
A.减少99% B.增大100倍 C.增大1倍 D.不变
3.将80g质量分数为40%的某浓溶液,稀释成10%的稀溶液,需要加水的质量为( )
A.80g B.100g C.240g D.280g
4.把400g 20%的氯化钠溶液稀释成10%的溶液,需再加水( )
A.100g B.200g C.400g D.800g
5.现有溶质质量分数为37%的浓盐酸100mL(密度为1.18g/mL),需要稀释成溶质质量分数为10%的稀盐酸,需要再量取水( )
A.270.0mL B.318.6mL C.366.6mL D.392.94mL
6.将40g质量分数为35%的浓盐酸,稀释成10%的稀盐酸,需加水的质量为( )
A.40g B.50g C.100g D.140g
7.汽车、电动车一般使用铅酸蓄电池.某铅酸蓄电池用的硫酸溶液溶质质量分数为28%,若用1L(1000mL)98%的浓硫酸溶液(密度为1.84g?mL﹣1)配制该硫酸溶液,配制时需要加入蒸馏水的体积为( )
A.1660 mL B.1803.2 mL C.4600 mL D.4636.8 mL
8.为防止春季疾病传染需质量分数为0.2%﹣1%的过氧乙酸用于环境喷洒和用具浸泡的一种消毒剂.现有20%的过氧乙酸200g,配制成1%的过氧乙酸,需加水的质量是( )
A.3800g B.380g C.200g D.360g
9.传统“陈醋”生产过程中有一步称为“冬捞夏晒”,是指冬天捞出醋中的冰,夏日曝晒蒸发醋中的水分,以提高醋的品质,假设用醋酸的质量分数为5%的半成醋,生产l000g10%优级醋,过程中醋酸没有损失,需半成醋的质量为( )
A.500g B.400g C.2000g D.1000g
10.过氧乙酸溶液可以用于消毒.现有质量分数为10%的过氧乙酸溶液500g,将该溶液稀释成2%的过氧乙酸溶液,需加水的质量为( )
A.50g B.200g C.2000g D.2500g
11.家用漂白水的主要成分是次氯酸钠,其浓度大小直接影响漂白水杀灭病菌的效能.已知将含5%次氯酸钠的漂白水和水以1:99的比例稀释后,用于家居消毒效果最佳.若某同学购买的漂白水中次氯酸钠含量为2.5%,则此漂白水的最佳稀释方案应为(由于漂白水的溶质质量分数很小,其密度可近似看成1g/cm3)( )
A.0.5:99 B.0.5:99.5 C.1:49 D.1:49.5
12.注射用链霉素试验针的药液配制方法如下
(1)把2.0g链霉素溶于水,制成4.0mL溶液①;
(2)取0.2mL溶液①加水稀释到1.0mL,得溶液②;
(3)取0.1mL溶液②加水稀释到2.0mL,得溶液③;
(4)取0.2mL溶液③加水稀释到2.0mL,得溶液④.
最终得到的试验针药液(溶液④)中,链霉素的质量分数是(由于整个过程中药液很稀,密度近似看作1g/cm3)( )
A.25% B.0.05% C.0.25% D.2.5%
13.室温时,对某物质的溶液m1进行如下操作,有关说法正确的是( )
m1溶液m2溶液m3溶液.
A.m1溶液可能是不饱和溶液
B.m2溶液可能是饱和溶液
C.溶质质量分数最小的一定是m3溶液
D.室温时,该物质的溶解度一定为40g/100g水
14.下表是20℃时硫酸溶液和氨水的密度与其溶质的质量分数对照表.下列说法正确的是( )
溶液中溶质的质量分数 4% 12% 16% 24% 28%
硫酸溶液的密度(g/mL) 1.02 1.08 1.11 1.17 1.20
氨水的密度(g/mL) 0.98 0.95 0.94 0.91 0.90
A.质量分数为28%的硫酸加入等质量水,所得溶液的密度大于1.08g/mL
B.质量分数为24%的硫酸加入等体积水,所得溶液的密度等于1.08g/mL
C.质量分数为28%的氨水加入等质量水,所得溶液的密度等于0.95g/mL
D.质量分数为24%的氨水加入等体积水,所得溶液的质量分数大于12%
15.在20℃时,将某硝酸钾溶液恒温蒸发水分,第一次蒸发掉10g水,析出晶体2g,第二次蒸发掉10g水,析出晶体3g,由此可以判断,原硝酸钾溶液是 (饱和或者不饱和溶液),第三次再蒸发掉5g水,析出晶体 g.
16.根据如表回答问题.
温度/℃ 0 20 40 60 80 100
溶解度 (g/100g水) 氯化钠 35.7 36.0 36.6 37.3 38.4 39.8
硝酸钾 13.3 31.6 63.9 110 169 246
(1)40℃时,氯化钠固体的溶解度是 g.
(2)60℃时在100g水中加入100g硝酸钾固体,充分溶解后所形成的溶液是 溶液(“饱和”或“不饱和”).
(3)将上述(2)中溶液降温到20℃时,析出的晶体质量是 g.
(4)工业上将硝酸钾和氯化钠的热混合溶液(两者均己达到饱和)冷却至室温,析出晶体.
①析出的晶体中主要物质是 ;
②关于剩余溶液.下列说法正确的是 ;(填序号)
A.只含氯化钠,不含硝酸钾,且氯化钠达到饱和
B.含有氯化钠,又含有硝酸钾,且只有氯化钠达到饱和
C.含有氯化钠,又含有硝酸钾,且两者都达到饱和
D.含有氯化钠,又含有硝酸钾,且只有硝酸钾达到饱和
(5)20℃时,将20克氯化钠溶解在80克水中,应至少蒸发 克(精确到0.1g)水才能配成饱和溶液.蒸发时要用到玻璃棒,其作用是 .
17.在一定温度下,某物质不饱和溶液的质量分数为a%,饱和溶液的质量分数为b%,溶解度为cg,则a、b、c由大到小的顺序是 .
18.将一定量的溶质质量分数为20.0%的某溶液,在一定温度下蒸发掉10.0克水时,有2.0克不含结晶水的溶质晶体析出,此时溶液中溶质的质量分数变为24.0%.则该溶液在此温度下的溶解度为 ;此实验中所取的20.0%的溶液质量为 .
19.t℃时,硝酸钾在水中的溶解度为a克,在该温度下,把b克硝酸钾晶体投入c克水中.
(1)当>时,该溶液中溶质的质量分数是 .
(2)当≤时,该溶液中溶质的质量分数是 .
20.现有80 g质量分数为10%的硝酸钠溶液,试回答下列问题:
(1)上述硝酸钠溶液中含溶质的质量为 g,溶剂的质量为 g;
(2)若向上述溶液中加入20 g水,则所得溶液中溶质的质量分数 ;
(3)若向上述溶液中加入20 g硝酸钠,则所得溶液中溶质的质量分数为 ;
(4)若使上述溶液中溶质的质量分数变为20%,则应加入硝酸钠 g;
(5)若使上述溶液中溶质的质量分数变为20%,则应蒸发水 g;
(6)若使上述溶液中溶质的质量分数变为5%,则应加水 g.
21.20℃时硫酸的密度和百分比浓度对照表如下:
密度(g/cm3) 1.07 1.14 1.30 1.50 1.73 1.84
百分比浓度(%) 10 20 40 60 80 98
实验室要用98%的浓硫酸配制20%的稀硫酸250毫升,问:
(1)250毫升20%稀硫酸的质量为多少克?
需98%的浓硫酸多少毫升?
22.硫酸的密度和硫酸溶液中溶质的质量分数对照表(常温)如下,现往盛有45毫升水的烧杯中放入一个密度为1.14×103kg/m3、体积为20cm3的耐酸小球,然后再慢慢倒入10毫升98%的浓硫酸,并用玻璃棒搅拌,冷却至常温后,求:
密 度/g?cm﹣3 1.01 1.07 1.14 1.22 1.30 1.40 1.50 1.61 1.73 1.81 1.84
溶质的质量分数/% 1 10 20 30 40 50 60 70 80 90 98
(1)稀释后的硫酸的溶质质量分数.
(2)耐酸小球在稀硫酸中静止时受到的浮力.(g取10牛/千克)
23.
二氧化氯(ClO2)1000毫升
溶质的质量分数 80%
密度 1.2克/厘米3
强腐蚀性,阴冷,密封储藏
求:(1)这1000毫升二氧化氯消毒液的质量是 克,其中含溶质二氧化氯 克.
(2)欲配制30千克质量分数为20%的稀二氧化氯消毒液用来消毒,需要多少千克这种二氧化氯消毒液和多少千克水.
24.制作“叶脉书签”需要100mL质量分数为10%氢氧化钠溶液(密度为1.1g/cm3)请计算:
(1)配制时氢氧化钠的固体质量是 克,水的质量是 克
(2)若用20% 的氢氧化钠溶液配制成10%的溶液,需要20%的氢氧化钠溶液的质量是多少克?
为了预防“非典”,人们用过氧乙酸(CH3COOH)对家庭居室和公共场所进行消毒.过氧乙酸具有强的腐蚀性和氧化性,使用时一定要稀释.一般家庭用的是溶质质量分数为0.2%~0.5%的过氧乙酸消毒液,现要配制1 L溶质质量分数为0.5%的过氧乙酸消毒液(密度约为l g/cm3),需要溶质质量分数为20%过氧乙酸溶液多少克?
26.汽车、电动车一般要使用铅酸蓄电池,某铅酸蓄电池用的是稀硫酸.请根据如图情景图完成计算.若配制溶质质量分数为28%的稀硫酸350g,需要溶质质量分数为98%的浓硫酸多少克?蒸馏水多少克?
【参考答案】
经典例题
【例1】B;【例2】B;【例3】D;
【例4】(1)552g;540.96g;
(2)123.9ml,912ml.
【例5】(1)32;(2)214.9.
【例6】(1)需要98%的浓硫酸质量是20.4g.
(2)需要98%的浓硫酸质量为23.3g.
(3)100mL98%的浓硫酸可稀释成20%硫酸溶液的体积是790.9mL,加入水的体积是717.6mL.
【例7】(1)39;(2)184;(3)10.2.
【例8】需6%的氯化钠溶液24.03毫升,需要水25毫升.
【例9】 可得到395.4毫升稀硫酸,需要加水358.8毫升.
【例10】 需加水247ml.
【例11】 加入水的体积为5635mL.
【例12】 需要98%的浓硫酸和水分别是63.22mL、453.66mL.
【例13】1015;4232.
【例14】(1)过滤;(2)引流;高于;若高于滤纸边缘,液体会沿着滤纸和漏斗之间的缝隙流下,达不到过滤的目的;(3)不溶性;蒸馏;(4)纱布;筷子;(5)滤纸破损,液面高于滤纸边缘,仪器不干净;
课堂演练
1.C;2.B;3.C;4.A;5.D;6.D;7.D;8.B;9.A;10.D;11.D;12.D;
13.3:2;<;降温结晶;温度降低,甲物质的溶解度减小,饱和溶液中析出固体,固体增多;乙物质的溶解度增大,固体减少;A;
14.6;6%;
蒸馏;AC;④③⑤①②;在t1℃时,a、c的溶解度都是20g;75;b>a>c;降温结晶;
B;用带火星的木条检验;20;乙;>;
17.不变;变大;变小;
18.硝酸钾;×100%;降低温度;68g;蒸发结晶;A;B>C>A;
19.(1)需要质量分数为98%的硫酸的体积为293.9mL.
(2)需要水的体积为4759.2mL.
20.(1)需要20%的过氧乙酸750g;
(2)至少需要15%的过氧乙酸溶液96g,需要100mL规格的量筒最适宜.
21.390 ml
22.需要加水的质量为600g;他要蒸发掉水的质量为40g.
23.需浓硫酸63.2mL,水453.7mL.
巩固练习
1.C;2.B;3.C;4.D;5.C;6.C;7.D;8.B;9.B;10.C;11.A;12.D;
13.200;变小;
14.0.05%;
15.1500;1350;
16.4.6;
17.520kg;
18.5g;20g;易溶物质;16.7%;
19.需要63.2mL浓硫酸,需要加水453.7mL.
20.配制50千克0.2%的该溶液时需20%的过氧乙酸溶液0.5千克.
21.应加入90g水.
22.需要水440kg.
23.需要这种浓盐酸10.6mL,需加水37.5g.
课后作业
1.B;2.D;3.C;4.C;5.B;6.C;7.C;8.A;9.C;10.C;11.C;12.B;13.B;14.A;
15.不饱和溶液;1.5;
16.36.6;不饱和;68.4;硝酸钾;C;24.4;加快蒸发速度防止液体局部过热而使液滴飞溅;
c>b>a;
31.6g;22g;
×100%;×100%;
20.8;72;8%;28%;10;40;80;
21.(1)250毫升20%稀硫酸的质量为57g.
(2)需要31.6mL浓硫酸.
22.(1)28.4%;(2)228牛.
23.(1)1200;960;(2)需要7.5kg这种二氧化氯消毒液和22.5kg水.
24.解:(1)需要氢氧化钠固体的质量=100mL×1.1g/cm3×10%=11g,则需要水的质量=100mL×1.1g/cm3﹣11g=99g;故答案为:11;99;
(2)需要20%的氢氧化钠溶液的质量为:11g÷20%=55g故答案为:55g.
25.需要溶质质量分数为20%过氧乙酸溶液25克.
26.需要98%的浓硫酸100克,蒸馏水250克.
一、溶质的质量分数
概念:溶液中溶质的质量分数是指溶质质量与溶液质量的比值。
溶质的质量分数的计算公式:
公式的变换形式:m质=m液×溶质的质量分数;
m液=m质÷溶质的质量分数;
一定温度下,饱和溶液中的溶质的质量分数(P%)与溶解度(S)的关系:
P%= ×100%
二、有关溶液稀释问题的计算:
溶液稀释就是往浓溶液中加入溶剂或加入低浓度的较稀溶液变成稀溶液的过程。
溶液稀释问题的特点是:稀释前后溶液中溶质的质量保持不变,即:
浓溶液的质量×浓溶液中的溶质质量分数=稀溶液的质量×稀溶液中溶质的质量分数
由于液体称量比较麻烦,而用量筒量取体积比较方便,所以计算时有时会涉及到溶液的体积,这时要通过密度来进行换算。(ρ=m/V)
由于分子之间存在一定的间隔,所以两种不同液体混合溶解时,一般来说体积不能简单相加,因为混合后体积小于混合前两种液体体积之和。
三、有关溶液的浓缩问题的计算:
溶液的浓缩问题思考方法可以与稀释问题一样来考虑。溶液增浓的方法一般可以:加入溶质、蒸发溶剂、加入较高浓度的浓溶液。
加入溶质增浓的计算:
增浓后的溶质质量分数= ×100%
两种浓度的同种溶质的溶液混合后,所得的溶液中溶质的质量分数一定大于小浓度,小于大浓度的质量分数的值。
混合后溶质的质量分数= ×100%
四、配制一定溶质的质量分数的溶液:(以配制50克10%的氯化钠溶液为例)
实验步骤如下(主要是前3步):
计算:按配制要求计算所需的溶质和溶剂的量。
所需的氯化钠质量:50g×10%=5g
所需溶剂水的质量:50g-5g=45g,水的体积:V=m/ρ=45g/1g.cm-3=45ml
称量(或量取):用天平称取氯化钠5克,用量筒量取45ml的水。
溶解:将溶质和溶剂混合,搅拌至溶质全部溶解。
转移:将配制好的溶液移到指定容器内,贴上标签。
五、晶体的形成
晶体和非晶体的主要区别:
(1)晶体有固定的熔化温度(即熔点),而非晶体则没有固定的熔化温度;
(2)晶体有规则的几何外形,而非晶体则没有固定的几何外形。
晶体的形成:
(1)蒸发溶剂的方法:当饱和溶液蒸发溶剂后(温度不变),便会析出晶体。如我们吃的食盐就是通过海水的蒸发得到的。
具体方法:海水 食盐晶体
蒸发溶剂得到晶体这种方法一般用在溶解度受温度影响不大的固体物质,如得到食盐之类等。
(2)冷却热饱和溶液的方法:这种方法一般用来得到溶解度受温度影响较大的固体物质,如得到硫酸铜晶体、硝酸钾晶体等。
六、水的净化
防止水污染:
(1)在工农业生产和生活中会产生大量的污水。
①工业废水中常含有许多有毒物质;②农业废水中常含有农药、化肥等;
③生活污水中常含有微生物或有利于微生物生长的物质。
(2)污水排放流入湖泊和河流中会造成水污染。
(3)污水的作用会导致生活在河流和湖泊中的水生生物难以生存,甚至死亡,同时还会污染地下水源。
(4)被污水污染的水不能直接饮用和使用,必须经过污水的处理,除去说中的有毒有害物质。
污水的处理
(1)沉淀法:加入明矾或活性炭作凝聚剂,静置几分钟,可见泥沙沉到底,水变清。
(2)过滤法:过滤时应注意“一贴、二低、三靠”。过滤时,玻璃棒的作用是引流。
“一贴”指:滤纸紧贴漏斗内壁;
“二低”指:滤纸低于漏斗口、液体低于滤纸上沿;
“三靠”指:漏斗下端紧靠烧杯内壁、玻璃棒末端轻靠在有三层滤纸的一侧、上面烧杯嘴紧靠玻璃棒中下部。
蒸馏法:注意冷凝管中的水流方向应该是从下往上流。
沉淀法、过滤法、蒸馏法的比较:
方法 原理 适用范围 基本操作 所起作用
沉淀法 根据物质溶解性不同 分离液体中混有不溶性固体杂质 加入明矾等凝聚剂,搅拌静置 使水中的悬浮微粒凝聚成较大颗粒而沉淀下来
过滤法 根据物质溶解性不同 除去液体中混有的不溶性固体杂质 溶解、过滤 可除去水中的悬浮颗粒
蒸馏法 根据液体物质的沸点不同 分离或提纯液态混合物 加热、蒸馏、冷凝 可除去水中溶解的物质
相比较而言,净水效果最好的是蒸馏法,一般可直接饮用。
七、探究粗盐的精制
1.实验器材:
烧杯、玻璃棒、蒸发皿、酒精灯、漏斗、药匙、量筒、铁架台(带铁圈)、滤纸、天平等
2.实验步骤:
(1)溶解:用天平称取一定量食盐,用量筒量取一定量水,加入粗盐,搅拌至溶解。
(2)过滤:按过滤要求进行。
(3)蒸发:滤液置于蒸发皿中,边加热边搅拌蒸发结晶。
3.思考一:粗盐精制过程中几次使用玻璃棒的作用是什么?
【答】在粗盐精制的过程中玻璃棒在三处要用到:在溶解时,所起的作用是加速粗盐的溶解;在过滤时,所起作用是引流;在滤液蒸发时,所起的作用是防止液体局部过热,致使液体飞溅。
4.思考二:在滤液蒸发的过程中,加热到什么时候为好?
【答】加热到出现多量固体时,应停止加热,可以利用余热将剩余水蒸发掉。
【经典例题】
【例1】农业上常用10%﹣15%的氯化钠溶液进行选种.将40g质量分数为20%的氯化钠,稀释成10%的氯化钠,需加水的质量为( )
A.80g B.40g C.20g D.12g
【例2】200g质量分数为20%的氯化钠溶液,倒出去溶液体积的一半后加水稀释至200g,再倒出稀释后的溶液体积的一半,加水稀释至200g,所得溶液中溶质的质量分数为( )
A.3% B.5% C.8% D.10%
【例3】浓度为a%的H2SO4溶液mg,若将它稀释到b%,需加水的质量是( )
A.g B.g C.g D.g
【例4】某同学在实验室进行有关浓硫酸的实验,观察到瓶上的标签如表所示.他从瓶中倒出300毫升用于配制稀硫酸.求:
浓硫酸 500毫升
溶质的质量分数 98%
密度 1.84克/厘米3
强腐蚀性,阴冷,密封储藏
(1)这300毫升浓硫酸的质量是多少克?其中含溶质硫酸多少克?
(2)欲配制1000毫升(密度为1.14克/厘米3)质量分数为19.6%的稀硫酸,需要这种浓硫酸和水各多少毫升?
【例5】溶液与人类的生活息息相关,溶液的配制是日常生活和化学实验中的常见操作.
(1)在农业上,常需要用质量分数为16%的氯化钠溶液来选种,现要配制200kg这种溶液,需要氯化钠的质量为 kg.
(2)化学实验室现有质量分数为98%的浓硫酸,但在实验中常用到较稀的硫酸,要把50g上述浓硫酸稀释为质量分数为20%(密度为1.14g/cm3)的硫酸,稀释后20%硫酸溶液体积为 mL(计算结果保留至0.1)
【例6】已知20%的硫酸溶液密度为1.14g/mL,98%的浓硫酸密度为1.84g/mL,水的密度为1g/mL.请计算:
(1)欲配制100g的20%硫酸溶液,需要98%的浓硫酸质量是多少?
(2)欲配制100mL的20%硫酸溶液,需要98%的浓硫酸质量是多少?
(3)100mL98%的浓硫酸可稀释成20%硫酸溶液的体积是多少,加入水的体积是多少?
【例7】如图是某试剂瓶标签上的内容.
(1)要把10g这种浓硫酸稀释为20%的硫酸,需要水的质量为 g.
(2)取10mL该硫酸可配制成9.8%的硫酸 g.
(3)要配置100g质量分数为10%的稀硫酸需要这种浓硫酸的质量是 .
【例8】若用配好的6%的氯化钠溶液(密度约为1.04g/cm3)配制50g质量分数为3%的氯化钠溶液,需6%的氯化钠溶液和水各多少毫升?
【例9】工人师傅用50mL溶质质量分数为98%的浓硫酸(密度为1.84g/cm3)稀释成20%的稀硫酸(密度为1.14g/cm3),可得到多少毫升稀硫酸?需要加水多少毫升?
【例10】某工厂欲用2%的稀硫酸测定本厂排放的废水中氢氧化钾的含量(废水中的其他物质不与稀硫酸反应).试计算用40%的浓硫酸(密度为1.30g/cm3)10ml配制2%的稀硫酸,需加水多少毫升?(密度为1.0g/cm3)
【例11】0.3%的过氧乙酸喷洒液是一种常用的消毒剂,可杀灭多种病原微生物.为配制得到这种喷洒液,可向100mL溶质质量分数为15%的过氧乙酸原液中(工业用过氧乙酸溶液,密度为1.15g/mL)加入多少mL的水?
【例12】配制500mL溶质质量分数为20%的稀硫酸,需要98%的浓硫酸和水各多少毫升?(已知:98%浓硫酸的密度为1.84g/cm3,20%的稀硫酸密度为1.14g/cm3,水的密度为1.0g/cm3)
【例13】蓄电池中需要用到溶质质量分数为30%(密度为1.22g/mL)的硫酸溶液,若要配制5L该硫酸溶液,需要98%的浓硫酸(密度为1.84g/mL) mL浓硫酸稀释时需加水 g.
【例14】如图所示.
(1)该图进行的是 操作.
(2)在此操作中玻璃棒的作用是 ,滤纸的边缘要 液面(填“高于”或“低于”),这主要是因为 .
(3)该操作用于净水,可除水中 杂质,如需要进一步使水净化,则可继续进行 (填“吸附”或“蒸馏”).
(4)我们在生活中可以用 和 代替滤纸和玻璃棒来完成此操作.
(5)过滤后,滤液仍然浑浊,其原因有哪些? .
【课堂演练】
1.用溶质质量分数为98%的浓硫酸10ml(密度为1.84g?ml﹣1)配制溶质质量分数为10%的硫酸溶液,需要量取水的体积是( )
A.180ml B.170ml C.162ml D.88ml
2.化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用较稀的硫酸,要把40g上述浓硫酸稀释为质量分数为20%的稀硫酸,需要水的质量是( )
A.196g B.156g C.155.2g D.8.16g
3.现有质量分数为98%的浓硫酸100g,将上述浓硫酸稀释成质量分数为20%的稀硫酸.需要加入水的质量是多少( )
A.290g B.400g C.390g D.500g
4.用密度为1.84g/cm3质量分数为98%的浓硫酸,配制200ml密度为1.14g/cm3质量分数为20%的稀硫酸,需要98%的浓硫酸( )
A.25.3ml B.40.8ml C.45.6ml D.46.5ml
5.小李同学昨晚与父母到小肥羊吃火锅,吃到一半儿,小王发现汤太咸了,妈妈说,加点开水可冲淡些,加水后,汤内盐的质量分数如何变化?在此过程溶液中溶质的质量分数(a%)与加入水的质量的变化关系如下图所示,其中正确的是( )
A.B. C. D.
6.某溶液溶质的质量分数为20%,蒸发掉40g水后变为40%.蒸发后溶液中溶质的质量是( )
A.8g B.40g C.80g D.16g
7.实验室用密度为1.84g/cm3、质量分数为98%的浓硫酸和蒸馏水,配制400g质量分数为20%的稀硫酸,需要用多少毫升的量筒量取多少毫升的浓硫酸( )
A.100mL 44.47mL B.50mL 44.47mL C.100mL 44.4mL D.50mL 44.4mL
8.向200g40%的氢氧化钠溶液中加入200g水,稀释后溶液中溶质的质量分数是( )
A.10% B.20% C.40% D.5%
9.质量分数为10%的盐酸5g,加水稀释至250g后取出10g,则此10g溶液中溶质的质量分数是( )
A.0.2% B.0.5% C.1% D.2%
10.20℃时,将硝酸钾饱和溶液100克和200克,分别加热蒸发掉20克水后,冷却到原来的温度,各析出了晶体a克和b克,则a和b的关系是( )
A.a<b B.2a=b C.2b=a D.a=b
11.20℃时,恒温蒸发某硝酸钾溶液,第一次蒸发掉10克水,没有晶体析出;第二次又蒸发掉10克水,析出3克晶体;第三次再蒸发掉10克水,析出m克晶体( )
A.m<3 B.m≤3 C.m>3 D.m≥3
12.在温度不变的情况下,将不含结晶水的某物质的溶液甲经历如下的变化:
甲溶液乙溶液丙溶液,据此,下列结论正确的是( )
A.若将甲溶液一次性蒸发20g水,则析出晶体10g
B.若将丙溶液再蒸发10g水,则析出的晶体质量一定大于5g
C.乙溶液和丙溶液中,溶质质量分数不可能相同
D.若乙溶液是饱和溶液,甲溶液加入5g晶体即达到饱和状态
13.溶液在生命活动和生产、生活中起着十分重要的作用.
(1)农业生产常用溶质的质量分数10%~20%的氯化钠溶液来选种.现将300g25%的氯化钠稀释为15%的氯化钠溶液 需要氯化钠和水的质量比为
(2)甲、乙两种固体物质的溶解度曲线如图Ⅰ所示.常温下,分别向装有适量甲、乙物质的两支试管里加入等量的蒸馏水,充分振荡后,两支试管底部均有未溶解的固体;再将两支试管放入盛有冰水混合物的烧杯里,如图Ⅱ所示.
①t1℃时,乙物质的饱和溶液的溶质质量分数 25%(填“>”、“<”、“=”之一).
②若甲中含有少量的杂质乙,可采用 方法提纯甲.(填“蒸发结晶”、“降温结晶”之一)
③在图Ⅱ实验中看到的实验现象是甲试管中固体增多,乙两试管里固体减少.请你对此现象作出解释 .
④20摄氏度时,对甲试管中进行如下操作,最终甲试管中溶液的溶质质量分数一定发生变化的是 .
A.加少量水 B.加入少量甲物质 C.升温 D.蒸发部分溶剂,恢复到20摄氏度.
14.把15%的氯化钠水溶液40克,用水稀释至100克,则溶液中溶质的质量为 克,氯化钠的质量分数为 .
15.结合水和溶液的相关知识,回答下列问题:
(1)对于沉淀、过滤、吸附、蒸馏等净化水的操作,相对净化程度较高的是 .
(2)水是化学实验中常用的试剂,下列各组物质能用水鉴别的是 (填字母).
A.氢氧化钠和硝酸铵 B.食盐和蔗糖 C.高锰酸钾和碘
(3)欲配制100g溶质质量分数为10%的氯化钠溶液,完成此实验的正确操作顺序是 .
①溶解 ②把配好的溶液装入细口瓶 ③称量 ④计算 ⑤量取
(4)如图是a、b、c三种固体物质的溶解度曲线,回答下列问题:
①P点的含义是 .
②在t2℃时,向30克a物质中加入50克水,充分溶解后所得溶液的质量是 克.
③将t1℃时a、b、c三种物质的饱和溶液升温至t2℃,所得溶液中溶质质量分数大小关系是 .
④a物质中含有少量c物质,可用 方法提纯a物质(填“降温结晶”或“蒸发结晶”).
16.人类的日常生活和工农业生产都离不开水.请回答:
(1)净化水时,加入明矾所起的作用是 (填字母序号);
A.静置沉淀 B.吸附沉淀 C.蒸馏 D.过滤
(2)电解水实验中正极产生的气体用 检验;
(3)水是最常见的溶剂,甲和乙两种固体物质的溶解度曲线如右图所示,回答下列问题:
①在 ℃时,甲和乙两种物质的溶解度相等;
②将t1℃时等质量的甲乙两种物质的饱和溶液降温到0℃,析出固体质量较少的是 ;
③t2℃时,将60g甲物质放入100g 水中,充分搅拌,所得溶液的溶质质量分数w1与同温下乙物质的饱和溶液的溶质质量分数w2大小关系为:w1 w2.
17.如图所示,一物体悬挂在饱和的氯化钠溶液中,在恒温条件下向烧杯内溶液中分别加入下列物质(悬挂物不参与反应),说明弹簧秤示数变化情况(填“变大”、“不变”或“变小”):
(1)如果加入氯化钠晶体,弹簧秤示数 ;
(2)如果加入蒸馏水,弹簧秤示数 ;
(3)如果加入氯化钾晶体,弹簧秤示数 .
18.溶解是生活中常见的现象,不同物质在水中的溶解能力不同.
①下表是硝酸钾、食盐在不同温度下的溶解度(单位:g/100g水).
温度(℃) 0 20 40 60 80 100
硝酸钾 13.3 31.6 63.9 110 169 246
食盐 35.7 36.0 36.6 37.3 38.4 39.8
I.上表中的两种物质在40℃时, 的溶解度较大;请用相应的数据列式表示该温度是硝酸钾饱和溶液的质量分数 (不要求计算).
II.请写出一种将硝酸钾的不饱和溶液转化为饱和溶液的方法 .
III.20℃时,将20g 食盐放入50g水中,所得溶液的质量是 g.
IV.从食盐溶液中得到食盐晶体的方法是 .
②用硫酸铜进行如图所示的实验,完成下列填空(用编号表示).
所得三个溶液中:一定属于饱和溶液的是 ,溶液中溶剂质量的大小关系是 .
19.生产上要用质量分数为10%的硫酸溶液来清洗钢材.配置5000mL质量分数为10%的硫酸溶液(密度为1.06g/mL),需要质量分数为98%的硫酸溶液(密度为1.84g/mL)多少毫升?需水多少毫升?
20.依靠科学方法可以克制病情.如,对“非典”病人住过的病房需及时使用15%的过氧乙酸溶液熏蒸2h,或者按每立方米空间用8mL2%过氧乙酸溶液喷雾消毒,1h后通风换气.
(1)要配制1000g15%的过氧乙酸溶液,需要20%的过氧乙酸多少克?
(2)现要用2%的过氧乙酸溶液(密度为1.0g/cm3)对90m3的房间进行喷雾消毒,那么至少需要15%的过氧乙酸溶液多少克?配制时,量取所需的15%的过氧乙酸溶液(密度为A1.1g/cm3)应采用(填50mL、100mL、200mL)规格的量筒为宜.
21.汽车、电动车一般使用铅酸蓄电池.某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸.若用100g质量分数为98%的浓硫酸(密度为1.84g/cm3)配制该稀硫酸时,需要蒸馏水(密度为1g/cm3)的体积为多少ml?(精确到0.1)
22.某同学要将200g 40%的氯化钠溶液加水稀释成10%的溶液,需要加水的质量为多少?若他想将该溶液蒸发水分得到50%的溶液,则他要蒸发掉水的质量为多少?
23.稀释质量分数为98%(密度为1.84g/mL)的浓硫酸配制500mL质量分数为20%的稀硫酸(密度为1.14g/mL),求需浓硫酸多少mL?水多少mL?
【巩固练习】
1.将200g溶质质量分数为10%的蔗糖溶液,蒸发水变成溶质质量分数为20%的蔗糖溶液,需蒸发水的质量为( )
A.90g B.150g C.100g D.80g
2.今年6月份,强降雨给中国南方某地造成汛情和洪涝灾害,各地已采取积极措施防汛抗洪.为防止灾区疾病传染,需对灾区喷洒消毒剂,进行医疗卫生防疫.质量分数为0.2%~1%的过氧乙酸就是用于环境喷洒和用具浸泡的一种消毒剂.现有市售质量分数为20%的过氧乙酸,要配制1%的过氧乙酸10kg,需要市售过氧乙酸的质量为( )
A.0.5 g B.500 g C.100 g D.50 g
3.把400克质量分数为20%的食盐水稀释成质量分数为10%的溶液,需加水( )
A.100克 B.200克 C.400克 D.800克
4.现有40g溶质质量分数为5%的氯化钠溶液,若使该溶液的溶质质量分数变为20%,则需要蒸发掉的水(恒温蒸发)的质量为( )
A.15g B.20g C.25g D.30g
5.把100mL10%的氯化钠溶液稀释50倍,稀释后溶液中的溶质质量( )
A.减少50倍 B.增加50倍 C.不变 D.减少5倍
6.把20g溶质质量分数为95%的酒精,稀释为溶质质量分数为50%的酒精,根据需加水的体积 (水的密度为1g/cm3),为了减少实验误差,最好选用量筒的量程为( )
A.10mL B.50mL C.20mL D.100mL
7.“天地无情,人间有爱”,四川发生的地震灾难牵动着全国人民的心.某市紧急援助的浓度为25%的二氧化氯消毒液10吨,欲稀释成2%的溶液,需加水( )
A.250吨 B.100吨 C.125吨 D.115吨
8.实验室有溶质质量分数为30%的氯化钾溶液,李晓取出一部分溶液,向其中加入60g水后溶质质量分数变为10%,则李晓稀释后的溶液中溶质质量为( )
A.3g B.9g C.15g D.18g
9.某注射用药液的配制方法如下
(1)把1.0g药品溶于水配制成5.0mL溶液a;
(2)取0.1mL溶液a,加水稀释至1.0mL,得溶液b;
(3)取0.1mL溶液b,加水稀释至1.0mL,得溶液c;
(4)取0.2mL溶液c,加水稀释至1.0mL,得溶液d;
在整个配制过程中药液很稀,其密度可近似看做1g/cm3,则1.0g药品一共可配制溶液d的体积是( )
A.2000mL B.2500mL C.250mL D.1000mL
10.在做“估算高锰酸根离子大小”的实验时.取一颗体积为V的高锰酸钾小颗粒配制成10毫升溶液.从中取l毫升溶液加入9毫升水稀释,溶液颜色变浅:从稀释后的溶液中取1毫升溶液加人9毫升水稀释.溶液颜色变得更浅:再从第二次稀释后的溶液中取l毫升溶液加入9毫升水稀释.溶液略显紫红:再从第三次稀释后的溶液中取l毫升溶液加入9毫升水稀释,此时溶液无色.已知最后能看出略显紫红色的10毫升溶液中存在n个高锰酸根离子.则高锰酸根离子的体积大约为( )
A. B. C. D.
11.小明从冰箱冷藏室(温度为4℃)取出一杯4℃的澄清石灰水,盖上杯盖,在室温(温度为20℃)下放置一段时间后,发现杯底有少量晶体析出,下列说法正确的是( )
A.室温时该石灰水溶液一定是饱和溶液 B.4℃时该石灰水溶液一定是不饱和溶液
C.氢氧化钙的溶解度随温度升高而增大 D.室温时该石灰水溶液一定是不饱和溶液
12.下列关于结晶和晶体的说法,错误的是( )
A.饱和溶液降温析出晶体后的溶液仍然是饱和溶液
B.降低饱和溶液的温度不一定有晶体析出
C.从溶液中析出的晶体不一定有结晶水
D.把溶液的溶剂蒸发一些一定会有晶体析出
13.化学活动小组欲用溶质质量分数为98%的浓硫酸配制溶质质量分数为19.6%的稀硫酸,计算50g浓硫酸配制溶质质量分数为19.6%的稀硫酸时需加水 g.若浓硫酸敞口放置溶质的质量分数将 (填“变小”、“变大”或“不变”).
14.把1g药品溶于水制成4mL溶液a;取0.1mL溶液a,加水稀释至1mL得溶液b;取0.1g溶液b加水稀释至1mL得溶液c;取0.2ml溶液c,加水稀释至1mL得溶液d.(密度约为1g/cm3)问最终得到的药液(溶液d)中溶质的质量分数 .
15.若将1500g溶质质量分数为0.2%的某溶液稀释成溶质质量分数为0.1%的溶液,需加水的质量为
g;若将其浓缩为溶质质量分数为2%的溶液,需蒸发掉水的质量为 g.
16.汽车、电动车一般要使用铅酸蓄电池.某铅酸蓄电池用的酸溶液是溶质质量分数为28%的稀硫酸,若用1L溶质质量分数为98%的浓硫酸(密度为1.84g/cm3)配制该稀硫酸时,需要蒸馏水(密度为1g/cm3) L.
17.某花卉基地需要含硝酸钾的质量分数为7%的无土栽培营养液.若将质量分数为20%的硝酸钾溶液280kg加水稀释成该营养液,则稀释时需要水的质量 .
18.20℃时,将一杯物质R的溶液分四次蒸去世10克水(不过滤),每次蒸发后均恢复在20℃观察杯底固体物质的质量,得下表数据
每次蒸去水的质量 第一次 第二次 第三次 第四次
杯底固体物质的总质量 0 1 3 ?
则第四次蒸发水后杯底固体物质的质量为 ,物质R在20℃时的溶解度为 ,物质R的溶解性属于 ,第二次蒸发后所得溶液含R的质量分数为 .
19.实验室常用溶质质量分数为98%的浓硫酸(密度1.84g/cm3)来配制需要用的较稀的硫酸溶液.现要配制500mL溶质质量分数为20%(密度为1.14g/cm3)的硫酸溶液,需要多少毫升浓硫酸?需要加水多少毫升?
20.传染性非典型性肺炎(简称非典)是一种传染性很强的呼吸系统疾病.患者有发热、干咳,白细胞不升高.肺部X线检查有阴影等症状,严重者呼吸窘迫.由于目前还没有很有效的治疗药物,积极采取预防措施是控制非典流行的关键.请问:
过氧乙酸溶液(C2H4O3)是一种消毒剂.若用0.2%的过氧乙酸溶液对全校教室进行消毒,一次需50千克.问配制50千克0.2%的该溶液时需20%的过氧乙酸溶液多少千克?
长期卧床的病人,可用质量分数为50%的酒精溶液擦洗受伤的局部,以促进血液循环,防止褥疮,用市售酒精(质量分数为95%的酒精溶液)100g,配制50%的酒精溶液时,应加入多少克水?
工业生产上,有时要用溶质的质量分数为10%的稀硫酸来清洗钢材.把50kg溶质的质量分数为98%的浓硫酸稀释成溶质的质量分数为10%的稀硫酸,需要水多少千克?
市售的浓盐酸溶质的质量分数为37.6%,密度为1.18g?cm﹣3,现要配制50g溶质的质量分数为5%的盐酸溶液,需要这种浓盐酸多少毫升?需加水多少克?
【课后作业】
1.稀释质量分数为98%(密度为1.84g/mL)的浓硫酸配制500mL质量分数为20%的稀硫酸(密度为1.14g/mL),稀释时需用的水的体积约为( )
A.436.8 mL B.453.7 mL C.456.0 mL D.458.3 mL
2.把10mL溶质质量分数为35%的浓盐酸稀释100倍,则稀释后的溶液中所含溶质的质量( )
A.减少99% B.增大100倍 C.增大1倍 D.不变
3.将80g质量分数为40%的某浓溶液,稀释成10%的稀溶液,需要加水的质量为( )
A.80g B.100g C.240g D.280g
4.把400g 20%的氯化钠溶液稀释成10%的溶液,需再加水( )
A.100g B.200g C.400g D.800g
5.现有溶质质量分数为37%的浓盐酸100mL(密度为1.18g/mL),需要稀释成溶质质量分数为10%的稀盐酸,需要再量取水( )
A.270.0mL B.318.6mL C.366.6mL D.392.94mL
6.将40g质量分数为35%的浓盐酸,稀释成10%的稀盐酸,需加水的质量为( )
A.40g B.50g C.100g D.140g
7.汽车、电动车一般使用铅酸蓄电池.某铅酸蓄电池用的硫酸溶液溶质质量分数为28%,若用1L(1000mL)98%的浓硫酸溶液(密度为1.84g?mL﹣1)配制该硫酸溶液,配制时需要加入蒸馏水的体积为( )
A.1660 mL B.1803.2 mL C.4600 mL D.4636.8 mL
8.为防止春季疾病传染需质量分数为0.2%﹣1%的过氧乙酸用于环境喷洒和用具浸泡的一种消毒剂.现有20%的过氧乙酸200g,配制成1%的过氧乙酸,需加水的质量是( )
A.3800g B.380g C.200g D.360g
9.传统“陈醋”生产过程中有一步称为“冬捞夏晒”,是指冬天捞出醋中的冰,夏日曝晒蒸发醋中的水分,以提高醋的品质,假设用醋酸的质量分数为5%的半成醋,生产l000g10%优级醋,过程中醋酸没有损失,需半成醋的质量为( )
A.500g B.400g C.2000g D.1000g
10.过氧乙酸溶液可以用于消毒.现有质量分数为10%的过氧乙酸溶液500g,将该溶液稀释成2%的过氧乙酸溶液,需加水的质量为( )
A.50g B.200g C.2000g D.2500g
11.家用漂白水的主要成分是次氯酸钠,其浓度大小直接影响漂白水杀灭病菌的效能.已知将含5%次氯酸钠的漂白水和水以1:99的比例稀释后,用于家居消毒效果最佳.若某同学购买的漂白水中次氯酸钠含量为2.5%,则此漂白水的最佳稀释方案应为(由于漂白水的溶质质量分数很小,其密度可近似看成1g/cm3)( )
A.0.5:99 B.0.5:99.5 C.1:49 D.1:49.5
12.注射用链霉素试验针的药液配制方法如下
(1)把2.0g链霉素溶于水,制成4.0mL溶液①;
(2)取0.2mL溶液①加水稀释到1.0mL,得溶液②;
(3)取0.1mL溶液②加水稀释到2.0mL,得溶液③;
(4)取0.2mL溶液③加水稀释到2.0mL,得溶液④.
最终得到的试验针药液(溶液④)中,链霉素的质量分数是(由于整个过程中药液很稀,密度近似看作1g/cm3)( )
A.25% B.0.05% C.0.25% D.2.5%
13.室温时,对某物质的溶液m1进行如下操作,有关说法正确的是( )
m1溶液m2溶液m3溶液.
A.m1溶液可能是不饱和溶液
B.m2溶液可能是饱和溶液
C.溶质质量分数最小的一定是m3溶液
D.室温时,该物质的溶解度一定为40g/100g水
14.下表是20℃时硫酸溶液和氨水的密度与其溶质的质量分数对照表.下列说法正确的是( )
溶液中溶质的质量分数 4% 12% 16% 24% 28%
硫酸溶液的密度(g/mL) 1.02 1.08 1.11 1.17 1.20
氨水的密度(g/mL) 0.98 0.95 0.94 0.91 0.90
A.质量分数为28%的硫酸加入等质量水,所得溶液的密度大于1.08g/mL
B.质量分数为24%的硫酸加入等体积水,所得溶液的密度等于1.08g/mL
C.质量分数为28%的氨水加入等质量水,所得溶液的密度等于0.95g/mL
D.质量分数为24%的氨水加入等体积水,所得溶液的质量分数大于12%
15.在20℃时,将某硝酸钾溶液恒温蒸发水分,第一次蒸发掉10g水,析出晶体2g,第二次蒸发掉10g水,析出晶体3g,由此可以判断,原硝酸钾溶液是 (饱和或者不饱和溶液),第三次再蒸发掉5g水,析出晶体 g.
16.根据如表回答问题.
温度/℃ 0 20 40 60 80 100
溶解度 (g/100g水) 氯化钠 35.7 36.0 36.6 37.3 38.4 39.8
硝酸钾 13.3 31.6 63.9 110 169 246
(1)40℃时,氯化钠固体的溶解度是 g.
(2)60℃时在100g水中加入100g硝酸钾固体,充分溶解后所形成的溶液是 溶液(“饱和”或“不饱和”).
(3)将上述(2)中溶液降温到20℃时,析出的晶体质量是 g.
(4)工业上将硝酸钾和氯化钠的热混合溶液(两者均己达到饱和)冷却至室温,析出晶体.
①析出的晶体中主要物质是 ;
②关于剩余溶液.下列说法正确的是 ;(填序号)
A.只含氯化钠,不含硝酸钾,且氯化钠达到饱和
B.含有氯化钠,又含有硝酸钾,且只有氯化钠达到饱和
C.含有氯化钠,又含有硝酸钾,且两者都达到饱和
D.含有氯化钠,又含有硝酸钾,且只有硝酸钾达到饱和
(5)20℃时,将20克氯化钠溶解在80克水中,应至少蒸发 克(精确到0.1g)水才能配成饱和溶液.蒸发时要用到玻璃棒,其作用是 .
17.在一定温度下,某物质不饱和溶液的质量分数为a%,饱和溶液的质量分数为b%,溶解度为cg,则a、b、c由大到小的顺序是 .
18.将一定量的溶质质量分数为20.0%的某溶液,在一定温度下蒸发掉10.0克水时,有2.0克不含结晶水的溶质晶体析出,此时溶液中溶质的质量分数变为24.0%.则该溶液在此温度下的溶解度为 ;此实验中所取的20.0%的溶液质量为 .
19.t℃时,硝酸钾在水中的溶解度为a克,在该温度下,把b克硝酸钾晶体投入c克水中.
(1)当>时,该溶液中溶质的质量分数是 .
(2)当≤时,该溶液中溶质的质量分数是 .
20.现有80 g质量分数为10%的硝酸钠溶液,试回答下列问题:
(1)上述硝酸钠溶液中含溶质的质量为 g,溶剂的质量为 g;
(2)若向上述溶液中加入20 g水,则所得溶液中溶质的质量分数 ;
(3)若向上述溶液中加入20 g硝酸钠,则所得溶液中溶质的质量分数为 ;
(4)若使上述溶液中溶质的质量分数变为20%,则应加入硝酸钠 g;
(5)若使上述溶液中溶质的质量分数变为20%,则应蒸发水 g;
(6)若使上述溶液中溶质的质量分数变为5%,则应加水 g.
21.20℃时硫酸的密度和百分比浓度对照表如下:
密度(g/cm3) 1.07 1.14 1.30 1.50 1.73 1.84
百分比浓度(%) 10 20 40 60 80 98
实验室要用98%的浓硫酸配制20%的稀硫酸250毫升,问:
(1)250毫升20%稀硫酸的质量为多少克?
需98%的浓硫酸多少毫升?
22.硫酸的密度和硫酸溶液中溶质的质量分数对照表(常温)如下,现往盛有45毫升水的烧杯中放入一个密度为1.14×103kg/m3、体积为20cm3的耐酸小球,然后再慢慢倒入10毫升98%的浓硫酸,并用玻璃棒搅拌,冷却至常温后,求:
密 度/g?cm﹣3 1.01 1.07 1.14 1.22 1.30 1.40 1.50 1.61 1.73 1.81 1.84
溶质的质量分数/% 1 10 20 30 40 50 60 70 80 90 98
(1)稀释后的硫酸的溶质质量分数.
(2)耐酸小球在稀硫酸中静止时受到的浮力.(g取10牛/千克)
23.
二氧化氯(ClO2)1000毫升
溶质的质量分数 80%
密度 1.2克/厘米3
强腐蚀性,阴冷,密封储藏
求:(1)这1000毫升二氧化氯消毒液的质量是 克,其中含溶质二氧化氯 克.
(2)欲配制30千克质量分数为20%的稀二氧化氯消毒液用来消毒,需要多少千克这种二氧化氯消毒液和多少千克水.
24.制作“叶脉书签”需要100mL质量分数为10%氢氧化钠溶液(密度为1.1g/cm3)请计算:
(1)配制时氢氧化钠的固体质量是 克,水的质量是 克
(2)若用20% 的氢氧化钠溶液配制成10%的溶液,需要20%的氢氧化钠溶液的质量是多少克?
为了预防“非典”,人们用过氧乙酸(CH3COOH)对家庭居室和公共场所进行消毒.过氧乙酸具有强的腐蚀性和氧化性,使用时一定要稀释.一般家庭用的是溶质质量分数为0.2%~0.5%的过氧乙酸消毒液,现要配制1 L溶质质量分数为0.5%的过氧乙酸消毒液(密度约为l g/cm3),需要溶质质量分数为20%过氧乙酸溶液多少克?
26.汽车、电动车一般要使用铅酸蓄电池,某铅酸蓄电池用的是稀硫酸.请根据如图情景图完成计算.若配制溶质质量分数为28%的稀硫酸350g,需要溶质质量分数为98%的浓硫酸多少克?蒸馏水多少克?
【参考答案】
经典例题
【例1】B;【例2】B;【例3】D;
【例4】(1)552g;540.96g;
(2)123.9ml,912ml.
【例5】(1)32;(2)214.9.
【例6】(1)需要98%的浓硫酸质量是20.4g.
(2)需要98%的浓硫酸质量为23.3g.
(3)100mL98%的浓硫酸可稀释成20%硫酸溶液的体积是790.9mL,加入水的体积是717.6mL.
【例7】(1)39;(2)184;(3)10.2.
【例8】需6%的氯化钠溶液24.03毫升,需要水25毫升.
【例9】 可得到395.4毫升稀硫酸,需要加水358.8毫升.
【例10】 需加水247ml.
【例11】 加入水的体积为5635mL.
【例12】 需要98%的浓硫酸和水分别是63.22mL、453.66mL.
【例13】1015;4232.
【例14】(1)过滤;(2)引流;高于;若高于滤纸边缘,液体会沿着滤纸和漏斗之间的缝隙流下,达不到过滤的目的;(3)不溶性;蒸馏;(4)纱布;筷子;(5)滤纸破损,液面高于滤纸边缘,仪器不干净;
课堂演练
1.C;2.B;3.C;4.A;5.D;6.D;7.D;8.B;9.A;10.D;11.D;12.D;
13.3:2;<;降温结晶;温度降低,甲物质的溶解度减小,饱和溶液中析出固体,固体增多;乙物质的溶解度增大,固体减少;A;
14.6;6%;
蒸馏;AC;④③⑤①②;在t1℃时,a、c的溶解度都是20g;75;b>a>c;降温结晶;
B;用带火星的木条检验;20;乙;>;
17.不变;变大;变小;
18.硝酸钾;×100%;降低温度;68g;蒸发结晶;A;B>C>A;
19.(1)需要质量分数为98%的硫酸的体积为293.9mL.
(2)需要水的体积为4759.2mL.
20.(1)需要20%的过氧乙酸750g;
(2)至少需要15%的过氧乙酸溶液96g,需要100mL规格的量筒最适宜.
21.390 ml
22.需要加水的质量为600g;他要蒸发掉水的质量为40g.
23.需浓硫酸63.2mL,水453.7mL.
巩固练习
1.C;2.B;3.C;4.D;5.C;6.C;7.D;8.B;9.B;10.C;11.A;12.D;
13.200;变小;
14.0.05%;
15.1500;1350;
16.4.6;
17.520kg;
18.5g;20g;易溶物质;16.7%;
19.需要63.2mL浓硫酸,需要加水453.7mL.
20.配制50千克0.2%的该溶液时需20%的过氧乙酸溶液0.5千克.
21.应加入90g水.
22.需要水440kg.
23.需要这种浓盐酸10.6mL,需加水37.5g.
课后作业
1.B;2.D;3.C;4.C;5.B;6.C;7.C;8.A;9.C;10.C;11.C;12.B;13.B;14.A;
15.不饱和溶液;1.5;
16.36.6;不饱和;68.4;硝酸钾;C;24.4;加快蒸发速度防止液体局部过热而使液滴飞溅;
c>b>a;
31.6g;22g;
×100%;×100%;
20.8;72;8%;28%;10;40;80;
21.(1)250毫升20%稀硫酸的质量为57g.
(2)需要31.6mL浓硫酸.
22.(1)28.4%;(2)228牛.
23.(1)1200;960;(2)需要7.5kg这种二氧化氯消毒液和22.5kg水.
24.解:(1)需要氢氧化钠固体的质量=100mL×1.1g/cm3×10%=11g,则需要水的质量=100mL×1.1g/cm3﹣11g=99g;故答案为:11;99;
(2)需要20%的氢氧化钠溶液的质量为:11g÷20%=55g故答案为:55g.
25.需要溶质质量分数为20%过氧乙酸溶液25克.
26.需要98%的浓硫酸100克,蒸馏水250克.
同课章节目录
