苏教版(2019)化学 必修一 专题2《研究物质的基本方法》测试题(含答案)
文档属性
| 名称 | 苏教版(2019)化学 必修一 专题2《研究物质的基本方法》测试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 166.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-30 17:26:15 | ||
图片预览

文档简介
《研究物质的基本方法》测试题
一、单选题(每小题只有一个正确答案)
1.图标所警示的是(
)
A.当心火灾——氧化剂
B.当心爆炸——爆炸性物质
C.当心火灾——易燃物质
D.当心爆炸——自燃物质
2.配制一定物质的量浓度的溶液不需要用到的仪器是( )
A.
B.
C.
D.
3.在SiO2、CaCO3和Al粉的混合物中,除去CaCO3和Al粉并净化SiO2,最好用下列哪种溶液处理(
)
A.盐酸
B.氢氧化钠
C.浓硫酸
D.硝酸银
4.某学生配制0.1
mol·L-1氢氧化钠溶液
100
mL,下列操作会造成实际浓度偏高的是( )
A.空盘时天平指针指向左边
B.把烧碱放在滤纸上称量
C.定容时俯视刻度线
D.使用部分变质的烧碱
5.O常用作“示踪原子”。下列关于O的说法不正确的是(
)
A.质子数是8
B.中子数是10
C.质量数是18
D.电子数是26
6.下列说法中,正确的是
A.22.4
LN2中一定含有2molN
B.在标准状况下,20
mLNH3和60
mLO2所含分子个数比为1:3
C.18
g
H2O在标准状况下的体积约为22.4
L
D.80
g
NaOH溶解在1
L水中,所得溶液中溶质的物质的量浓度为2
mol/L
7.下列仪器在酸碱中和反应中不会用到的是(
)
A.烧杯
B.长颈漏斗
C.锥形瓶
D.酸式滴定管
8.某有机物的蒸汽密度是相同条件下CO2密度的两倍,取该有机物22g完全燃烧后,得到18g水和22.4L二氧化碳(标准状况下),该有机物的化学式为(
)
A.C4H8O2
B.C4H8O
C.C4H8
D.C4H8O3
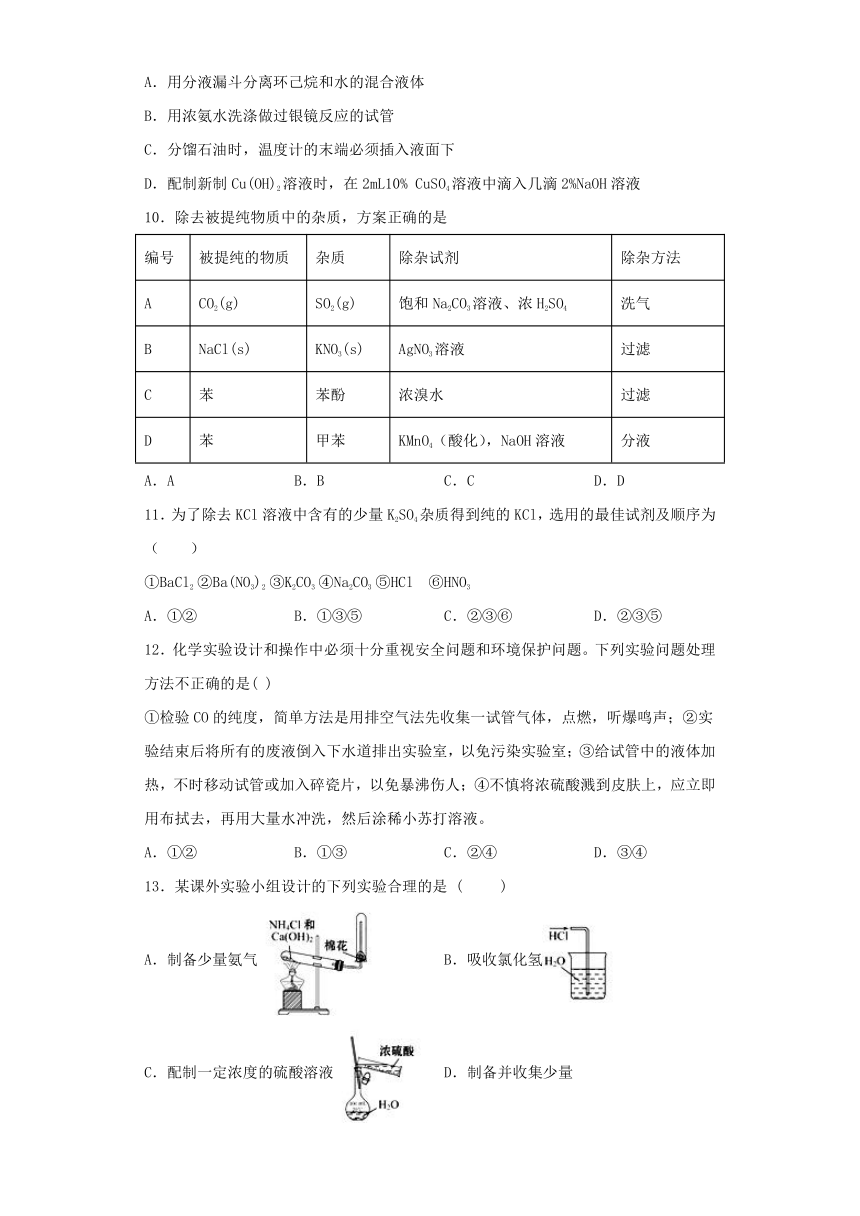
9.下列有关实验的叙述,正确的是
(
)
A.用分液漏斗分离环己烷和水的混合液体
B.用浓氨水洗涤做过银镜反应的试管
C.分馏石油时,温度计的末端必须插入液面下
D.配制新制Cu(OH)2溶液时,在2mL10%
CuSO4溶液中滴入几滴2%NaOH溶液
10.除去被提纯物质中的杂质,方案正确的是
编号
被提纯的物质
杂质
除杂试剂
除杂方法
A
CO2(g)
SO2(g)
饱和Na2CO3溶液、浓H2SO4
洗气
B
NaCl(s)
KNO3(s)
AgNO3溶液
过滤
C
苯
苯酚
浓溴水
过滤
D
苯
甲苯
KMnO4(酸化),NaOH溶液
分液
A.A
B.B
C.C
D.D
11.为了除去KCl溶液中含有的少量K2SO4杂质得到纯的KCl,选用的最佳试剂及顺序为( )
①BaCl2
②Ba(NO3)2
③K2CO3
④Na2CO3
⑤HCl
⑥HNO3
A.①②
B.①③⑤
C.②③⑥
D.②③⑤
12.化学实验设计和操作中必须十分重视安全问题和环境保护问题。下列实验问题处理方法不正确的是(
)
①检验CO的纯度,简单方法是用排空气法先收集一试管气体,点燃,听爆鸣声;②实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室;③给试管中的液体加热,不时移动试管或加入碎瓷片,以免暴沸伤人;④不慎将浓硫酸溅到皮肤上,应立即用布拭去,再用大量水冲洗,然后涂稀小苏打溶液。
A.①②
B.①③
C.②④
D.③④
13.某课外实验小组设计的下列实验合理的是
(
)
A.制备少量氨气
B.吸收氯化氢
C.配制一定浓度的硫酸溶液
D.制备并收集少量NO2
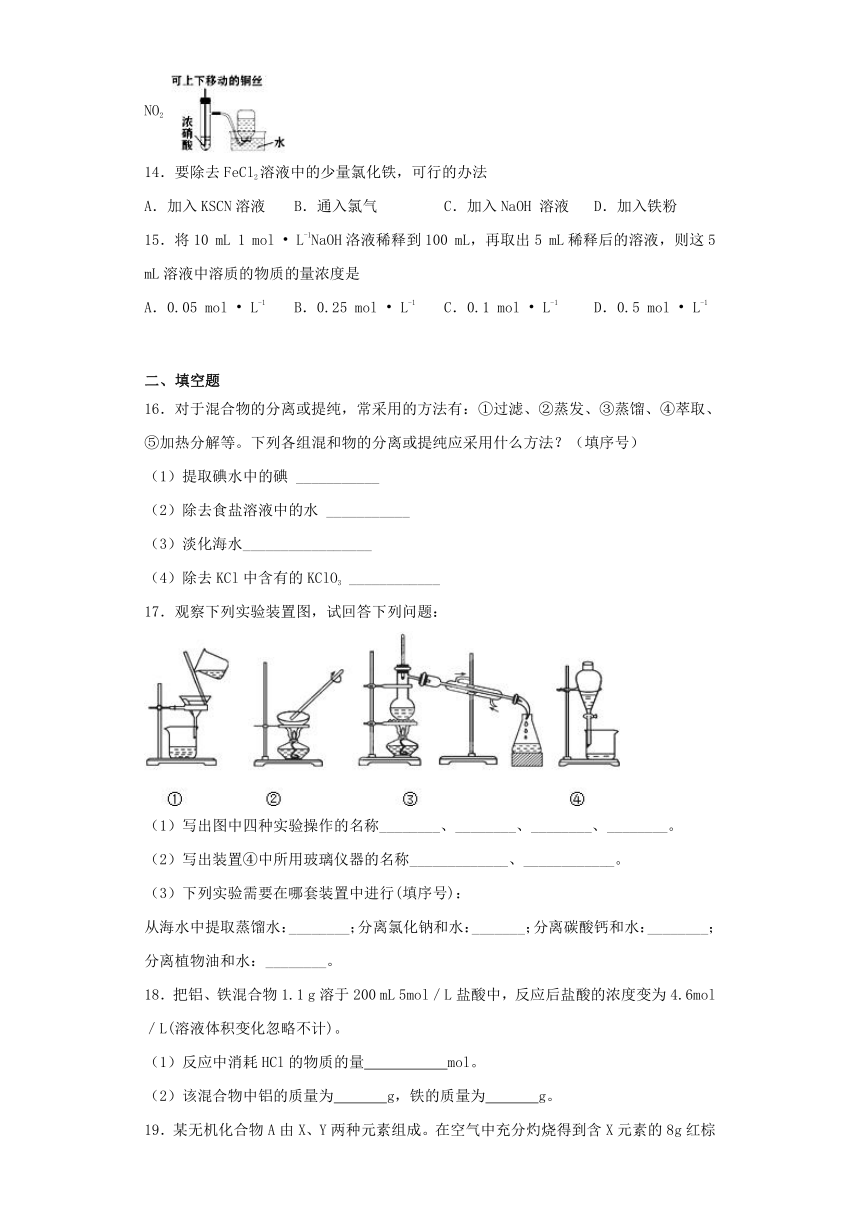
14.要除去FeCl2溶液中的少量氯化铁,可行的办法
A.加入KSCN溶液
B.通入氯气
C.加入NaOH
溶液
D.加入铁粉
15.将10
mL
1
mol
?
L-1NaOH洛液稀释到100
mL,再取出5
mL稀释后的溶液,则这5
mL溶液中溶质的物质的量浓度是
A.0.05
mol
?
L-1
B.0.25
mol
?
L-1
C.0.1
mol
?
L-1
D.0.5
mol
?
L-1
二、填空题
16.对于混合物的分离或提纯,常采用的方法有:①过滤、②蒸发、③蒸馏、④萃取、⑤加热分解等。下列各组混和物的分离或提纯应采用什么方法?(填序号)
(1)提取碘水中的碘
___________
(2)除去食盐溶液中的水
___________
(3)淡化海水_________________
(4)除去KCl中含有的KClO3
____________
17.观察下列实验装置图,试回答下列问题:
(1)写出图中四种实验操作的名称________、________、________、________。
(2)写出装置④中所用玻璃仪器的名称_____________、____________。
(3)下列实验需要在哪套装置中进行(填序号):
从海水中提取蒸馏水:________;分离氯化钠和水:_______;分离碳酸钙和水:________;分离植物油和水:________。
18.把铝、铁混合物1.1
g溶于200
mL
5mol/L盐酸中,反应后盐酸的浓度变为4.6mol/L(溶液体积变化忽略不计)。
(1)反应中消耗HCl的物质的量
mol。
(2)该混合物中铝的质量为
g,铁的质量为
g。
19.某无机化合物A由X、Y两种元素组成。在空气中充分灼烧得到含X元素的8g红棕色固体B,并产生能使品红褪色的气体C,将该气体全部通入足量的双氧水中得D溶液,再向D溶液中加入足量的BaCl2溶液,过滤、洗涤、干燥得46.6g固体。
(1)写出A的化学式
。
(2)写出气体C通入H2O2中反应的离子方程式
。
(3)将A溶于D的稀溶液中得到E,并产生一种单质固体和一种气体,写出该反应的化学方程式
。
(4)将化合物E固体隔绝空气充分灼烧,使其分解,生成等物质的量的B、C和另一种化合物,则另一种化合物的分子式是
;有同学认为该分解反应得到的固体产物中除B外,还可能会有含X元素的低价态物质,请判断该同学的观点是否合理
理由是
。
(5)请设计实验证明E完全分解后的固体产物中是否含有X元素的低价态化合物
。
三、推断题
20.有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙_____;B________;
G_______。
(2)写出反应②反应的化学方程式:_______;反应③的离子方程式:________。
(3)反应①-④的4个反应属于氧化还原反应的有_________
(填选项代号)
A.①②③④
B.①②③
C.①②③
D.①③④
(4)0.1mol的金属单质A与一定量的水完全反应,可得到标准状况下的甲气体_____
L,若得到的D溶液体积为100mL,则溶液的物质的量浓度为___________
。
21.有一包粉末可能含有K+、Fe3+、Al3+、Cl-、SO42-、CO32-中的若干种,现进行以下实验:
①取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
②向①溶液中加入一定量Ba(OH)2溶液,生成有色沉淀;
③取②中的有色沉淀加入足量的稀盐酸后,沉淀全部溶解;
④重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
⑤向④的溶液中加入氨水使溶液呈碱性,有沉淀生成,过滤。往得到的沉淀中加入过量的NaOH溶液,沉淀减少。
(1)根据上述实验,这包粉末中一定不含有的离子是_____________,肯定含有的离子是__________,不能确定是否含有的离子是____________,可通过___________实验来进一步确定是否含有该离子。
(2)写出⑤中生成有色沉淀反应的离子方程式:_____________________;
(3)写出⑤中沉淀减少反应的离子方程式:_____________________
四、实验题
22.有一含NaCl、NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。请回答下列问题。
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是_________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,A中碱石灰的作用是_______。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为_______。
⑤打开活塞K1,缓缓鼓入空气数分钟,拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)实验方案的评价及数据处理
①实验步骤⑤打开活塞K1,缓缓鼓入空气数分钟的目的是__________。
②若样品质量为W
g,反应后C装置增加的质量为m1
g则D装置增重的质量为______g(用含m1的代数式表达),混合物中NaHCO3的质量分数为________(用含W、m1的代数式表示)。
23.在高中阶段,安排了两种酯的制备实验:
乙酸乙酯的制备
乙酸丁酯[CH3COO(CH2)3CH3]的制备
制备这两种酯所涉及的有关物质的物理性质见下表:
乙酸
乙醇
1—丁醇
乙酸乙酯
乙酸丁酯
熔点(℃)
16.6
-117.3
-89.5
-83.6
-73.5
沸点(℃)
117.9
78.5
117
77.06
126.3
密度(g/cm3)
1.05
0.79
0.81
0.90
0.88
水溶性
互溶
互溶
可溶
(9g/100克水)
可溶
(8.5g/100克水)
微溶
请回答下列问题:
(1)在乙酸乙酯的制备过程中,采用水浴加热的优点为_______________________;而乙酸丁酯的制备过程中未采用水浴加热的原因是______________。
(2)提纯时,乙酸乙酯一般采用______洗涤,而乙酸丁酯可先采用______、后采用______洗涤(均填编号)。
a.水
b.15%Na2CO3溶液
c.饱和Na2CO3溶液
(3)两种酯的提纯过程中都需用到的关键仪器是______________,在操作中要注意振荡洗涤后,静置分液前必须要有步骤,所制得的酯应从该仪器的________(填编号)。
a.下部流出
b.上口倒出
c.都可以
(4)在乙酸乙酯制备中,采用了乙醇过量,下列说法不正确的是_______(填编号)。
a.乙醇比乙酸价廉
b.提高乙酸的转化率
c.提高乙醇的转化率
d.提高乙酸乙酯的产率
(5)在乙酸丁酯制备中,下列方法可提高1—丁醇利用率的是________(填编号)。
a.使用催化剂
b.加过量乙酸
c.不断移去产物
d.缩短反应时间
五、计算题
24.常温下,将20.0g14.0%的NaCl溶液跟30.0g24.0%的NaCl溶液混合,得到密度为1.15g/cm3的混合溶液。求:
(1)该混合溶液的质量分数为_________?
(2)该混合溶液的物质的量浓度为_________?
(3)在1000g水中溶解_______摩尔NaCl才能使其浓度与上述溶液的浓度相等?
25.某含(NH4)2SO4和K2SO4的混合溶液100mL,向其中滴加足量的Ba(OH)2溶液,加热,充分反应,生成的气体在标准状况下体积为448
mL,将反应后的溶液过滤得白色沉淀4.66
g。求原混合溶液中K2SO4的物质的量浓度________。
参考答案
1.C
2.A
3.A
4.C
5.D
6.B
7.B
8.A
9.A
10.D
11.B
12.A
13.A
14.D
15.C
16.④
②
③
⑤
17.过滤
蒸发
蒸馏
分液
烧杯
分液漏斗
③
②
①
④
18.24.(1)
0.08
(2)0.54
0.56
19.(1)
FeS2(2分)
(2)SO2+H2O2=2H++SO42-
(2分)
(3)FeS2+H2SO4=H2S↑+S↓+FeSO4(2分)
(4)SO3(2分)
合理(1分)
分解反应可能部分发生非氧化还原反应(或其它合理答案)(2分)
(5)取少量固体加稀硫酸溶解,再滴加酸性KMnO4溶液,若紫色褪去,则证明含有FeO,否则没有。(或其它合理答案)(2分)
20.Cl2
Al
FeCl3
2Al+2NaOH+2H2O=2NaAlO2+3H2
↑
Fe3++3OH-=Fe(OH)3↓
C
1.12
1mol/L
21.CO32-、SO42-
Fe3+、Al3+、Cl-
K+
焰色反应
Fe3++3NH3·H2O=Fe(OH)3↓+NH4+
Al(OH)3+OH-=AlO2-+2H2O
22.检查装置气密性
吸收空气中的水和二氧化碳
2NaHCO3Na2CO3+H2O+CO2↑
使反应产生的水蒸气和二氧化碳完全被C、D吸收
×100%
23.受热均匀,易控制温度
乙酸、1—丁醇和乙酸丁酯的沸点均高于100度,故不必进行水浴加热
c
a
b
分液漏斗
b
c
b
c
24.20.0%
3.93mol/L
4.27mol
25.0.1mol/L
一、单选题(每小题只有一个正确答案)
1.图标所警示的是(
)
A.当心火灾——氧化剂
B.当心爆炸——爆炸性物质
C.当心火灾——易燃物质
D.当心爆炸——自燃物质
2.配制一定物质的量浓度的溶液不需要用到的仪器是( )
A.
B.
C.
D.
3.在SiO2、CaCO3和Al粉的混合物中,除去CaCO3和Al粉并净化SiO2,最好用下列哪种溶液处理(
)
A.盐酸
B.氢氧化钠
C.浓硫酸
D.硝酸银
4.某学生配制0.1
mol·L-1氢氧化钠溶液
100
mL,下列操作会造成实际浓度偏高的是( )
A.空盘时天平指针指向左边
B.把烧碱放在滤纸上称量
C.定容时俯视刻度线
D.使用部分变质的烧碱
5.O常用作“示踪原子”。下列关于O的说法不正确的是(
)
A.质子数是8
B.中子数是10
C.质量数是18
D.电子数是26
6.下列说法中,正确的是
A.22.4
LN2中一定含有2molN
B.在标准状况下,20
mLNH3和60
mLO2所含分子个数比为1:3
C.18
g
H2O在标准状况下的体积约为22.4
L
D.80
g
NaOH溶解在1
L水中,所得溶液中溶质的物质的量浓度为2
mol/L
7.下列仪器在酸碱中和反应中不会用到的是(
)
A.烧杯
B.长颈漏斗
C.锥形瓶
D.酸式滴定管
8.某有机物的蒸汽密度是相同条件下CO2密度的两倍,取该有机物22g完全燃烧后,得到18g水和22.4L二氧化碳(标准状况下),该有机物的化学式为(
)
A.C4H8O2
B.C4H8O
C.C4H8
D.C4H8O3
9.下列有关实验的叙述,正确的是
(
)
A.用分液漏斗分离环己烷和水的混合液体
B.用浓氨水洗涤做过银镜反应的试管
C.分馏石油时,温度计的末端必须插入液面下
D.配制新制Cu(OH)2溶液时,在2mL10%
CuSO4溶液中滴入几滴2%NaOH溶液
10.除去被提纯物质中的杂质,方案正确的是
编号
被提纯的物质
杂质
除杂试剂
除杂方法
A
CO2(g)
SO2(g)
饱和Na2CO3溶液、浓H2SO4
洗气
B
NaCl(s)
KNO3(s)
AgNO3溶液
过滤
C
苯
苯酚
浓溴水
过滤
D
苯
甲苯
KMnO4(酸化),NaOH溶液
分液
A.A
B.B
C.C
D.D
11.为了除去KCl溶液中含有的少量K2SO4杂质得到纯的KCl,选用的最佳试剂及顺序为( )
①BaCl2
②Ba(NO3)2
③K2CO3
④Na2CO3
⑤HCl
⑥HNO3
A.①②
B.①③⑤
C.②③⑥
D.②③⑤
12.化学实验设计和操作中必须十分重视安全问题和环境保护问题。下列实验问题处理方法不正确的是(
)
①检验CO的纯度,简单方法是用排空气法先收集一试管气体,点燃,听爆鸣声;②实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室;③给试管中的液体加热,不时移动试管或加入碎瓷片,以免暴沸伤人;④不慎将浓硫酸溅到皮肤上,应立即用布拭去,再用大量水冲洗,然后涂稀小苏打溶液。
A.①②
B.①③
C.②④
D.③④
13.某课外实验小组设计的下列实验合理的是
(
)
A.制备少量氨气
B.吸收氯化氢
C.配制一定浓度的硫酸溶液
D.制备并收集少量NO2
14.要除去FeCl2溶液中的少量氯化铁,可行的办法
A.加入KSCN溶液
B.通入氯气
C.加入NaOH
溶液
D.加入铁粉
15.将10
mL
1
mol
?
L-1NaOH洛液稀释到100
mL,再取出5
mL稀释后的溶液,则这5
mL溶液中溶质的物质的量浓度是
A.0.05
mol
?
L-1
B.0.25
mol
?
L-1
C.0.1
mol
?
L-1
D.0.5
mol
?
L-1
二、填空题
16.对于混合物的分离或提纯,常采用的方法有:①过滤、②蒸发、③蒸馏、④萃取、⑤加热分解等。下列各组混和物的分离或提纯应采用什么方法?(填序号)
(1)提取碘水中的碘
___________
(2)除去食盐溶液中的水
___________
(3)淡化海水_________________
(4)除去KCl中含有的KClO3
____________
17.观察下列实验装置图,试回答下列问题:
(1)写出图中四种实验操作的名称________、________、________、________。
(2)写出装置④中所用玻璃仪器的名称_____________、____________。
(3)下列实验需要在哪套装置中进行(填序号):
从海水中提取蒸馏水:________;分离氯化钠和水:_______;分离碳酸钙和水:________;分离植物油和水:________。
18.把铝、铁混合物1.1
g溶于200
mL
5mol/L盐酸中,反应后盐酸的浓度变为4.6mol/L(溶液体积变化忽略不计)。
(1)反应中消耗HCl的物质的量
mol。
(2)该混合物中铝的质量为
g,铁的质量为
g。
19.某无机化合物A由X、Y两种元素组成。在空气中充分灼烧得到含X元素的8g红棕色固体B,并产生能使品红褪色的气体C,将该气体全部通入足量的双氧水中得D溶液,再向D溶液中加入足量的BaCl2溶液,过滤、洗涤、干燥得46.6g固体。
(1)写出A的化学式
。
(2)写出气体C通入H2O2中反应的离子方程式
。
(3)将A溶于D的稀溶液中得到E,并产生一种单质固体和一种气体,写出该反应的化学方程式
。
(4)将化合物E固体隔绝空气充分灼烧,使其分解,生成等物质的量的B、C和另一种化合物,则另一种化合物的分子式是
;有同学认为该分解反应得到的固体产物中除B外,还可能会有含X元素的低价态物质,请判断该同学的观点是否合理
理由是
。
(5)请设计实验证明E完全分解后的固体产物中是否含有X元素的低价态化合物
。
三、推断题
20.有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙_____;B________;
G_______。
(2)写出反应②反应的化学方程式:_______;反应③的离子方程式:________。
(3)反应①-④的4个反应属于氧化还原反应的有_________
(填选项代号)
A.①②③④
B.①②③
C.①②③
D.①③④
(4)0.1mol的金属单质A与一定量的水完全反应,可得到标准状况下的甲气体_____
L,若得到的D溶液体积为100mL,则溶液的物质的量浓度为___________
。
21.有一包粉末可能含有K+、Fe3+、Al3+、Cl-、SO42-、CO32-中的若干种,现进行以下实验:
①取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
②向①溶液中加入一定量Ba(OH)2溶液,生成有色沉淀;
③取②中的有色沉淀加入足量的稀盐酸后,沉淀全部溶解;
④重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
⑤向④的溶液中加入氨水使溶液呈碱性,有沉淀生成,过滤。往得到的沉淀中加入过量的NaOH溶液,沉淀减少。
(1)根据上述实验,这包粉末中一定不含有的离子是_____________,肯定含有的离子是__________,不能确定是否含有的离子是____________,可通过___________实验来进一步确定是否含有该离子。
(2)写出⑤中生成有色沉淀反应的离子方程式:_____________________;
(3)写出⑤中沉淀减少反应的离子方程式:_____________________
四、实验题
22.有一含NaCl、NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。请回答下列问题。
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是_________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,A中碱石灰的作用是_______。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为_______。
⑤打开活塞K1,缓缓鼓入空气数分钟,拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)实验方案的评价及数据处理
①实验步骤⑤打开活塞K1,缓缓鼓入空气数分钟的目的是__________。
②若样品质量为W
g,反应后C装置增加的质量为m1
g则D装置增重的质量为______g(用含m1的代数式表达),混合物中NaHCO3的质量分数为________(用含W、m1的代数式表示)。
23.在高中阶段,安排了两种酯的制备实验:
乙酸乙酯的制备
乙酸丁酯[CH3COO(CH2)3CH3]的制备
制备这两种酯所涉及的有关物质的物理性质见下表:
乙酸
乙醇
1—丁醇
乙酸乙酯
乙酸丁酯
熔点(℃)
16.6
-117.3
-89.5
-83.6
-73.5
沸点(℃)
117.9
78.5
117
77.06
126.3
密度(g/cm3)
1.05
0.79
0.81
0.90
0.88
水溶性
互溶
互溶
可溶
(9g/100克水)
可溶
(8.5g/100克水)
微溶
请回答下列问题:
(1)在乙酸乙酯的制备过程中,采用水浴加热的优点为_______________________;而乙酸丁酯的制备过程中未采用水浴加热的原因是______________。
(2)提纯时,乙酸乙酯一般采用______洗涤,而乙酸丁酯可先采用______、后采用______洗涤(均填编号)。
a.水
b.15%Na2CO3溶液
c.饱和Na2CO3溶液
(3)两种酯的提纯过程中都需用到的关键仪器是______________,在操作中要注意振荡洗涤后,静置分液前必须要有步骤,所制得的酯应从该仪器的________(填编号)。
a.下部流出
b.上口倒出
c.都可以
(4)在乙酸乙酯制备中,采用了乙醇过量,下列说法不正确的是_______(填编号)。
a.乙醇比乙酸价廉
b.提高乙酸的转化率
c.提高乙醇的转化率
d.提高乙酸乙酯的产率
(5)在乙酸丁酯制备中,下列方法可提高1—丁醇利用率的是________(填编号)。
a.使用催化剂
b.加过量乙酸
c.不断移去产物
d.缩短反应时间
五、计算题
24.常温下,将20.0g14.0%的NaCl溶液跟30.0g24.0%的NaCl溶液混合,得到密度为1.15g/cm3的混合溶液。求:
(1)该混合溶液的质量分数为_________?
(2)该混合溶液的物质的量浓度为_________?
(3)在1000g水中溶解_______摩尔NaCl才能使其浓度与上述溶液的浓度相等?
25.某含(NH4)2SO4和K2SO4的混合溶液100mL,向其中滴加足量的Ba(OH)2溶液,加热,充分反应,生成的气体在标准状况下体积为448
mL,将反应后的溶液过滤得白色沉淀4.66
g。求原混合溶液中K2SO4的物质的量浓度________。
参考答案
1.C
2.A
3.A
4.C
5.D
6.B
7.B
8.A
9.A
10.D
11.B
12.A
13.A
14.D
15.C
16.④
②
③
⑤
17.过滤
蒸发
蒸馏
分液
烧杯
分液漏斗
③
②
①
④
18.24.(1)
0.08
(2)0.54
0.56
19.(1)
FeS2(2分)
(2)SO2+H2O2=2H++SO42-
(2分)
(3)FeS2+H2SO4=H2S↑+S↓+FeSO4(2分)
(4)SO3(2分)
合理(1分)
分解反应可能部分发生非氧化还原反应(或其它合理答案)(2分)
(5)取少量固体加稀硫酸溶解,再滴加酸性KMnO4溶液,若紫色褪去,则证明含有FeO,否则没有。(或其它合理答案)(2分)
20.Cl2
Al
FeCl3
2Al+2NaOH+2H2O=2NaAlO2+3H2
↑
Fe3++3OH-=Fe(OH)3↓
C
1.12
1mol/L
21.CO32-、SO42-
Fe3+、Al3+、Cl-
K+
焰色反应
Fe3++3NH3·H2O=Fe(OH)3↓+NH4+
Al(OH)3+OH-=AlO2-+2H2O
22.检查装置气密性
吸收空气中的水和二氧化碳
2NaHCO3Na2CO3+H2O+CO2↑
使反应产生的水蒸气和二氧化碳完全被C、D吸收
×100%
23.受热均匀,易控制温度
乙酸、1—丁醇和乙酸丁酯的沸点均高于100度,故不必进行水浴加热
c
a
b
分液漏斗
b
c
b
c
24.20.0%
3.93mol/L
4.27mol
25.0.1mol/L
