苏教版(2019)化学 必修一 专题2《研究物质的基本方法》测试题(含答案) (2)
文档属性
| 名称 | 苏教版(2019)化学 必修一 专题2《研究物质的基本方法》测试题(含答案) (2) | 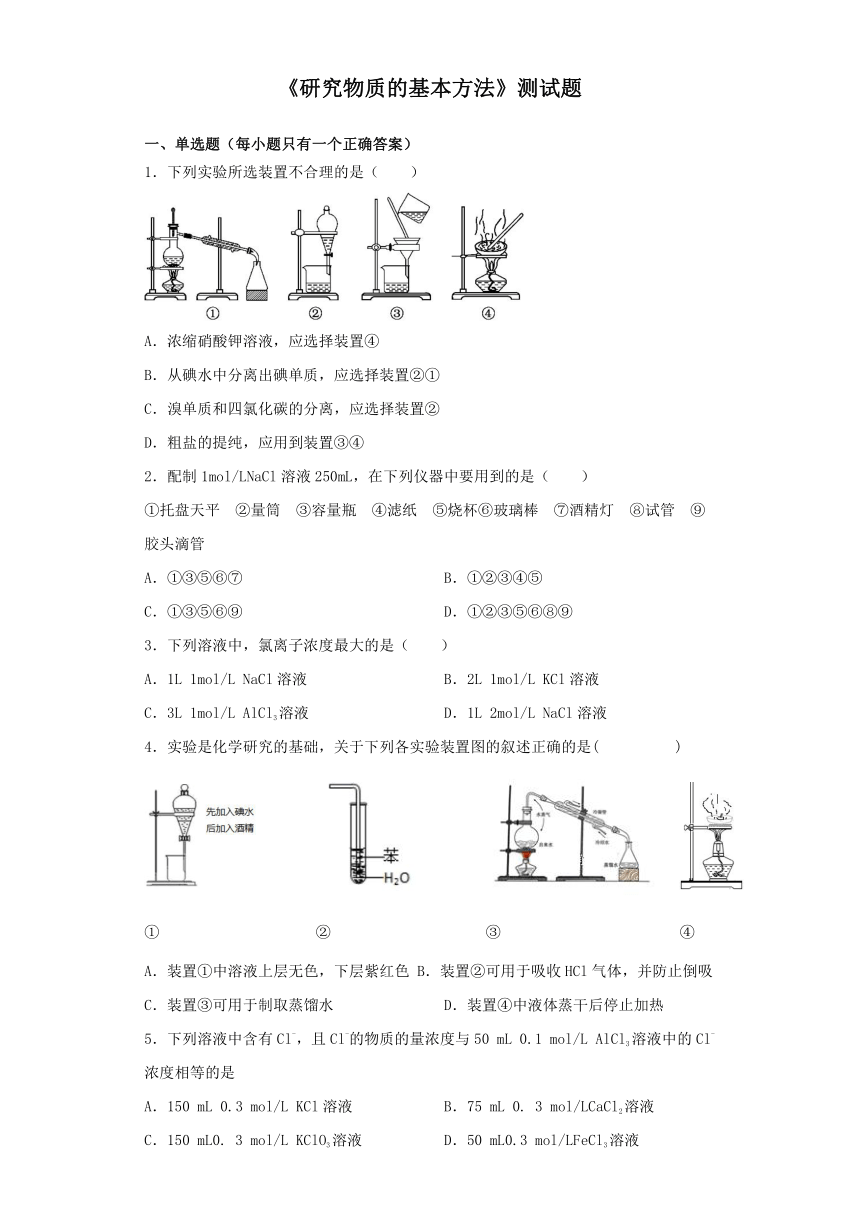 | |
| 格式 | docx | ||
| 文件大小 | 190.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-30 17:26:39 | ||
图片预览



文档简介
《研究物质的基本方法》测试题
一、单选题(每小题只有一个正确答案)
1.下列实验所选装置不合理的是(
)
A.浓缩硝酸钾溶液,应选择装置④
B.从碘水中分离出碘单质,应选择装置②①
C.溴单质和四氯化碳的分离,应选择装置②
D.粗盐的提纯,应用到装置③④
2.配制1mol/LNaCl溶液250mL,在下列仪器中要用到的是(
)
①托盘天平
②量筒
③容量瓶
④滤纸
⑤烧杯⑥玻璃棒
⑦酒精灯
⑧试管
⑨胶头滴管
A.①③⑤⑥⑦
B.①②③④⑤
C.①③⑤⑥⑨
D.①②③⑤⑥⑧⑨
3.下列溶液中,氯离子浓度最大的是(
)
A.1L
1mol/L
NaCl溶液
B.2L
1mol/L
KCl溶液
C.3L
1mol/L
AlCl3溶液
D.1L
2mol/L
NaCl溶液
4.实验是化学研究的基础,关于下列各实验装置图的叙述正确的是(?
???)
①
②
③
④
A.装置①中溶液上层无色,下层紫红色
B.装置②可用于吸收HCl气体,并防止倒吸
C.装置③可用于制取蒸馏水
D.装置④中液体蒸干后停止加热
5.下列溶液中含有Cl-,且Cl-的物质的量浓度与50
mL
0.1
mol/L
AlCl3溶液中的Cl-浓度相等的是
A.150
mL
0.3
mol/L
KCl溶液
B.75
mL
0.
3
mol/LCaCl2溶液
C.150
mL0.
3
mol/L
KClO3溶液
D.50
mL0.3
mol/LFeCl3溶液
6.化学实验中的安全意识是重要的科学素质,下列实验操作或事故处理中,不正确的是(
)
A.稀释浓硫酸时,应将水沿器壁慢慢注入浓硫酸中,并不断搅拌
B.将酒精灯熄灭后,才能向其中补充酒精至适量
C.皮肤上不慎粘苯酚,应立即用酒精洗涤
D.钾、钠着火时,应立即用沙子扑灭
7.关于某无色溶液中所含离子或物质的鉴别,下列判断正确的是(
)
A.加入AgNO3溶液,生成白色沉淀,再加入稀盐酸沉淀不溶解,可确定有Cl-存在。
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不溶解,可确定有SO42-存在。
C.某棕黄色溶液,加入四氯化碳充分振荡静置后下层变为紫红色,则原液有I2存在。
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
8.在相同体积、相同物质的量浓度的酸中,必然相等的是(
)
A.H+
的物质的量
B.溶质的质量分数
C.溶质的质量
D.溶质的物质的量
9.下列关于物质性质与应用因果关系的说法正确的是
A.二氧化碳具有氧化性,在点燃的条件下能将金属镁氧化
B.锌具有还原性和导电性,可作锌锰干电池的正极材料
C.二氧化氯具有还原性,可用于自来水的杀菌消毒
D.氧化铁具有较强的氧化性,可作H2O2分解的氧化剂
10.V
mL?Fe2(SO4)3溶液中含Fe3+ag,取出V
ml,用水稀释成4V
mL,则稀释后溶液中SO42-的物质的量浓度是(
?)
A.mol/L
B.mol/L
C.
mol/L
D.
mol/L
11.下列有关有机化合物的说法正确的是
A.“间二甲苯”中苯环上的一个氢原子被“-C2H3Cl2”
取代时,形成的同分异构体有9种
B.将等物质的量的C2H6与Cl2混合在光照条件下,充分反应可以制得纯净的氯乙烷
C.苯与液溴混合后加入铁粉,此时苯发生了加成反应
D.食物中的纤维素在人体内可以水解生成葡萄糖,为人类活动提供能量
12.下列有关实验说法中,正确的是(
)
A.氯酸钾、高锰酸钾结块时,可放在研钵中先敲击成小块,再研碎
B.用滴定法进行定量测定时,基准物应该具有性质稳定、相对分子质量较小等特点
C.除去NaCl晶体中的少量KNO3时,主要步骤包括:加热溶解、蒸发、冷却结晶、过滤、洗涤、干燥
D.不慎将苯酚沾到皮肤上时,应立即用酒精洗涤,再用水冲洗
13.在Na2SO4和K2SO4的混合溶液中,当c(Na+)=
0.2
mol·L-1,c(SO42-)=
x
mol·L-1,c(K+)=
y
mol·L-1时,x与y的关系是(
)
A.x=0.2+y
B.x=1/2
y
C.x=0.1+1/2
y
D.缺c(H+)和c(OH-)的数值,无法计算
14.废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂。Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.9g和1.3g。
下列说法正确的是( )
A.沉淀甲是LiOH
B.在上述溶解过程,Na2S2O3、LiCoO2反应的化学方程式为8LiCoO2+Na2S2O3+11H2SO4===4Li2SO4+8CoSO4+Na2SO4+11H2O
C.已知:常温下Ksp[Co(OH)2]=1.58×10-15。沉淀钴过程中,当溶液pH=10时,溶液中c(Co2+)=1.58×10-11mol·L-1
D.分离沉淀所需要的玻璃仪器主要是分液漏斗
二、填空题
15.实验室配制100
mL
0.1mol·L-1CuSO4溶液,需要用到下列仪器:烧杯、量筒、钥匙、玻璃棒、托盘天平、胶头滴管
(1)配制时,还缺少的玻璃仪器是_____(填名称)。
(2)下列操作对所配溶液的浓度大小有何影响(填“偏大”、“偏小”或“无影响”)。
①容量瓶未干燥,浓度会_____。
②向容量瓶中加水定容时眼睛一直仰视刻度线,浓度会_____。
16.(1)同温同压下,同体积的S18O2和硫化氢气体(H2S)的物质的量之比为_____,质量之比为_____;同温同压下,等质量的S18O2和H2S的密度之比为_____;
(2)现有0.2mol/L的BaCl2溶液,则2L该溶液中含有_____molBa2+;3L该溶液中,Cl﹣的物质的量浓度是_____mol/L,将原溶液取出10mL,稀释到250mL,则所得溶液的物质的量浓度是_____mol/L,向该溶液加入200mL硫酸溶液,恰好将此溶液中的钡离子完全沉淀,则该硫酸溶液的物质的量浓度是_____mol/L,将沉淀过滤后洗涤干燥并称量,所得固体的质量是_____g。
17.(1)鉴别KCl溶液和K2CO3的试剂是________,离子方程式为________。
(2)除去混入FeCl3溶液混有中少量FeCl2杂质的试剂是_______,离子方程式为__________
(3)除去镁粉末中混入的铝粉剂是_______,化学方程式为__________。
18.氨和硝酸都是重要的工业原料。
(1)标准状况下,将500
L氨气溶于水形成1
L氨水,则此氨水的物质的量浓度为__mol·
L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
(3)下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3=2NaNH2+H2↑
B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O
D.HNO3+NH3=NH4NO3
(4)工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣=NO2﹣+NO3﹣+H2O和NO+NO2+2OH﹣=__+H2O(配平该方程式)。
19.①除去Mg粉中的Al粉的试剂是__,反应的离子方程式为:__;
②还原铁粉与高温水蒸气反应的化学方程式:__;
三、推断题
20.用铁、铝混合物进行如下实验:
操作X的名称是_____,若铝和铁的物质的量相等,前后两次生成气体A的物质的量之比为______,溶液B中阴离子除OH﹣外还有______,溶液D中存在的金属离子主要为______。
21.有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A_________;H
___________;
G__________;乙__________。
(2)检验溶液G中金属阳离子常用的试剂是:____________,现象:____________。
(3)写出下列反应的离子方程式:
反应①____________________________;
反应②____________________________。
四、实验题
22.现用98%的浓H2SO4(密度为1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL。简要回答下列问题。
(1)所需浓硫酸的体积为____mL,量取时发现量筒不干净,用水冲洗后直接量取将会使所配溶液浓度_____。(填偏大、偏小或无影响,下同)
(2)将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,不断搅拌的目的是____,若搅拌过程中有液体溅出,会使所配溶液浓度______。
(3)在转入容量瓶前烧杯中的液体应____,否则会使浓度______。
(4)定容时,若仰视则会使最终结果______;在定容过程中的正确操作应该是_____。
23.“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1000mL、密度1.192g·cm?3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为_____mol·L?1。
(2)该同学取100
mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=____mol·L?1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中____L的CO2(标准状况)而变质。(已知:CO2+2NaClO+H2O=Na2CO3+2HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480mL含25%NaClO的消毒液。下列说法正确的是____。
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143g
五、计算题
24.将117
g
NaCl溶于水配制成1
L溶液。
(1)该溶液中NaCl的物质的量浓度为________,溶液中Cl-的物质的量浓度为________。
(2)配制1
mol·L-1的NaCl溶液500
mL,需该溶液的体积为________。
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3
mol·L-1(假设溶液体积不变),则溶液中H+的物质的量浓度为________,通入HCl气体的体积(标准状况下)为________。
25.(1)将30mL0.5mol/L的H2SO4溶液加水稀释到500mL后,从中取出50mL溶液的物质的量浓度为___。
(2)常温下,将20.0g14%的NaOH溶液跟30.0g24%的NaOH溶液混合,混合后得到1.2g/mL的混合液,试计算:
①混合后的溶液中NaOH的质量分数为___。
②混合后的溶液中NaOH的物质的量浓度为___mol/L。
③配制100mL同浓度溶液需要溶解___g的NaOH才能使其浓度与上述混合液浓度相等。
(3)在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g,该混合气体中,CO和CO2的物质的量之比为___。
参考答案
1.C
2.C
3.C
4.C
5.A
6.A
7.C
8.D
9.A
10.C
11.A
12.D
13.C
14.B
15.100
mL
容量瓶
无影响
偏小
16.1:1
2:1
2:1
0.4
0.4
0.08
0.01
0.466
17.盐酸
CO32-+2H+=CO2↑+H2O
氯气
2Fe2+
+
Cl2=2Fe3+
+
2Cl-
氢氧化钠溶液
2Al
+
2NaOH
+2H2O=2NaAlO2
+
3H2↑
18.22.3
SO2+2NH3?H2O=(NH4)2SO3+H2O
4NH3+5O24NO+6H2O
BC
19.NaOH溶液
2Al+2OH-+2H2O=2AlO2-+3H2↑
3Fe+4H2O(g)Fe3O4+4H2↑
20.过滤
3:2
AlO2-
Fe2+
21.Na
Fe(OH)3
FeCl3
Cl2
KSCN溶液
溶液显红色
Fe+2H+=Fe2++H2↑
2Al+2H2O+2OH-=2AlO2-+3H2↑
22.13.6mL;
偏小;
迅速散热,防止暴沸;
偏小;
冷却至室温;
偏大;
偏小;
向容量瓶中加水至距离刻度线1-2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切。
23.4.0
0.04
89.6
C
24.2
mol·L-1
2
mol·L-1
0.25
L
1
mol·L-1
22.4
L
25.0.03
mol/L
20%
6
24
2:1
一、单选题(每小题只有一个正确答案)
1.下列实验所选装置不合理的是(
)
A.浓缩硝酸钾溶液,应选择装置④
B.从碘水中分离出碘单质,应选择装置②①
C.溴单质和四氯化碳的分离,应选择装置②
D.粗盐的提纯,应用到装置③④
2.配制1mol/LNaCl溶液250mL,在下列仪器中要用到的是(
)
①托盘天平
②量筒
③容量瓶
④滤纸
⑤烧杯⑥玻璃棒
⑦酒精灯
⑧试管
⑨胶头滴管
A.①③⑤⑥⑦
B.①②③④⑤
C.①③⑤⑥⑨
D.①②③⑤⑥⑧⑨
3.下列溶液中,氯离子浓度最大的是(
)
A.1L
1mol/L
NaCl溶液
B.2L
1mol/L
KCl溶液
C.3L
1mol/L
AlCl3溶液
D.1L
2mol/L
NaCl溶液
4.实验是化学研究的基础,关于下列各实验装置图的叙述正确的是(?
???)
①
②
③
④
A.装置①中溶液上层无色,下层紫红色
B.装置②可用于吸收HCl气体,并防止倒吸
C.装置③可用于制取蒸馏水
D.装置④中液体蒸干后停止加热
5.下列溶液中含有Cl-,且Cl-的物质的量浓度与50
mL
0.1
mol/L
AlCl3溶液中的Cl-浓度相等的是
A.150
mL
0.3
mol/L
KCl溶液
B.75
mL
0.
3
mol/LCaCl2溶液
C.150
mL0.
3
mol/L
KClO3溶液
D.50
mL0.3
mol/LFeCl3溶液
6.化学实验中的安全意识是重要的科学素质,下列实验操作或事故处理中,不正确的是(
)
A.稀释浓硫酸时,应将水沿器壁慢慢注入浓硫酸中,并不断搅拌
B.将酒精灯熄灭后,才能向其中补充酒精至适量
C.皮肤上不慎粘苯酚,应立即用酒精洗涤
D.钾、钠着火时,应立即用沙子扑灭
7.关于某无色溶液中所含离子或物质的鉴别,下列判断正确的是(
)
A.加入AgNO3溶液,生成白色沉淀,再加入稀盐酸沉淀不溶解,可确定有Cl-存在。
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不溶解,可确定有SO42-存在。
C.某棕黄色溶液,加入四氯化碳充分振荡静置后下层变为紫红色,则原液有I2存在。
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
8.在相同体积、相同物质的量浓度的酸中,必然相等的是(
)
A.H+
的物质的量
B.溶质的质量分数
C.溶质的质量
D.溶质的物质的量
9.下列关于物质性质与应用因果关系的说法正确的是
A.二氧化碳具有氧化性,在点燃的条件下能将金属镁氧化
B.锌具有还原性和导电性,可作锌锰干电池的正极材料
C.二氧化氯具有还原性,可用于自来水的杀菌消毒
D.氧化铁具有较强的氧化性,可作H2O2分解的氧化剂
10.V
mL?Fe2(SO4)3溶液中含Fe3+ag,取出V
ml,用水稀释成4V
mL,则稀释后溶液中SO42-的物质的量浓度是(
?)
A.mol/L
B.mol/L
C.
mol/L
D.
mol/L
11.下列有关有机化合物的说法正确的是
A.“间二甲苯”中苯环上的一个氢原子被“-C2H3Cl2”
取代时,形成的同分异构体有9种
B.将等物质的量的C2H6与Cl2混合在光照条件下,充分反应可以制得纯净的氯乙烷
C.苯与液溴混合后加入铁粉,此时苯发生了加成反应
D.食物中的纤维素在人体内可以水解生成葡萄糖,为人类活动提供能量
12.下列有关实验说法中,正确的是(
)
A.氯酸钾、高锰酸钾结块时,可放在研钵中先敲击成小块,再研碎
B.用滴定法进行定量测定时,基准物应该具有性质稳定、相对分子质量较小等特点
C.除去NaCl晶体中的少量KNO3时,主要步骤包括:加热溶解、蒸发、冷却结晶、过滤、洗涤、干燥
D.不慎将苯酚沾到皮肤上时,应立即用酒精洗涤,再用水冲洗
13.在Na2SO4和K2SO4的混合溶液中,当c(Na+)=
0.2
mol·L-1,c(SO42-)=
x
mol·L-1,c(K+)=
y
mol·L-1时,x与y的关系是(
)
A.x=0.2+y
B.x=1/2
y
C.x=0.1+1/2
y
D.缺c(H+)和c(OH-)的数值,无法计算
14.废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂。Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.9g和1.3g。
下列说法正确的是( )
A.沉淀甲是LiOH
B.在上述溶解过程,Na2S2O3、LiCoO2反应的化学方程式为8LiCoO2+Na2S2O3+11H2SO4===4Li2SO4+8CoSO4+Na2SO4+11H2O
C.已知:常温下Ksp[Co(OH)2]=1.58×10-15。沉淀钴过程中,当溶液pH=10时,溶液中c(Co2+)=1.58×10-11mol·L-1
D.分离沉淀所需要的玻璃仪器主要是分液漏斗
二、填空题
15.实验室配制100
mL
0.1mol·L-1CuSO4溶液,需要用到下列仪器:烧杯、量筒、钥匙、玻璃棒、托盘天平、胶头滴管
(1)配制时,还缺少的玻璃仪器是_____(填名称)。
(2)下列操作对所配溶液的浓度大小有何影响(填“偏大”、“偏小”或“无影响”)。
①容量瓶未干燥,浓度会_____。
②向容量瓶中加水定容时眼睛一直仰视刻度线,浓度会_____。
16.(1)同温同压下,同体积的S18O2和硫化氢气体(H2S)的物质的量之比为_____,质量之比为_____;同温同压下,等质量的S18O2和H2S的密度之比为_____;
(2)现有0.2mol/L的BaCl2溶液,则2L该溶液中含有_____molBa2+;3L该溶液中,Cl﹣的物质的量浓度是_____mol/L,将原溶液取出10mL,稀释到250mL,则所得溶液的物质的量浓度是_____mol/L,向该溶液加入200mL硫酸溶液,恰好将此溶液中的钡离子完全沉淀,则该硫酸溶液的物质的量浓度是_____mol/L,将沉淀过滤后洗涤干燥并称量,所得固体的质量是_____g。
17.(1)鉴别KCl溶液和K2CO3的试剂是________,离子方程式为________。
(2)除去混入FeCl3溶液混有中少量FeCl2杂质的试剂是_______,离子方程式为__________
(3)除去镁粉末中混入的铝粉剂是_______,化学方程式为__________。
18.氨和硝酸都是重要的工业原料。
(1)标准状况下,将500
L氨气溶于水形成1
L氨水,则此氨水的物质的量浓度为__mol·
L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
(3)下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3=2NaNH2+H2↑
B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O
D.HNO3+NH3=NH4NO3
(4)工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣=NO2﹣+NO3﹣+H2O和NO+NO2+2OH﹣=__+H2O(配平该方程式)。
19.①除去Mg粉中的Al粉的试剂是__,反应的离子方程式为:__;
②还原铁粉与高温水蒸气反应的化学方程式:__;
三、推断题
20.用铁、铝混合物进行如下实验:
操作X的名称是_____,若铝和铁的物质的量相等,前后两次生成气体A的物质的量之比为______,溶液B中阴离子除OH﹣外还有______,溶液D中存在的金属离子主要为______。
21.有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A_________;H
___________;
G__________;乙__________。
(2)检验溶液G中金属阳离子常用的试剂是:____________,现象:____________。
(3)写出下列反应的离子方程式:
反应①____________________________;
反应②____________________________。
四、实验题
22.现用98%的浓H2SO4(密度为1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL。简要回答下列问题。
(1)所需浓硫酸的体积为____mL,量取时发现量筒不干净,用水冲洗后直接量取将会使所配溶液浓度_____。(填偏大、偏小或无影响,下同)
(2)将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,不断搅拌的目的是____,若搅拌过程中有液体溅出,会使所配溶液浓度______。
(3)在转入容量瓶前烧杯中的液体应____,否则会使浓度______。
(4)定容时,若仰视则会使最终结果______;在定容过程中的正确操作应该是_____。
23.“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1000mL、密度1.192g·cm?3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为_____mol·L?1。
(2)该同学取100
mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=____mol·L?1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中____L的CO2(标准状况)而变质。(已知:CO2+2NaClO+H2O=Na2CO3+2HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480mL含25%NaClO的消毒液。下列说法正确的是____。
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143g
五、计算题
24.将117
g
NaCl溶于水配制成1
L溶液。
(1)该溶液中NaCl的物质的量浓度为________,溶液中Cl-的物质的量浓度为________。
(2)配制1
mol·L-1的NaCl溶液500
mL,需该溶液的体积为________。
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3
mol·L-1(假设溶液体积不变),则溶液中H+的物质的量浓度为________,通入HCl气体的体积(标准状况下)为________。
25.(1)将30mL0.5mol/L的H2SO4溶液加水稀释到500mL后,从中取出50mL溶液的物质的量浓度为___。
(2)常温下,将20.0g14%的NaOH溶液跟30.0g24%的NaOH溶液混合,混合后得到1.2g/mL的混合液,试计算:
①混合后的溶液中NaOH的质量分数为___。
②混合后的溶液中NaOH的物质的量浓度为___mol/L。
③配制100mL同浓度溶液需要溶解___g的NaOH才能使其浓度与上述混合液浓度相等。
(3)在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g,该混合气体中,CO和CO2的物质的量之比为___。
参考答案
1.C
2.C
3.C
4.C
5.A
6.A
7.C
8.D
9.A
10.C
11.A
12.D
13.C
14.B
15.100
mL
容量瓶
无影响
偏小
16.1:1
2:1
2:1
0.4
0.4
0.08
0.01
0.466
17.盐酸
CO32-+2H+=CO2↑+H2O
氯气
2Fe2+
+
Cl2=2Fe3+
+
2Cl-
氢氧化钠溶液
2Al
+
2NaOH
+2H2O=2NaAlO2
+
3H2↑
18.22.3
SO2+2NH3?H2O=(NH4)2SO3+H2O
4NH3+5O24NO+6H2O
BC
19.NaOH溶液
2Al+2OH-+2H2O=2AlO2-+3H2↑
3Fe+4H2O(g)Fe3O4+4H2↑
20.过滤
3:2
AlO2-
Fe2+
21.Na
Fe(OH)3
FeCl3
Cl2
KSCN溶液
溶液显红色
Fe+2H+=Fe2++H2↑
2Al+2H2O+2OH-=2AlO2-+3H2↑
22.13.6mL;
偏小;
迅速散热,防止暴沸;
偏小;
冷却至室温;
偏大;
偏小;
向容量瓶中加水至距离刻度线1-2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切。
23.4.0
0.04
89.6
C
24.2
mol·L-1
2
mol·L-1
0.25
L
1
mol·L-1
22.4
L
25.0.03
mol/L
20%
6
24
2:1
