第六单元《碳及其氧化物》复习课件(39张ppt)
文档属性
| 名称 | 第六单元《碳及其氧化物》复习课件(39张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-30 00:00:00 | ||
图片预览










文档简介
(共39张PPT)
人教版第六单元
《碳及其氧化物》复习课件
山东省济南市孙集中学
胡方彬
《石灰吟》
千锤万凿出深山,
物理变化
烈火焚烧若等闲。
粉身碎骨浑不怕,
要留清白在人间。
CO2+Ca(OH)2=CaCO3↓+H2O
CaO+H2O=Ca(OH)2
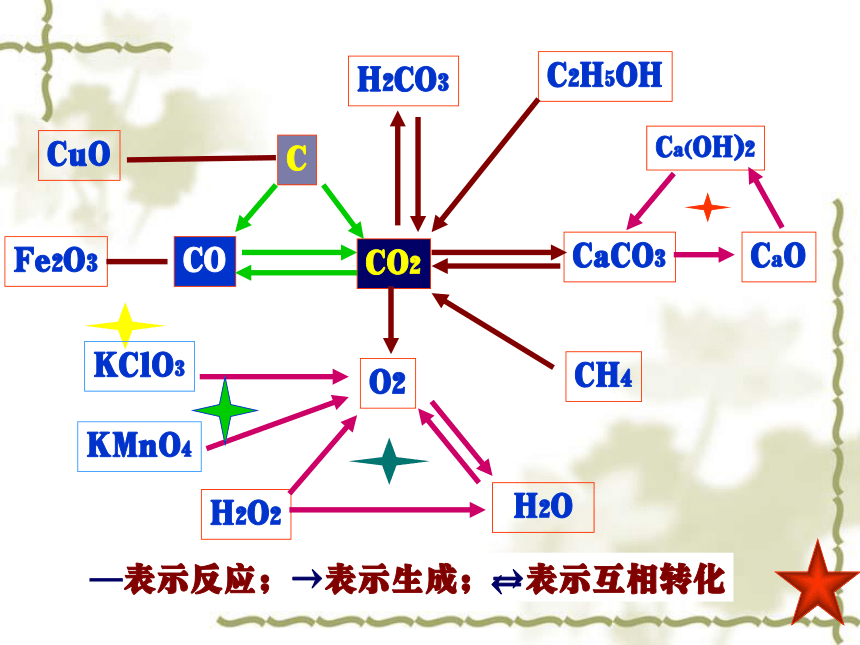
C
CO
CO2
CuO
Fe2O3
H2CO3
CaCO3
C2H5OH
CH4
O2
H2O2
H2O
—表示反应;→表示生成;→表示互相转化
←
Ca(OH)2
CaO
KClO3
KMnO4
1.常温下碳化学性质不活泼
用途:①用墨汁绘画
②钻石恒久远
2.碳能与氧气反应—可燃性
用途:作燃料
3.碳能与某些氧化物反应—还原性
用途:冶炼金属
单质碳的化学性质
一氧化碳的化学性质
1.有毒性
危害:污染空气
2.可燃性
用途:作燃料
3.
还原性
用途:炼铁
(1)CO2不能燃烧,也不能支持燃烧;
(2)CO2不能供给呼吸。
①CO2能与水反应生成碳酸
CO2
+H2O=H2CO3
②光合作用
(3)CO2能与H2O反应
二氧化碳的化学性质
(4)CO2能与石灰水中的氢氧化钙反应
CO2
+
Ca(OH)2
=
CaCO3↓+
H2O
(5)有弱氧化性
C+CO2===2CO
2Mg+CO2===2MgO+C
CO2
+
2NaOH
=
Na2CO3+
H2O
高温
点燃
二氧化碳的化学性质
“利”
1.灭火
2.促进绿色植物光合作用
3.气体肥料
4.化工原料
“弊”
过多造成温室效应
二氧化碳的“利”与“弊”
1.金刚石、石墨与C60结构不同
金刚石、石墨有碳原子构成,
C60有C60分子构成
2.三种碳单质物理性质存在着明显差异的原因?
碳原子的排列方式不同
3.石墨在一定条件下变为金刚石
是
变化,
实质是
。
【结构与性质】
化学
碳原子的排列方式不同
4.从原子结构上分析碳常温下化学性质不活泼
碳原子最外层电子数为4,不易得失电子
5.CO与CO2化学性质不同根本原因
分子结构不同
6.Na与Mg化学性质不同根本原因
最外层电子数不同
8.Na与Na+化学性质不同根本原因
最外层电子数不同
【结构与性质】
1.碳在氧气中燃烧生成CO或CO2:
反应物相同,反应物的量不同,生成物不同
2.CO2与H2O反应生成碳酸或葡萄糖:
反应物相同,反应条件不同,生成物不同
3.硫在氧气和空气中燃烧现象不同:
反应物的浓度不同
4.木炭块和木炭粉在等浓度氧气中燃烧剧烈程度不同
反应物与氧气的接触面积不同
【反应中的不同】
二氧化碳的制取
1)反应原理
2)装置图
3)收集方法
4)检验方法
二氧化碳实验室制取
向上排空气法
将气体通入澄清石灰水或向集气瓶倒入少量澄清石灰水,澄清石灰水变浑浊。
CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2↑
5)验满方法
点燃的木条放在瓶口,若木条熄灭,则已收集满二氧化碳,因为二氧化碳不支持燃烧。
工业上制取二氧化碳—煅烧石灰石
红棕色NO2
木炭(或活性炭)
现象:
红棕色逐渐消失,
倒扣的漏斗内水面上升
原因:
NO2气体被木炭(或活性炭)吸附
瓶内气压减小
【探究吸附作用】
(1)通过对上表的比较,你发现的问题如下:
①实验一和实验二相比:_________________________________________________,
②实验二和实验三相比:________________________________________________,
(2)通过实验,你得出的结论是_____________________________________
。
为什么都是活性炭,实验二红色消失而实验一红色变浅
为什么等质量的木炭和活性炭,实验二红色消失而实验三红色变浅
活性炭的吸附作用比木炭强(或接触面积越大,吸附作用越强)
【探究吸附作用】
实验序号
添加物质及质量
实验现象
实验一
1
g活性炭
溶液的红色变浅
实验二
2
g活性炭
溶液的红色消失
实验三
2
g木炭
溶液的红色变浅
紫色——红色
红色——紫色
【探究CO2性质】
【探究CO2性质】
现象:
干燥的紫色石蕊试纸不变色
湿润的紫色石蕊试纸变红色
结论:
二氧化碳能与水反应
现象:
下面的紫色石蕊试纸先变红色
上面的紫色石蕊试纸后变红色
结论:
二氧化碳的密度比空气大
二氧化碳能与水反应
【探究CO2性质】
将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,
现象:
①试管内液面上升
②试管内溶液变红
结论:
二氧化碳能与水反应
充满CO2
滴入紫色
石蕊的水
【探究CO2性质】
右图①④为用紫色石蕊溶液润湿的棉球,②③为用石蕊溶液染成紫色的干燥棉球.
现象:
④比①先变红,
②、③不变红
结论:
二氧化碳密度大于空气
二氧化碳能与水反应
【探究CO2性质】
小彭同学设计了如图装置并验证二氧化碳的性质,当通入二氧化碳一段时间后,
F中的现象:
G中澄清石灰水变
浑浊,反应的化学
方程式
:
H中观察到蜡烛由低到高依次熄灭,说明
紫色石蕊溶液变红色
Ca(OH)2+CO2═CaCO3↓+H2O
二氧化碳的密度比空气大,不能燃烧,不支持燃烧
【探究CO2性质】
F
G
H
二氧化碳溶于水后的溶液中含有:
。
【实验目的】
为了探究二氧化碳与水反应后的溶液中哪种物质使紫色石蕊变红色。
【提出问题】
什么物质使紫色石蕊变红的呢?
【猜想与假设】
猜想1.二氧化碳使紫色石蕊变红
猜想2.水使紫色石蕊变红
猜想3.碳酸使紫色石蕊变红
CO2、H2O、H2CO3
【物质探究】
—四朵纸花
Ⅰ中小花变红色,探究酸能使紫色石蕊变红
Ⅱ中小花不变红,探究水不能使紫色石蕊变红
Ⅲ中小花不变红色,探究二氧化碳不能使紫色石蕊变红
Ⅳ中小花变红色,探究碳酸使紫色石蕊变红
Ⅴ中小花由红色变为紫色,探究碳酸不稳定,受热易分解
现象及目的
Ⅰ
石蕊和某些酸的反应
Ⅲ
直接放入CO2中
Ⅱ
喷水
Ⅳ
喷水后
放入CO2中
【设计并实验】
Ⅴ用吹风机给变红色的小花加热
结论:猜想
正确。
3
【反思与评价】
(1)步骤Ⅱ有没有必要做?为什么?
没有必要做。因为第Ⅳ已经做了对比试验
(2)如果要证明稀醋酸中水不能使紫色石蕊变红色操作顺序调整为:
。
Ⅱ、Ⅰ、Ⅲ、Ⅳ
Ⅰ
石蕊和某些酸的反应
Ⅲ
直接放入CO2中
Ⅱ
喷水
Ⅳ
喷水后
放入CO2中
【气体净化】
1.净化气体:
先除去气体杂质,再干燥(浓硫酸)
2.CO2(HCl和H2O)
依次通过(1)饱和NaHCO3溶液
(2)浓硫酸
3.O2(H2O)
通过浓硫酸
专题归纳
【物质推断】
1.黑色固体:
木炭(C)、CuO、MnO2、Fe3O4、铁粉
2.红色固体:
氧化铁(Fe2O3)、铜(Cu)
3.
白色固体:
氯化钾(KCl)氯酸钾(KClO3)
氧化镁(MgO)五氧化二磷(P2O5)
碳酸钙(CaCO3)
(1)若A为单质,B、C为
化合物,且组成元素相同,
则:A
;B
;C
.
(2)若C为单质,A、B为
化合物,且组成元素相同,
则:A
;B
;C
.
【物质推断】
【物质推断】
4、三角关系
碳三角
氧三角
钙三角
1.有A、B、C、D四种单质,通常情况下,A、D是无色气
体,B是红色金属,C是黑色粉末。现在进行下列实验:
①在D中加热B,生成一种黑色固体E;
②C与黑色固体E混合加热后,得到B和一种无色气体;
③向①的黑色固体E通入气体A并加热,得到B和水。
据以上实验,试推断这四种单质的化学式
A:___
B:___
C:___
D:___
E:
——
【物质推断】
Cu
CuO
O2
C
H2
(1)若A为常见黑色固体,B为红色固体,
则乙为
。
CO2
【物质推断】
(1)若乙为无色液体,B为红色固体,
则A为
。
H2
1、检验气体方法
(1)检验氧气方法
带火星木条
(2)检验二氧化碳方法
澄清石灰水
(3)检验氢气方法
点燃,验证产物为水
(4)检验一氧化碳方法
点燃,验证产物为二氧化碳
(5)检验甲烷(CH4)方法
点燃,验证产物为二氧化碳和水
【物质鉴别】
2、鉴别CO和CO2
(1)用燃着木条;
(2)通过灼热氧化铜;
(3)通过澄清石灰水;
(4)通过紫色石蕊溶液
【物质鉴别】
例题:一种无色气体X与灼热的木炭反应,
得到另一种气体Y,Y气体与灼热的氧化铜
反应又得到X气体,则X、Y分别是(
)
A、CO2、O2 B、CO2、CO
C、CO、CO2
D、O2、CO
【物质鉴别】
B
1.CO(CO2)
2.CO2(CO)
3.CO2(O2)
4.Cu(CuO)
5.CuO(Cu)
【物质除杂】
通过澄清石灰水
通过灼热的氧化铜
通过灼热的铜网
通入一氧化碳
通过氧气流加热
例题:要除去二氧化碳气体中混有的少量一氧化碳气体,应采用的方法是(
)
A、将混合气体通过澄清的石灰水
B、将混合气体从一个容器倒入另一个容器
C、将混合气体通过灼热的氧化铜粉末
D、将混合气体点燃
【物质除杂】
C
例题、欲除去CO中混有的少量CO2,其措施是( )
A、点燃
B、通入灼热的氧化铜
C、通往石灰水
D、通入石蕊试液
例题、在CO中混有的少量CO2和水蒸气,要得到纯净的CO,可将混合气体依次通过( )
A、灼热的氧化铜、浓H2SO4
B、浓H2SO4、灼热的氧化铜
C、浓H2SO4、NaOH溶液
D、NaOH溶液、浓H2SO4
D
D
【三种还原剂】
C(固体单质)、
CO(氧化物)、H2(气体单质)
例题、由碳和氧两种元素组成的气体,碳与氧两种元素的质量比为3∶5,该气体( )
A、一氧化碳或二氧化碳的纯净物
B、一氧化碳和二氧化碳的混合物
C、一氧化碳与氧气的混合物
D、二氧化碳与氧气的混合物
结论:
例题、相同质量的CO和CO2中,碳元素的质量比是( )
A、7∶11
B、11∶7
C、1∶1
D、14∶11
如图是实验室制取气体的一些常用装置,请根据装置图回答下列问题
(1)A、B装置连接,B中蜡烛发出明亮的火焰,则A装置中发生反应的化学方程式是
;B装置烧杯中可以观察到的现象是
。若观察到B中蜡烛迅速熄灭,则A装置中所需的实验药品是
。
(2)若要得到干燥的气体需将A装置导管口与C装置
(填“a”或“b”)端相连。
(3)实验结束后,将A装置中固液分离,使用D装置,其中的错误操作有
(写出一处错误即可)。过滤后发现烧杯中的滤液仍然浑浊,可能的原因是
。
人教版第六单元
《碳及其氧化物》复习课件
山东省济南市孙集中学
胡方彬
《石灰吟》
千锤万凿出深山,
物理变化
烈火焚烧若等闲。
粉身碎骨浑不怕,
要留清白在人间。
CO2+Ca(OH)2=CaCO3↓+H2O
CaO+H2O=Ca(OH)2
C
CO
CO2
CuO
Fe2O3
H2CO3
CaCO3
C2H5OH
CH4
O2
H2O2
H2O
—表示反应;→表示生成;→表示互相转化
←
Ca(OH)2
CaO
KClO3
KMnO4
1.常温下碳化学性质不活泼
用途:①用墨汁绘画
②钻石恒久远
2.碳能与氧气反应—可燃性
用途:作燃料
3.碳能与某些氧化物反应—还原性
用途:冶炼金属
单质碳的化学性质
一氧化碳的化学性质
1.有毒性
危害:污染空气
2.可燃性
用途:作燃料
3.
还原性
用途:炼铁
(1)CO2不能燃烧,也不能支持燃烧;
(2)CO2不能供给呼吸。
①CO2能与水反应生成碳酸
CO2
+H2O=H2CO3
②光合作用
(3)CO2能与H2O反应
二氧化碳的化学性质
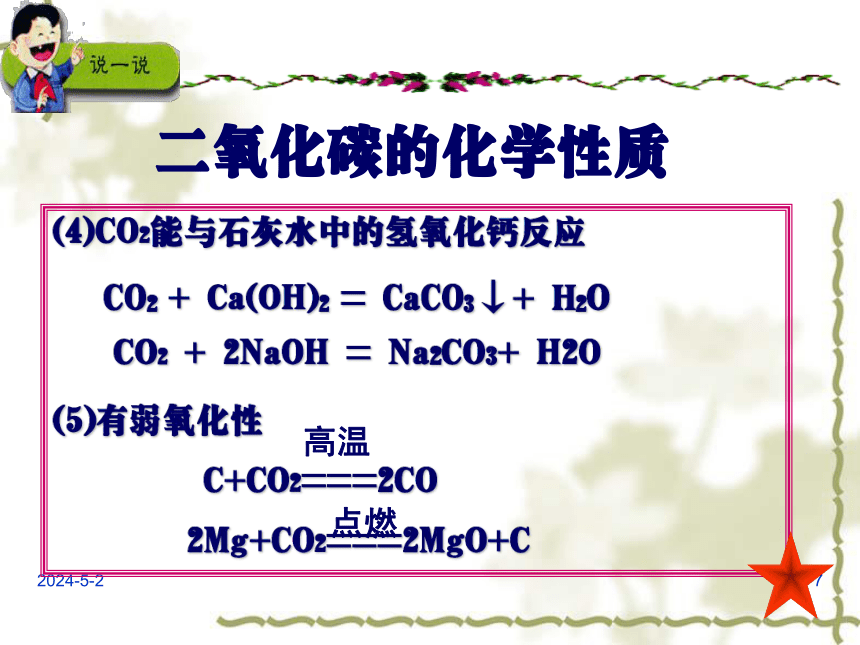
(4)CO2能与石灰水中的氢氧化钙反应
CO2
+
Ca(OH)2
=
CaCO3↓+
H2O
(5)有弱氧化性
C+CO2===2CO
2Mg+CO2===2MgO+C
CO2
+
2NaOH
=
Na2CO3+
H2O
高温
点燃
二氧化碳的化学性质
“利”
1.灭火
2.促进绿色植物光合作用
3.气体肥料
4.化工原料
“弊”
过多造成温室效应
二氧化碳的“利”与“弊”
1.金刚石、石墨与C60结构不同
金刚石、石墨有碳原子构成,
C60有C60分子构成
2.三种碳单质物理性质存在着明显差异的原因?
碳原子的排列方式不同
3.石墨在一定条件下变为金刚石
是
变化,
实质是
。
【结构与性质】
化学
碳原子的排列方式不同
4.从原子结构上分析碳常温下化学性质不活泼
碳原子最外层电子数为4,不易得失电子
5.CO与CO2化学性质不同根本原因
分子结构不同
6.Na与Mg化学性质不同根本原因
最外层电子数不同
8.Na与Na+化学性质不同根本原因
最外层电子数不同
【结构与性质】
1.碳在氧气中燃烧生成CO或CO2:
反应物相同,反应物的量不同,生成物不同
2.CO2与H2O反应生成碳酸或葡萄糖:
反应物相同,反应条件不同,生成物不同
3.硫在氧气和空气中燃烧现象不同:
反应物的浓度不同
4.木炭块和木炭粉在等浓度氧气中燃烧剧烈程度不同
反应物与氧气的接触面积不同
【反应中的不同】
二氧化碳的制取
1)反应原理
2)装置图
3)收集方法
4)检验方法
二氧化碳实验室制取
向上排空气法
将气体通入澄清石灰水或向集气瓶倒入少量澄清石灰水,澄清石灰水变浑浊。
CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2↑
5)验满方法
点燃的木条放在瓶口,若木条熄灭,则已收集满二氧化碳,因为二氧化碳不支持燃烧。
工业上制取二氧化碳—煅烧石灰石
红棕色NO2
木炭(或活性炭)
现象:
红棕色逐渐消失,
倒扣的漏斗内水面上升
原因:
NO2气体被木炭(或活性炭)吸附
瓶内气压减小
【探究吸附作用】
(1)通过对上表的比较,你发现的问题如下:
①实验一和实验二相比:_________________________________________________,
②实验二和实验三相比:________________________________________________,
(2)通过实验,你得出的结论是_____________________________________
。
为什么都是活性炭,实验二红色消失而实验一红色变浅
为什么等质量的木炭和活性炭,实验二红色消失而实验三红色变浅
活性炭的吸附作用比木炭强(或接触面积越大,吸附作用越强)
【探究吸附作用】
实验序号
添加物质及质量
实验现象
实验一
1
g活性炭
溶液的红色变浅
实验二
2
g活性炭
溶液的红色消失
实验三
2
g木炭
溶液的红色变浅
紫色——红色
红色——紫色
【探究CO2性质】
【探究CO2性质】
现象:
干燥的紫色石蕊试纸不变色
湿润的紫色石蕊试纸变红色
结论:
二氧化碳能与水反应
现象:
下面的紫色石蕊试纸先变红色
上面的紫色石蕊试纸后变红色
结论:
二氧化碳的密度比空气大
二氧化碳能与水反应
【探究CO2性质】
将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,
现象:
①试管内液面上升
②试管内溶液变红
结论:
二氧化碳能与水反应
充满CO2
滴入紫色
石蕊的水
【探究CO2性质】
右图①④为用紫色石蕊溶液润湿的棉球,②③为用石蕊溶液染成紫色的干燥棉球.
现象:
④比①先变红,
②、③不变红
结论:
二氧化碳密度大于空气
二氧化碳能与水反应
【探究CO2性质】
小彭同学设计了如图装置并验证二氧化碳的性质,当通入二氧化碳一段时间后,
F中的现象:
G中澄清石灰水变
浑浊,反应的化学
方程式
:
H中观察到蜡烛由低到高依次熄灭,说明
紫色石蕊溶液变红色
Ca(OH)2+CO2═CaCO3↓+H2O
二氧化碳的密度比空气大,不能燃烧,不支持燃烧
【探究CO2性质】
F
G
H
二氧化碳溶于水后的溶液中含有:
。
【实验目的】
为了探究二氧化碳与水反应后的溶液中哪种物质使紫色石蕊变红色。
【提出问题】
什么物质使紫色石蕊变红的呢?
【猜想与假设】
猜想1.二氧化碳使紫色石蕊变红
猜想2.水使紫色石蕊变红
猜想3.碳酸使紫色石蕊变红
CO2、H2O、H2CO3
【物质探究】
—四朵纸花
Ⅰ中小花变红色,探究酸能使紫色石蕊变红
Ⅱ中小花不变红,探究水不能使紫色石蕊变红
Ⅲ中小花不变红色,探究二氧化碳不能使紫色石蕊变红
Ⅳ中小花变红色,探究碳酸使紫色石蕊变红
Ⅴ中小花由红色变为紫色,探究碳酸不稳定,受热易分解
现象及目的
Ⅰ
石蕊和某些酸的反应
Ⅲ
直接放入CO2中
Ⅱ
喷水
Ⅳ
喷水后
放入CO2中
【设计并实验】
Ⅴ用吹风机给变红色的小花加热
结论:猜想
正确。
3
【反思与评价】
(1)步骤Ⅱ有没有必要做?为什么?
没有必要做。因为第Ⅳ已经做了对比试验
(2)如果要证明稀醋酸中水不能使紫色石蕊变红色操作顺序调整为:
。
Ⅱ、Ⅰ、Ⅲ、Ⅳ
Ⅰ
石蕊和某些酸的反应
Ⅲ
直接放入CO2中
Ⅱ
喷水
Ⅳ
喷水后
放入CO2中
【气体净化】
1.净化气体:
先除去气体杂质,再干燥(浓硫酸)
2.CO2(HCl和H2O)
依次通过(1)饱和NaHCO3溶液
(2)浓硫酸
3.O2(H2O)
通过浓硫酸
专题归纳
【物质推断】
1.黑色固体:
木炭(C)、CuO、MnO2、Fe3O4、铁粉
2.红色固体:
氧化铁(Fe2O3)、铜(Cu)
3.
白色固体:
氯化钾(KCl)氯酸钾(KClO3)
氧化镁(MgO)五氧化二磷(P2O5)
碳酸钙(CaCO3)
(1)若A为单质,B、C为
化合物,且组成元素相同,
则:A
;B
;C
.
(2)若C为单质,A、B为
化合物,且组成元素相同,
则:A
;B
;C
.
【物质推断】
【物质推断】
4、三角关系
碳三角
氧三角
钙三角
1.有A、B、C、D四种单质,通常情况下,A、D是无色气
体,B是红色金属,C是黑色粉末。现在进行下列实验:
①在D中加热B,生成一种黑色固体E;
②C与黑色固体E混合加热后,得到B和一种无色气体;
③向①的黑色固体E通入气体A并加热,得到B和水。
据以上实验,试推断这四种单质的化学式
A:___
B:___
C:___
D:___
E:
——
【物质推断】
Cu
CuO
O2
C
H2
(1)若A为常见黑色固体,B为红色固体,
则乙为
。
CO2
【物质推断】
(1)若乙为无色液体,B为红色固体,
则A为
。
H2
1、检验气体方法
(1)检验氧气方法
带火星木条
(2)检验二氧化碳方法
澄清石灰水
(3)检验氢气方法
点燃,验证产物为水
(4)检验一氧化碳方法
点燃,验证产物为二氧化碳
(5)检验甲烷(CH4)方法
点燃,验证产物为二氧化碳和水
【物质鉴别】
2、鉴别CO和CO2
(1)用燃着木条;
(2)通过灼热氧化铜;
(3)通过澄清石灰水;
(4)通过紫色石蕊溶液
【物质鉴别】
例题:一种无色气体X与灼热的木炭反应,
得到另一种气体Y,Y气体与灼热的氧化铜
反应又得到X气体,则X、Y分别是(
)
A、CO2、O2 B、CO2、CO
C、CO、CO2
D、O2、CO
【物质鉴别】
B
1.CO(CO2)
2.CO2(CO)
3.CO2(O2)
4.Cu(CuO)
5.CuO(Cu)
【物质除杂】
通过澄清石灰水
通过灼热的氧化铜
通过灼热的铜网
通入一氧化碳
通过氧气流加热
例题:要除去二氧化碳气体中混有的少量一氧化碳气体,应采用的方法是(
)
A、将混合气体通过澄清的石灰水
B、将混合气体从一个容器倒入另一个容器
C、将混合气体通过灼热的氧化铜粉末
D、将混合气体点燃
【物质除杂】
C
例题、欲除去CO中混有的少量CO2,其措施是( )
A、点燃
B、通入灼热的氧化铜
C、通往石灰水
D、通入石蕊试液
例题、在CO中混有的少量CO2和水蒸气,要得到纯净的CO,可将混合气体依次通过( )
A、灼热的氧化铜、浓H2SO4
B、浓H2SO4、灼热的氧化铜
C、浓H2SO4、NaOH溶液
D、NaOH溶液、浓H2SO4
D
D
【三种还原剂】
C(固体单质)、
CO(氧化物)、H2(气体单质)
例题、由碳和氧两种元素组成的气体,碳与氧两种元素的质量比为3∶5,该气体( )
A、一氧化碳或二氧化碳的纯净物
B、一氧化碳和二氧化碳的混合物
C、一氧化碳与氧气的混合物
D、二氧化碳与氧气的混合物
结论:
例题、相同质量的CO和CO2中,碳元素的质量比是( )
A、7∶11
B、11∶7
C、1∶1
D、14∶11
如图是实验室制取气体的一些常用装置,请根据装置图回答下列问题
(1)A、B装置连接,B中蜡烛发出明亮的火焰,则A装置中发生反应的化学方程式是
;B装置烧杯中可以观察到的现象是
。若观察到B中蜡烛迅速熄灭,则A装置中所需的实验药品是
。
(2)若要得到干燥的气体需将A装置导管口与C装置
(填“a”或“b”)端相连。
(3)实验结束后,将A装置中固液分离,使用D装置,其中的错误操作有
(写出一处错误即可)。过滤后发现烧杯中的滤液仍然浑浊,可能的原因是
。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
