江苏省南通市2019-2020学年高二下学期期末调研测试化学试题(A卷) Word版含答案
文档属性
| 名称 | 江苏省南通市2019-2020学年高二下学期期末调研测试化学试题(A卷) Word版含答案 |  | |
| 格式 | docx | ||
| 文件大小 | 1007.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-01 11:02:21 | ||
图片预览



文档简介
11887200113157002020年南通市高二年级调研测试
化学(A卷)
注意事项
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共6 页,包含选择题(第1 题~第 15 题, 共40分、) 非选择题(第16题~第20题, 共60分) 两部分。本次考试满分为100 分, 考试时间为 90 分钟。 考试结束后, 请将答题纸交回。
2.答题前,请您务必将自己的姓名、 学校、考位号、 考试号等用书写黑色字迹的0.5 毫米签字笔填写在答题纸上。
3.请认真核对答题纸表头规定填写或填涂的项目是否准确。
4.作答选择题必须用2B 铅笔把答题卡上对应题目的答案标号涂黑。如需改动,请用橡皮擦干净后, 再选涂且他答案。作答非选择题必须用书写黑色字的迹0.5 毫米签字笔写在答题纸上指定位置,在其他位置作答一律无效。
可能用到的相对原子质量: H 1 C 12 N 14 O16
选择题
单项选择题: 本题包括10小题,每 小题2分,共计20分。每小题只有一个选项符合题意。
1.2020 年 7 月 1 日, 世界首座跨度超千米的公铁两用斜拉桥--沪苏通长江公铁大桥胜利开通。大桥的开通为长三角一体化发展国家战略奠定了坚实的基础。下列有关大桥设施的说法不正确的是
A. 桥上层公路铺设的沥青主要成分为焦炭
B. 桥下层铁路铺设的钢轨是一种铁合金
C. 桥栏杆涂油漆兼具美观和防止金属生锈的功能
D. 桥索上的彩色灯光与原子核外电子的跃迁有关
2.下列有关化学用语表示正确的是
A. 羟基的电子式:
B.聚丙烯的结构简式:
C. 氨基乙酸的分子式: C2H5NO2
D. 乙酸的球棍模型:
3.下列关于物质分类的说法正确的是
A. 烧碱和纯碱均属于碱
.B.水煤气和天然气均属于纯净物
C. 裂化汽油和直馏汽油均属于烃类
D. 和均属于酚
4.下列有关物质性质与用途具有对应关系的是
A. 油脂难溶于水,可用于工业生产肥皂
B. 硫酸钠能使蛋白质盐析,可用于分离蛋白质 .
C. 甲醛能发生银镜反应,可用于浸制生物标本
D. 纤维素能水解得到葡萄糖,可用于制醋酸纤维
5.25℃时,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液:Na+、K+、HCO3-、SO42-
B.使酚酞变红色的溶液:NH4+、Ca2+、NO3-、SO42-
C.0.1mol·L-1 K2CO3溶液:H+、Ba2+、NO3-、Cl-、
D. 0.1mol·L-1FeCl3溶液:Na+、Cu2+、SO42-、NO3-
6. 下列说法正确的是
A.0.3g 3He含有0.1mol中子
B. 0.1mol·L-1NaCl溶液中含有0.1mol Na+
C. 标准状况下, 1.12 L 水中含有 0. 1 mol H
D. 常温常压下, 2.8 g N2 中含有 01 mol π键
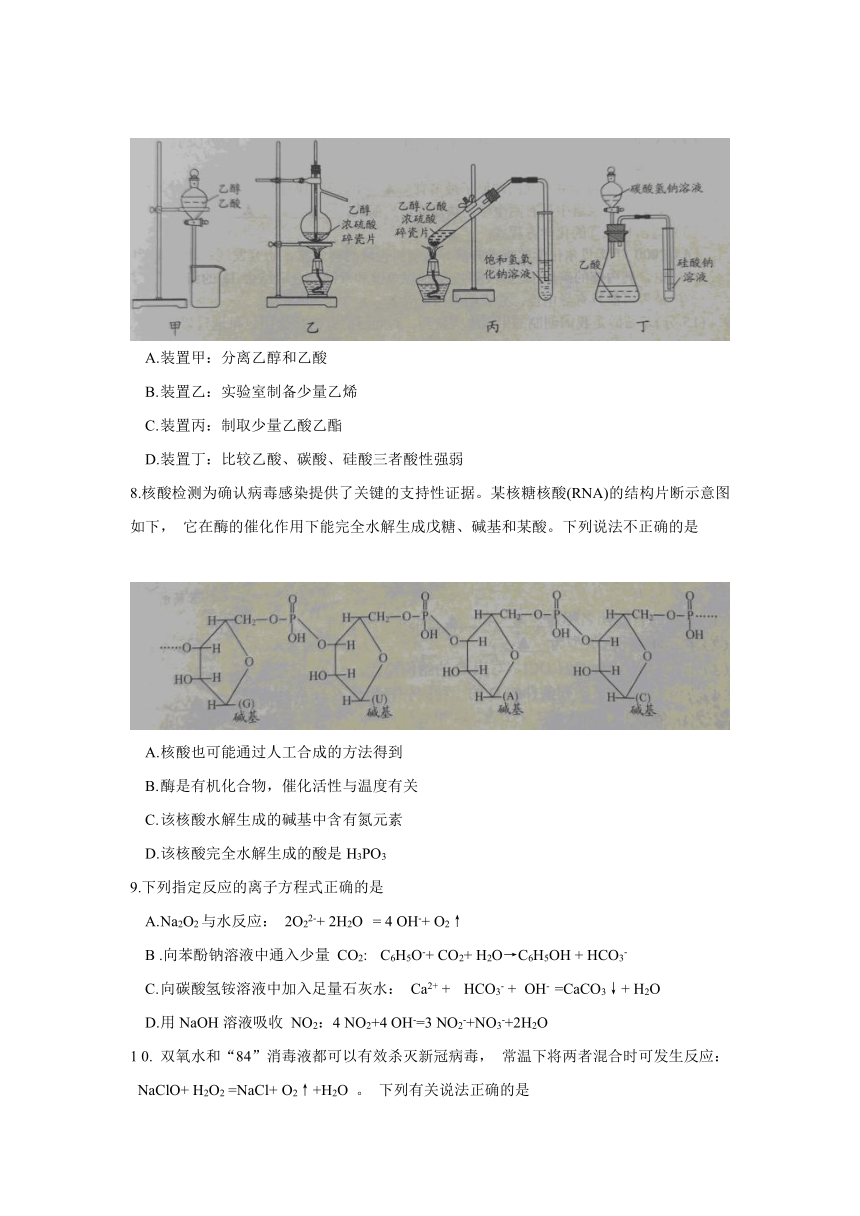
7.下列有关实验装置正确且能达到实验目的的是
A. 装置甲:分离乙醇和乙酸
B. 装置乙:实验室制备少量乙烯
C. 装置丙:制取少量乙酸乙酯
D. 装置丁:比较乙酸、碳酸、硅酸三者酸性强弱
8.核酸检测为确认病毒感染提供了关键的支持性证据。某核糖核酸(RNA)的结构片断示意图如下, 它在酶的催化作用下能完全水解生成戊糖、碱基和某酸。下列说法不正确的是
A. 核酸也可能通过人工合成的方法得到
B. 酶是有机化合物,催化活性与温度有关
C. 该核酸水解生成的碱基中含有氮元素
D. 该核酸完全水解生成的酸是H3PO3
9.下列指定反应的离子方程式正确的是
A. Na2O2与水反应: 2O22-+ 2H2O = 4 OH-+ O2↑
B .向苯酚钠溶液中通入少量 CO2: C6H5O-+ CO2+ H2O→C6H5OH + HCO3-
C. 向碳酸氢铵溶液中加入足量石灰水: Ca2+ + HCO3- + OH- =CaCO3↓+ H2O
D. 用NaOH溶液吸收 NO2:4 NO2+4 OH-=3 NO2-+NO3-+2H2O
1 0. 双氧水和“84”消毒液都可以有效杀灭新冠病毒, 常温下将两者混合时可发生反应:
NaClO+ H2O2 =NaCl+ O2↑+H2O 。 下列有关说法正确的是
A. 该反应属于置换反应
B. 常温下,H2O2 的氧化性强于 NaClO
C. H2O2在该反应中既作氧化剂又作还原剂
D. 生成1.12 L (标准状况)O2 时共转移 0.1 mol 电子
不定项选择题: 题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时, 该小题得0分; 若正确答案包括两个选项, 只选一 个且正确的得2分, 选两个且都正确的得满分, 但只要选错一个, 该小题就得0分。
11. 羟甲香豆素是一种治疗胆结石的药物,下列有关羟甲香豆素的叙述正确的是
A. 在一定条件下羟甲香豆素能与甲醛发生缩聚反应
B. 羟甲香豆素可以发生加成、取代、消去、氧化等反应
C. 1 mol 羟甲香豆素与足量 NaOH 溶液反应, 最多消耗 2 mol NaOH
D. 羟甲香豆素与足量溴水反应后, 生成的每个有机物分子中含 2 个手性碳原子
12. 下列实验方案能达到实验目的的是
A. 将酸性 KMnO4溶液分别滴入 和中, 鉴别两种有机物
B. 向苯和苯酚的混合液中加入足量溴水, 除去苯中混有的少量苯酚
C. 用激光笔照射淀粉水溶液, 检验其是否形成胶体
D. 将饱和食盐水滴加到电石中,制备乙炔气体
13. 根据下列实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
将Na2SO3样品溶于水, 加入硝酸酸化的Ba (NO3)2溶液, 有白色沉淀产生
Na2SO3样品中含有Na2SO4
B
向某溶液中滴加KSCN溶液, 无明显现象,再滴加氯水后,溶液变红
原溶液中含有Fe2+
C
向溴水中滴加乙醛溶液,溶液褪色
乙醛能与Br2发生加成反应
D
向苯和溴液的混合物中加入铁粉,将气体通入硝酸银溶液中,有淡黄色沉淀产生
苯与Br2发生取代反应
14.某一元醇具有如下性质:①能在加热时被 CuO氧化;②能发生消去反应得到烯烃;③生成的烯烃一定不存在顺反异构体。该一元醇可能
A. 1—丁醇 B. 2—丁醇 C. 2,2- 二甲基丙醇 D. 2-甲基-2-丙醇
15. 有机物X 可作为糖尿病人的营养补充剂。X完全燃烧只生成 CO2 和 H2O 。研究 小组为测定其组成,称取1.52g研碎的X样品,利用如图所示的装置进行实验。生成物先后通过分别装有足量高氯酸镁固体和碱石灰的U型管,被完全吸收后,U型管质量分别增加1.08g和2.2g。下列说法正确的是
A. CuO可保证样品中的碳元素完全转化为 CO2
B. 高氯酸镁的作用是吸收生成的 CO2
C. 每个有机物X 分子中含 5 个氧原子
D. 有机物X 可能是一种多羟基醛
非选择题
16. (10 分)短周期元素 A、G、M、X、Y 的原子序数依次增大, 其中元素A 的原子序数与周期序数相等, 元素G 和X 的基态原子的原子轨道上都只有 2 个未成对电子,元素 Y原子的电子层数与最外层电子数相等。元素 Z 的原子序数为 24。
( 1) Z3+ 基态核外电子排布式为 。
(2) G、M、X 中的两种元素形成的化合物, 属于非极性分子的是 (填化学式)。
(3) M、X、Y三种元素的第一电离能由大到小的顺序为 ( 填元素符号)。
MX3- 的空间构型为 (用文字描述)。
(4)M2A4分子中M 原子轨道的杂化类型为 。1 mol G2A4分子中含有 σ 键的数目为 。化合物 M2A4的沸点比化合物G2A4 的高, 主要原因是 。
( 5 ) 元素 Y 位于周期表的 区 , 它与元素 Z 形成的一种合金可用作航空发动机的轻质高温材料,其晶胞结构如图所示,该合金中 Y与 Z 的原子个数比为 。
( 6 ) 元素 Z 的氯化物的结晶水合物 ZCl3·6H2O 是配位化合物, 由于内界的配体不同而有不同的颜色。将1 mol 浅绿色的 ZCl3·6H2O晶体溶于水, 加入足量硝酸银溶液,立即生成 2 mol AgCl 沉淀。已知Z3+ 的配位数为 6, 则该浅绿色晶体中配离子的化学式为 。
17. (10 分 )糖类是维持生命活动所需能量的主要来源。淀粉在人体内代谢的过程中有麦芽糖、葡萄糖、乳酸( )等物质生成。
(1 )麦芽糖是一种二糖, 因为 1 mol 麦芽糖水解后能生成 。
(2)在酶的催化作用下, 葡萄糖在人体内代谢的最终产物是 (填化学式)。
(3)乳酸在浓硫酸、加热条件下可生成六元环酯, 写出该反应的化学方程式:
(4) 9g 葡萄糖与乳酸组成的混合物完全氧化为 CO2 和 H2O时消耗 O2 的物质的量为
。
(5) 设计检验尿液中是否含有葡萄糖的实验方案: 。(实验中须使用的试剂有:2%
的 CuSO4溶液 , 10%的 NaOH 溶液)。
18. (10 分)一种由烃A 合成高分子化合物D 的有机物转化关系如下:
A的质谱图如题 18 图 1 所示。B是一种二溴代烃,B的核磁共振氢谱如题18图2所示。C 是一种二烯烃。
题 18 图 1 题 18 图 2
(1) A的分子式为 。根据系统命名法, A 的名称是 。 反应①的反应类 型为 。
(2)C分子中可能共平面的碳原子最多有 个。写出两种与 C 互为同分异构体, 且核磁共振氢谱中只有两个峰的炔烃的结构简式: 、 。
( 3 ) 写出反应②的化学方程式: 。
(4) 2000年诺贝尔化学奖授予开辟导电塑料领域的科学家。研究发现:聚合物要能够导 电, 其内部的碳原子之间必须交替地以单键和双键结合。结合 D 的结构简式判断D
是否可能具有导电性, 并说明理由 : 。
19. ( 15 分)苯芴醇是我国创制的甲氟喹类新药, 对间日疟有治疗作用, 可通过以下方法合成:
(1) E中的官能团名称为 和 。
(2)C→D的反应类型为 。
(3) G 的分子式为 C7H5OCl, 写出G 的结构简式: 。
( 4 ) 写出同时满足下列条件的D 的一种同分异构体 X 的结构简式: 。
①能发生银镜反应;
②分子中含有两个苯环,每个苯环上只有一个取代基;
③分子中只有 4 种不同化学环境的氢。
(5)请写出以和ClCH2COCl为原料制备(苦杏仁酸)的合成路线图(无机试剂任用,合成路线流程图示例见本题题干)。
20. (15 分)某研究小组利用软锰矿( 主要成分 MnO2) 制备 MnSO4·H2O的流程如 下 :
已知:①“酸浸 ”后的溶液pH< 1,除含 Mn2+ 外 ,还含有少量 Fe2+、Al3+、 Ca2+等金属离子。
②下表列出相关金属离子形成氢氧化物沉淀时的 pH (开始沉淀的pH 按金属离子浓度为1.0 mol?L-1 计算):
金属离子
开始沉淀时的 pH
完全沉淀时的 pH
Fe2+
5.8
8.8
Fe3+
1.1
3.2
Al3+
3.0
5.0
Mn2+
7.3
10.3
(1)“ 酸浸”时使用的酸 X 为 , SO2的作用是 。
(2)“氧化”过程中主要反应的离子方程式是 。加入石灰浆调节溶液pH 范围是
。
(3) MnSO4可用于测定水中溶解氧的含量 , 步骤如下:
步骤1: 取 100.00mL 水样于锥形瓶中, 迅速加入足量MnSO4 溶液及碱性 KI溶液, 发生反应: 2Mn2++O2 +4OH- = 2MnO(OH)2↓, 密封静置。
步骤 2: 向锥形瓶中加入适量稀 H2SO4, MnO(OH)2与I- 完全反应生成 Mn2+和 I2后加入几滴淀粉溶液。
步骤 3: 用 5.000×10-3mol?L-1 Na2S2O3溶液进行滴定,发生反应: I2 +2 Na2S2O3= Na2S4O6+2NaI。滴定至终点时共消耗Na2S2O3 溶液16.00 mL。
①步骤 2 中 MnO(OH)2与 I- 反应的离子方程式为 。
②步骤 3 中滴定终点的实验现象为 。
③步骤l 中需迅速加入相关试剂并密封的原因是 。
④计算该水样中溶解氧的含量(用 mg?L-1 表示 )。(写出计算过程)
化学(A卷)
注意事项
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共6 页,包含选择题(第1 题~第 15 题, 共40分、) 非选择题(第16题~第20题, 共60分) 两部分。本次考试满分为100 分, 考试时间为 90 分钟。 考试结束后, 请将答题纸交回。
2.答题前,请您务必将自己的姓名、 学校、考位号、 考试号等用书写黑色字迹的0.5 毫米签字笔填写在答题纸上。
3.请认真核对答题纸表头规定填写或填涂的项目是否准确。
4.作答选择题必须用2B 铅笔把答题卡上对应题目的答案标号涂黑。如需改动,请用橡皮擦干净后, 再选涂且他答案。作答非选择题必须用书写黑色字的迹0.5 毫米签字笔写在答题纸上指定位置,在其他位置作答一律无效。
可能用到的相对原子质量: H 1 C 12 N 14 O16
选择题
单项选择题: 本题包括10小题,每 小题2分,共计20分。每小题只有一个选项符合题意。
1.2020 年 7 月 1 日, 世界首座跨度超千米的公铁两用斜拉桥--沪苏通长江公铁大桥胜利开通。大桥的开通为长三角一体化发展国家战略奠定了坚实的基础。下列有关大桥设施的说法不正确的是
A. 桥上层公路铺设的沥青主要成分为焦炭
B. 桥下层铁路铺设的钢轨是一种铁合金
C. 桥栏杆涂油漆兼具美观和防止金属生锈的功能
D. 桥索上的彩色灯光与原子核外电子的跃迁有关
2.下列有关化学用语表示正确的是
A. 羟基的电子式:
B.聚丙烯的结构简式:
C. 氨基乙酸的分子式: C2H5NO2
D. 乙酸的球棍模型:
3.下列关于物质分类的说法正确的是
A. 烧碱和纯碱均属于碱
.B.水煤气和天然气均属于纯净物
C. 裂化汽油和直馏汽油均属于烃类
D. 和均属于酚
4.下列有关物质性质与用途具有对应关系的是
A. 油脂难溶于水,可用于工业生产肥皂
B. 硫酸钠能使蛋白质盐析,可用于分离蛋白质 .
C. 甲醛能发生银镜反应,可用于浸制生物标本
D. 纤维素能水解得到葡萄糖,可用于制醋酸纤维
5.25℃时,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液:Na+、K+、HCO3-、SO42-
B.使酚酞变红色的溶液:NH4+、Ca2+、NO3-、SO42-
C.0.1mol·L-1 K2CO3溶液:H+、Ba2+、NO3-、Cl-、
D. 0.1mol·L-1FeCl3溶液:Na+、Cu2+、SO42-、NO3-
6. 下列说法正确的是
A.0.3g 3He含有0.1mol中子
B. 0.1mol·L-1NaCl溶液中含有0.1mol Na+
C. 标准状况下, 1.12 L 水中含有 0. 1 mol H
D. 常温常压下, 2.8 g N2 中含有 01 mol π键
7.下列有关实验装置正确且能达到实验目的的是
A. 装置甲:分离乙醇和乙酸
B. 装置乙:实验室制备少量乙烯
C. 装置丙:制取少量乙酸乙酯
D. 装置丁:比较乙酸、碳酸、硅酸三者酸性强弱
8.核酸检测为确认病毒感染提供了关键的支持性证据。某核糖核酸(RNA)的结构片断示意图如下, 它在酶的催化作用下能完全水解生成戊糖、碱基和某酸。下列说法不正确的是
A. 核酸也可能通过人工合成的方法得到
B. 酶是有机化合物,催化活性与温度有关
C. 该核酸水解生成的碱基中含有氮元素
D. 该核酸完全水解生成的酸是H3PO3
9.下列指定反应的离子方程式正确的是
A. Na2O2与水反应: 2O22-+ 2H2O = 4 OH-+ O2↑
B .向苯酚钠溶液中通入少量 CO2: C6H5O-+ CO2+ H2O→C6H5OH + HCO3-
C. 向碳酸氢铵溶液中加入足量石灰水: Ca2+ + HCO3- + OH- =CaCO3↓+ H2O
D. 用NaOH溶液吸收 NO2:4 NO2+4 OH-=3 NO2-+NO3-+2H2O
1 0. 双氧水和“84”消毒液都可以有效杀灭新冠病毒, 常温下将两者混合时可发生反应:
NaClO+ H2O2 =NaCl+ O2↑+H2O 。 下列有关说法正确的是
A. 该反应属于置换反应
B. 常温下,H2O2 的氧化性强于 NaClO
C. H2O2在该反应中既作氧化剂又作还原剂
D. 生成1.12 L (标准状况)O2 时共转移 0.1 mol 电子
不定项选择题: 题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时, 该小题得0分; 若正确答案包括两个选项, 只选一 个且正确的得2分, 选两个且都正确的得满分, 但只要选错一个, 该小题就得0分。
11. 羟甲香豆素是一种治疗胆结石的药物,下列有关羟甲香豆素的叙述正确的是
A. 在一定条件下羟甲香豆素能与甲醛发生缩聚反应
B. 羟甲香豆素可以发生加成、取代、消去、氧化等反应
C. 1 mol 羟甲香豆素与足量 NaOH 溶液反应, 最多消耗 2 mol NaOH
D. 羟甲香豆素与足量溴水反应后, 生成的每个有机物分子中含 2 个手性碳原子
12. 下列实验方案能达到实验目的的是
A. 将酸性 KMnO4溶液分别滴入 和中, 鉴别两种有机物
B. 向苯和苯酚的混合液中加入足量溴水, 除去苯中混有的少量苯酚
C. 用激光笔照射淀粉水溶液, 检验其是否形成胶体
D. 将饱和食盐水滴加到电石中,制备乙炔气体
13. 根据下列实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
将Na2SO3样品溶于水, 加入硝酸酸化的Ba (NO3)2溶液, 有白色沉淀产生
Na2SO3样品中含有Na2SO4
B
向某溶液中滴加KSCN溶液, 无明显现象,再滴加氯水后,溶液变红
原溶液中含有Fe2+
C
向溴水中滴加乙醛溶液,溶液褪色
乙醛能与Br2发生加成反应
D
向苯和溴液的混合物中加入铁粉,将气体通入硝酸银溶液中,有淡黄色沉淀产生
苯与Br2发生取代反应
14.某一元醇具有如下性质:①能在加热时被 CuO氧化;②能发生消去反应得到烯烃;③生成的烯烃一定不存在顺反异构体。该一元醇可能
A. 1—丁醇 B. 2—丁醇 C. 2,2- 二甲基丙醇 D. 2-甲基-2-丙醇
15. 有机物X 可作为糖尿病人的营养补充剂。X完全燃烧只生成 CO2 和 H2O 。研究 小组为测定其组成,称取1.52g研碎的X样品,利用如图所示的装置进行实验。生成物先后通过分别装有足量高氯酸镁固体和碱石灰的U型管,被完全吸收后,U型管质量分别增加1.08g和2.2g。下列说法正确的是
A. CuO可保证样品中的碳元素完全转化为 CO2
B. 高氯酸镁的作用是吸收生成的 CO2
C. 每个有机物X 分子中含 5 个氧原子
D. 有机物X 可能是一种多羟基醛
非选择题
16. (10 分)短周期元素 A、G、M、X、Y 的原子序数依次增大, 其中元素A 的原子序数与周期序数相等, 元素G 和X 的基态原子的原子轨道上都只有 2 个未成对电子,元素 Y原子的电子层数与最外层电子数相等。元素 Z 的原子序数为 24。
( 1) Z3+ 基态核外电子排布式为 。
(2) G、M、X 中的两种元素形成的化合物, 属于非极性分子的是 (填化学式)。
(3) M、X、Y三种元素的第一电离能由大到小的顺序为 ( 填元素符号)。
MX3- 的空间构型为 (用文字描述)。
(4)M2A4分子中M 原子轨道的杂化类型为 。1 mol G2A4分子中含有 σ 键的数目为 。化合物 M2A4的沸点比化合物G2A4 的高, 主要原因是 。
( 5 ) 元素 Y 位于周期表的 区 , 它与元素 Z 形成的一种合金可用作航空发动机的轻质高温材料,其晶胞结构如图所示,该合金中 Y与 Z 的原子个数比为 。
( 6 ) 元素 Z 的氯化物的结晶水合物 ZCl3·6H2O 是配位化合物, 由于内界的配体不同而有不同的颜色。将1 mol 浅绿色的 ZCl3·6H2O晶体溶于水, 加入足量硝酸银溶液,立即生成 2 mol AgCl 沉淀。已知Z3+ 的配位数为 6, 则该浅绿色晶体中配离子的化学式为 。
17. (10 分 )糖类是维持生命活动所需能量的主要来源。淀粉在人体内代谢的过程中有麦芽糖、葡萄糖、乳酸( )等物质生成。
(1 )麦芽糖是一种二糖, 因为 1 mol 麦芽糖水解后能生成 。
(2)在酶的催化作用下, 葡萄糖在人体内代谢的最终产物是 (填化学式)。
(3)乳酸在浓硫酸、加热条件下可生成六元环酯, 写出该反应的化学方程式:
(4) 9g 葡萄糖与乳酸组成的混合物完全氧化为 CO2 和 H2O时消耗 O2 的物质的量为
。
(5) 设计检验尿液中是否含有葡萄糖的实验方案: 。(实验中须使用的试剂有:2%
的 CuSO4溶液 , 10%的 NaOH 溶液)。
18. (10 分)一种由烃A 合成高分子化合物D 的有机物转化关系如下:
A的质谱图如题 18 图 1 所示。B是一种二溴代烃,B的核磁共振氢谱如题18图2所示。C 是一种二烯烃。
题 18 图 1 题 18 图 2
(1) A的分子式为 。根据系统命名法, A 的名称是 。 反应①的反应类 型为 。
(2)C分子中可能共平面的碳原子最多有 个。写出两种与 C 互为同分异构体, 且核磁共振氢谱中只有两个峰的炔烃的结构简式: 、 。
( 3 ) 写出反应②的化学方程式: 。
(4) 2000年诺贝尔化学奖授予开辟导电塑料领域的科学家。研究发现:聚合物要能够导 电, 其内部的碳原子之间必须交替地以单键和双键结合。结合 D 的结构简式判断D
是否可能具有导电性, 并说明理由 : 。
19. ( 15 分)苯芴醇是我国创制的甲氟喹类新药, 对间日疟有治疗作用, 可通过以下方法合成:
(1) E中的官能团名称为 和 。
(2)C→D的反应类型为 。
(3) G 的分子式为 C7H5OCl, 写出G 的结构简式: 。
( 4 ) 写出同时满足下列条件的D 的一种同分异构体 X 的结构简式: 。
①能发生银镜反应;
②分子中含有两个苯环,每个苯环上只有一个取代基;
③分子中只有 4 种不同化学环境的氢。
(5)请写出以和ClCH2COCl为原料制备(苦杏仁酸)的合成路线图(无机试剂任用,合成路线流程图示例见本题题干)。
20. (15 分)某研究小组利用软锰矿( 主要成分 MnO2) 制备 MnSO4·H2O的流程如 下 :
已知:①“酸浸 ”后的溶液pH< 1,除含 Mn2+ 外 ,还含有少量 Fe2+、Al3+、 Ca2+等金属离子。
②下表列出相关金属离子形成氢氧化物沉淀时的 pH (开始沉淀的pH 按金属离子浓度为1.0 mol?L-1 计算):
金属离子
开始沉淀时的 pH
完全沉淀时的 pH
Fe2+
5.8
8.8
Fe3+
1.1
3.2
Al3+
3.0
5.0
Mn2+
7.3
10.3
(1)“ 酸浸”时使用的酸 X 为 , SO2的作用是 。
(2)“氧化”过程中主要反应的离子方程式是 。加入石灰浆调节溶液pH 范围是
。
(3) MnSO4可用于测定水中溶解氧的含量 , 步骤如下:
步骤1: 取 100.00mL 水样于锥形瓶中, 迅速加入足量MnSO4 溶液及碱性 KI溶液, 发生反应: 2Mn2++O2 +4OH- = 2MnO(OH)2↓, 密封静置。
步骤 2: 向锥形瓶中加入适量稀 H2SO4, MnO(OH)2与I- 完全反应生成 Mn2+和 I2后加入几滴淀粉溶液。
步骤 3: 用 5.000×10-3mol?L-1 Na2S2O3溶液进行滴定,发生反应: I2 +2 Na2S2O3= Na2S4O6+2NaI。滴定至终点时共消耗Na2S2O3 溶液16.00 mL。
①步骤 2 中 MnO(OH)2与 I- 反应的离子方程式为 。
②步骤 3 中滴定终点的实验现象为 。
③步骤l 中需迅速加入相关试剂并密封的原因是 。
④计算该水样中溶解氧的含量(用 mg?L-1 表示 )。(写出计算过程)
同课章节目录
