江苏省无锡市2019-2020学年高二下学期期终调研考试化学(选修)试题 Word版含答案
文档属性
| 名称 | 江苏省无锡市2019-2020学年高二下学期期终调研考试化学(选修)试题 Word版含答案 |  | |
| 格式 | docx | ||
| 文件大小 | 434.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-01 11:04:24 | ||
图片预览


文档简介
1195070012026900无锡市普通高中2020 年春学期高二期终调研考试试卷
化学(选修)
注意事项:
1.本试卷分选择题和非选择题两部分,共100 分。考试时间 90 分钟。
2.答案全部写在答题卡上,写在试题纸上一律无效。
3.可能用到的相对原子质量: H -1 C -12 N -14 O-16 V-51
第 I 卷(选择题 共 40 分)
一、单项选择题(本题包括10小题 ,每小题 2 分 ,共20分。每小题只有一个选项符合题意)
1 .化学在抗击新冠肺炎中起到了重要作用。下列叙述错误的是
A. 医用消毒剂使用的酒精浓度越高消毒效果越好
B. 免洗洗手液的有效成分活性银离子能使蛋白质变性
C. 传播新冠病毒的气溶胶分散质粒子直径大小在 1nm ~ 100nm之间
D. 制作口罩的熔喷布的主要原料聚丙烯( PP) 是一种有机高分子材料
2.反应 CO2+ 2 NH3 CO(NH2) 2+ H2O可应用于工业合成尿素。 下列表示反应中相关微粒的化学用语正确的是
A. 中子数为 8 的碳原子:falseC
B. NH3的电子式:
C. 氧原子的结构示意图:
D. CO2的比例模型 :
3.下列有关物质的性质与用途具有对应关系的是
A. NH3具有还原性,可用作制冷剂
B. HClO溶液显酸性,可用于杀菌消毒
C. 浓硫酸具有吸水性,可用作干燥剂
D. Al2O3具有两性,可用作耐高温材料
4.室温下,下列各组离子在指定溶液中能大量共存的是
A. 0. lmol? L-1 NaAlO2溶液 :K+ 、OH-、Cl- 、SO42-
B. 0. lmol?L-1Na HCO3溶液 :Na + 、Ba2+ 、NO3- 、OH-
C. 0. lmol? L-1 NaHSO4溶液 :Fe2+ 、Mg2+ 、NO3- 、Cl-
D. 0. lmol? L-1 NaClO 溶液 :K+ 、SO32- 、S2-、Cl-
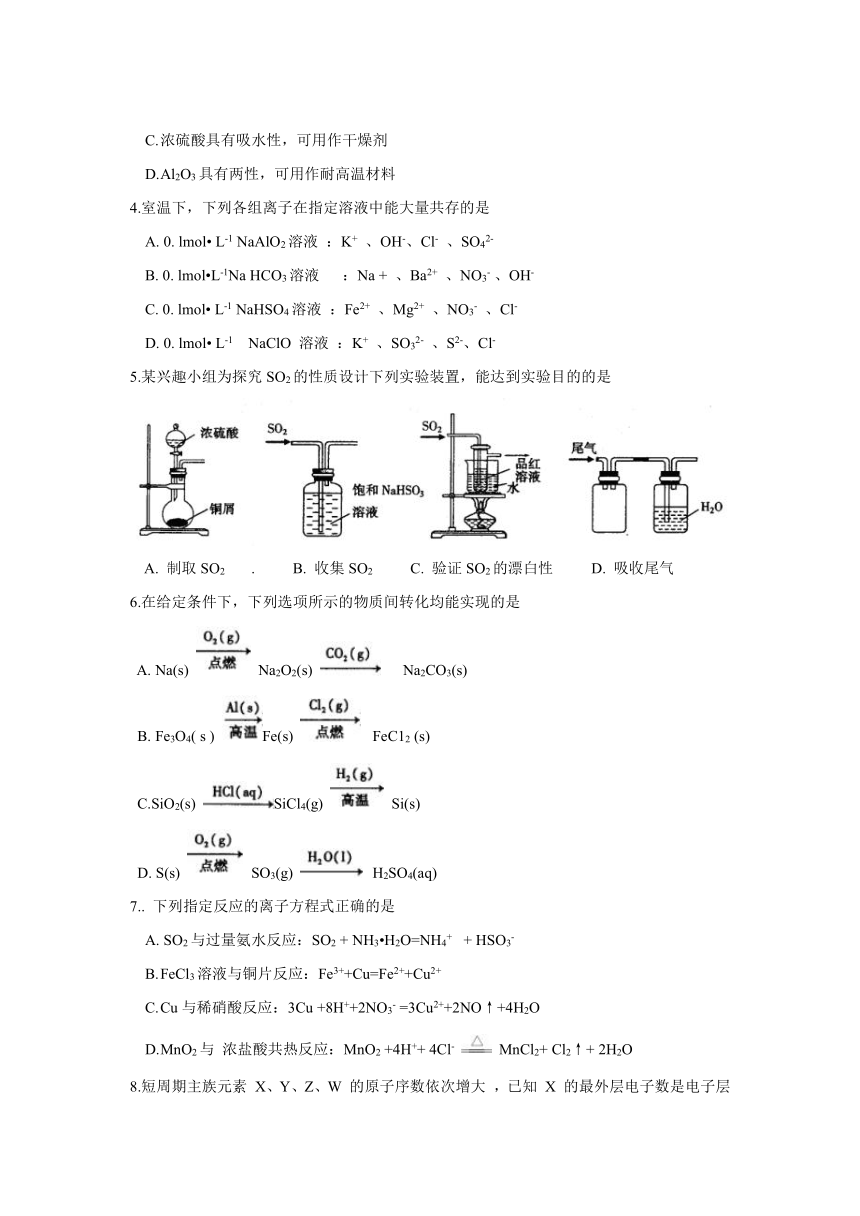
5.某兴趣小组为探究SO2的性质设计下列实验装置,能达到实验目的的是
A. 制取SO2 . B. 收集SO2 C. 验证SO2的漂白性 D. 吸收尾气
6.在给定条件下,下列选项所示的物质间转化均能实现的是
A. Na(s) Na2O2(s) Na2CO3(s)
B. Fe3O4( s ) Fe(s) FeC12 (s)
C.SiO2(s) SiCl4(g) Si(s)
D. S(s) SO3(g) H2SO4(aq)
7.. 下列指定反应的离子方程式正确的是
A. SO2 与过量氨水反应:SO2 + NH3?H2O=NH4+ + HSO3-
B. FeCl3溶液与铜片反应:Fe3++Cu=Fe2++Cu2+
C. Cu与稀硝酸反应:3Cu +8H++2NO3- =3Cu2++2NO↑+4H2O
D. MnO2与 浓盐酸共热反应:MnO2 +4H++ 4Cl- MnCl2+ Cl2↑+ 2H2O
8.短周期主族元素 X、Y、Z、W 的原子序数依次增大 ,已知 X 的最外层电子数是电子层数的 3 倍,X、W 同主族 ,Y 的原子半径在短周期主族元素中最大,Z 的最高化合价和最低化合价的代数和为零。下列说法正确的是
A. 由 X、Z 组成的化合物是离子化合物
B. X、Y 的简单离子半径:r(X2-) > r(Y+)
C. W 的简单气态氢化物的热稳定性比 X 的强
D. Z 的最高价氧化物对应水化物的酸性比W 的强
9.镉 ( Ni—Cd) 可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为 KOH 溶液,电池总反应为:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2。
下列有关说法正确的是
A. 放电时负极附近溶液的碱性不变
B. 充电过程是化学能转化为电能的过程
C. 放电时电解质溶液中的 OH- 向正极移动
D. 充电时阳极反应: Ni(OH)2 -e- +OH-=NiOOH +H2O
10. 以 TiO2为催化剂的光热化学循环分解 CO2反应为温室气体减排提供了一个新途径 ,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。下列说法正确的是
A. 过程①中钛氧键断裂会释放能量
B. 该反应中,光能和热能转化为化学能
C. 使用TiO2 作催化剂可以降低反应的焓变 ,从而提高化学反应速率
D. CO2 分解反应的热化学方程式为2 CO2( g)=2CO(g) +O2(g) ΔH= + 30kJ ? mol-1
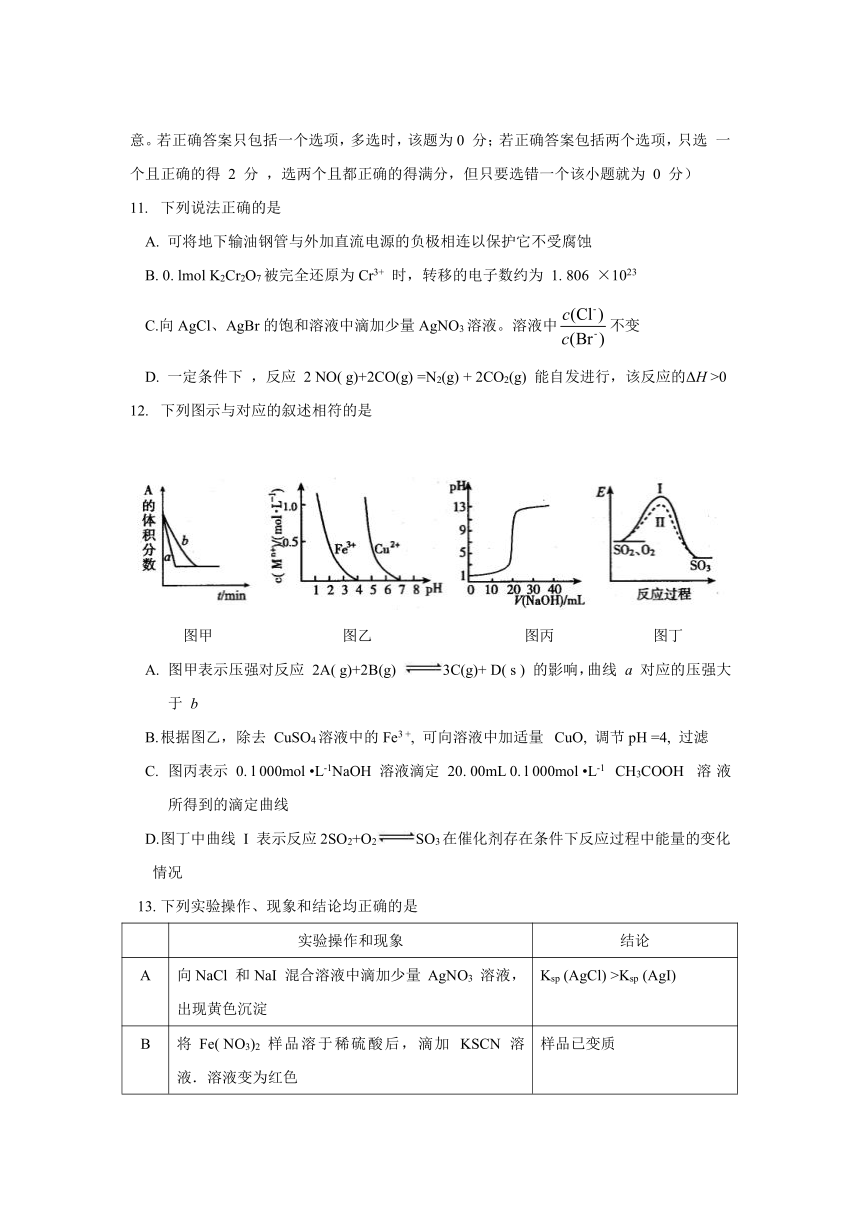
不定项选择题(本题包括 5 小题,每题 4 分,共20 分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0 分;若正确答案包括两个选项,只选 一 个且正确的得 2 分 ,选两个且都正确的得满分,但只要选错一个该小题就为 0 分)
11. 下列说法正确的是
A. 可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀
B. 0. lmol K2Cr2O7被完全还原为Cr3+ 时,转移的电子数约为 1. 806 ×1023
C.向AgCl、AgBr的饱和溶液中滴加少量AgNO3溶液。溶液中false不变
D. 一定条件下 ,反应 2 NO( g)+2CO(g) =N2(g) + 2CO2(g) 能自发进行,该反应的ΔH >0
12. 下列图示与对应的叙述相符的是
图甲 图乙 图丙 图丁
A. 图甲表示压强对反应 2A( g)+2B(g) 3C(g)+ D( s ) 的影响,曲线 a 对应的压强大于 b
B. 根据图乙,除去 CuSO4溶液中的Fe3 +, 可向溶液中加适量 CuO, 调节pH =4, 过滤
C. 图丙表示 0. l 000mol ?L-1NaOH 溶液滴定 20. 00mL 0. l 000mol ?L-1 CH3COOH 溶液所得到的滴定曲线
D. 图丁中曲线 I 表示反应2SO2+O2SO3在催化剂存在条件下反应过程中能量的变化情况
13. 下列实验操作、现象和结论均正确的是
实验操作和现象
结论
A
向NaCl 和NaI 混合溶液中滴加少量 AgNO3 溶液,出现黄色沉淀
Ksp (AgCl) >Ksp (AgI)
B
将 Fe( NO3)2 样品溶于稀硫酸后,滴加 KSCN 溶液.溶液变为红色
样品已变质
C
向KI溶液中滴入少量新制氯水和四氯化碳,振荡、静置,溶液下层呈紫红色
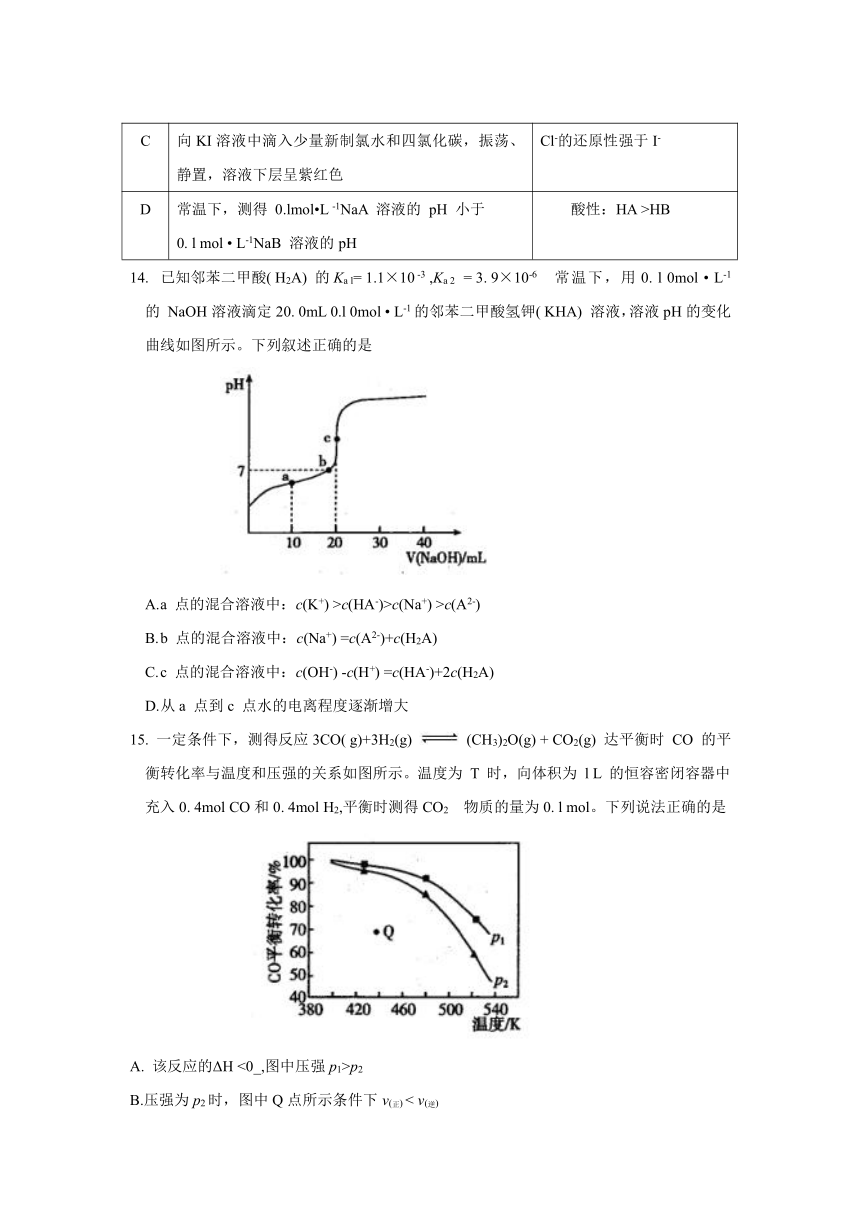
Cl-的还原性强于I-
D
常温下,测得 0.lmol?L -1NaA 溶液的 pH 小于
0. l mol ? L-1NaB 溶液的pH
酸性:HA >HB
14. 已知邻苯二甲酸( H2A) 的Ka l= 1.1×10 -3 ,Ka 2 = 3. 9×10-6 常温下,用0. l 0mol ? L-1的 NaOH溶液滴定20. 0mL 0.l 0mol ? L-1的邻苯二甲酸氢钾( KHA) 溶液,溶液pH的变化曲线如图所示。下列叙述正确的是
A. a 点的混合溶液中:c(K+) >c(HA-)>c(Na+) >c(A2-)
B. b 点的混合溶液中:c(Na+) =c(A2-)+c(H2A)
C. c 点的混合溶液中:c(OH-) -c(H+) =c(HA-)+2c(H2A)
D. 从a 点到c 点水的电离程度逐渐增大
15. 一定条件下,测得反应3CO( g)+3H2(g) (CH3)2O(g) + CO2(g) 达平衡时 CO 的平衡转化率与温度和压强的关系如图所示。温度为 T 时,向体积为 l L 的恒容密闭容器中充入0. 4mol CO和0. 4mol H2,平衡时测得CO2 物质的量为0. l mol。下列说法正确的是
A. 该反应的ΔH <0_,图中压强p1>p2
B.压强为p2时,图中Q点所示条件下v(正) < v(逆)
C. 温度为 T 时,若向体积为l L 的恒压容器中充入0. 4mol CO和 0.4mol H2,达平衡时CO的转化率大于75%
D. 温度为T 时,若向原容器中充入0. lmol CO、0. 2mol(CH3 )2 O和0. 2mol CO2,则该反应的平衡常数大于104
第 II 卷(非选择题 共 60 分)
16. ( 8 分)25°C 时 ,三种弱电解质的电离平衡常数如下表:
化学式
HCOOH
CH3COOH
NH3·H2O
电离平衡常数
1. 77 ×10-4
1. 75 ×10-5
1.76×10-5
(1) 下列方法中,可以使0. l 0mol ? L-1CH3COOH 溶液中CH3COOH 电离程度增大的是 。
a. 通入少量 HCl 气体 b. 加入少量冰醋酸
c. 加入少量醋酸钠固体 d.. 加入少量水
(2)常温下,0 . l mol ? L-1的NH3·H2O溶液加水稀释过程 ,下列表达式的数据 一 定变小的是 。
a.c(OH-) b. false c. c(H+)·c(OH-) d.. false
(3) 同浓度的①HCOONa、② CH3COONa、③CH3COONH4 ④NH4Cl 溶液的 pH 由大到小的顺序为 。
( 4 ) 用相同浓度的 NaOH 溶液分别滴定等体积 pH均为3 的 HCOOH和 CH3COOH溶液至终点,消耗 NaOH 溶液的体积分别为V1 、V2,则 V1 V2(填“ >”、“<“或”=”)。
17.(12分)硫酸铅( PbSO4) 广泛应用于制造铅蓄电池、白色颜料等。由方铅矿(主要成分为PbS, 含FeS2等杂质 )和软锰矿(主要成分为 MnO2)制备 PbSO4 的工艺流程如下:
已知:① PbCl2难溶于冷水,易溶于热水
②PbC12 (s) + 2Cl-(aq) PbCl42-(aq) ΔH >0
③Ksp(PbSO4)=1.08 ×l0-8 ,Ksp(PbCl2) =1.6× l 0-5
(1) “浸取”过程中盐酸与 MnO2、PbS 发生反应生成 PhCl2 和S 的化学方程式为
;“浸取”时加入饱和 NaCl 溶液的原因是 。
( 2 ) “调 pH”的目的是 。
( 3 ) “沉降”时加入冰水的作用是 。
( 4 ) 流程中可循环使用的物质是 。
( 5 ) 20°C 时 ,PbCl2 ( s ) 在不同浓度盐酸中的最大溶解量( g? L-1)如题17图所示。下列叙述正确的是 (填序号)。
a 盐酸浓度越小 ,Ksp(PbCl2) 越小
b.x、y 两点对应的溶液中 c( Pb2 +) 不相等
c.当盐酸浓度为 l mol ? L-1 时 ,溶液中 c( Pb2+) 一 定最小
18. (14 分)硫酸厂尾气中含有大量SO2 , 回收并综合利用SO2对环境保护有重要意义。
(1) )利用氨水吸收烟气中的SO2 可转化为( NH4)2 SO4 。 相关反应的主要热化学方程式如下:
SO2 (g) +NH3?H2O(aq)=NH4HSO3 (aq) ΔH1 = a kJ ? mol-1
NH3?H2O (aq)+ NH4HSO3 (aq)=(NH4)2SO3(aq) +H2O(l) ΔH2 =b kJ ? mol-1
2 (NH4)2SO3 (aq) + O2 (g) =2(NH4) 2SO4 (aq) ΔH3 =c kJ?mol-1
①反应2 SO2 ( g) +4 NH3?H2O (aq)+O2(g)= 2(NH4) 2SO4 (aq) + 2H2O( l ) 的
ΔH= kJ ?mol-1
②空气氧化NH4HSO3的速率随温度的变化如题 18 图 -1 所示,当温度超过 60℃ 时,
(NH4)2SO3氧化速率下降的原因可能是 。研究发现,在500℃下硫酸铵分解过程中得到4 种产物,其含氮物质随时间变化关系如题18 图- 2 所示。写出该条件下硫酸铵分解的化学方程式: 。
(2) 工业上利用SO2尾气可制备亚硫酰氯( SOCl2) 。SOCl2 是 一种发烟液体,易水解,可用于农药、医药、染料、电池等生产,其制备原理为:S(s) +2Cl2(g) +SO2(g)
2 SOCl2 ( g)。
①该反应的平衡常数表达式为 。
②用SOCl2 与 A1Cl3 ? 6 H2O混合共热,可得到无水A1Cl3, 原因是 。
( 3 ) 用电解法处理含有SO2尾气的装置如题18 图 - 3 所示(电极材料均为惰性电极)。
该装置中的离子交换膜为 离子交换膜(填“阴”或“阳”);阴极的电极反应式为 。
19. ( 14 分)二氧化氯泡腾片是一种常用的含氯消毒剂,其主要成分是亚氯酸钠( NaClO2) 。 NaClO2的制备原理为:用 SO2与NaClO3 制取 ClO2 气体,再由ClO2 在强碱性条件下与过量的 H2O2 反应制得(装置如题19 图- 1 所示)。
已知: ①NaClO2碱性溶液稳定,酸性溶液会分解
② 无水NaClO2常温稳定,有水存在时加热到130°C 分解;
③ NaClO2 饱和溶液在温度低于38°C时 析出的晶体是NaClO2?3 H2O, 高于38 °C时 析出晶体是NaClO2。
( 1) 装置C 用于制备 ClO2气体,同时生成 NaHSO4 , 写出该反应的化学方程式: 。
( 2) 将C 中产生的ClO2 通入装置D 中制备 NaClO2 , 反应温度需控制在3°C' 写出该反应的离子方程式: 。
( 3 ) 反应结束后,将 D 中混合物减压蒸发浓缩,冷却结晶可获得NaClO2 晶体。结晶时温度需保持在40 ~55°C,原因是 。
(4)保持反应时间、反应物和溶剂的用量不变,实验中提高ClO2吸收率的措施有:
(写出一种即可)。
( 5 ) 装置C 所得溶液中主要溶质为 Na2SO4和 NaHSO4 , 直接排放会污染环境且浪费资源,经处理后可获得芒硝(Na2SO4·10 H2O ) 。请补充完整由装置 C 中所得溶液制取Na2SO4·10 H2O 的实验方案: (实验中须使用的试剂和仪器有:NaOH溶液、冰水、pH计)。已知:Na2SO4 的溶解度曲线如题19图 - 2 所示。
20. ( 12 分)工业上以钒炉渣(主要含 V2O3还有少量SiO2 、P2O5等杂质)为原料可以制备氧钒碱式碳酸铵晶体[ ( NH4)a( VO ) b( CO3)c( OH)d?nH2O) , 其中V 为+ 4 价。其生产工艺流程如下:
( 1 ) “沉钒”得到偏钒酸铵( NH4VO3),若滤液中 c( VO3-)=0.l mol ?L-1为使钒元素的沉降率达到98% , 至少应调节c( NH4+)为 mol? L-1。
已知:Ksp(NH4VO3 )=1.6 ×10-3。
( 2 ) “还原”V2O5过程中,生成VOCl2 和一种无色无污染的气体,该反应的化学方程为式
。
用浓盐酸与V2O5 反应也可以制得VOC12, 该方法的缺点是 。
(3 ) 为测定氧钒碱式碳酸铵样品的组成,进行下列实验:
①准确称量1. 0650g 产品于锥形瓶中,用20 mL 蒸馏水与30mL 稀硫酸溶解后,加水稀释至100. 00mL得到溶液 A。将溶解过程产生的气体全部通入足量澄清石灰水,生成白色沉淀0. 4000g。
②准确量取20. 00mL溶液 A, 加足量的 NaOH 溶液并充分加热,生成 NH3 22.4 mL( 标准状况)。
③ 准确量取20. 00mL 溶液A, 加入0. l000mol?L-1 KMnO4溶液将VO2+ 恰好氧化成VO2+ , 然后用 0. l000mol? L-1( NH4) 2Fe(SO4)2 标准溶液滴定至终点,消耗标准溶液的体积为12. 00mL。已知滴定反应为:VO2+ +Fe2+ +2H+ = VO2+ +Fe3+ + H2O。
通过计算确定该氧钒碱式碳酸铵晶体样品的化学式(写出计算过程)。
无锡市普通高中2020 年春学期高二期终调研考试试卷
化学(选修)参考答案及评分标准
第 I卷(选择题 共 40 分)
单项选择题: 本题包括10 小题, 每小题 2 分, 共 20 分。
1. A 2. D 3. C 4. A 5. C 6. A 7. C 8. B 9. D 10. B
不定项选择题: 本题包括 5 小题,每小题 4 分,共 20 分。
11. AC 12. B 13. D 14. CD 15. AC
第 II 卷(非选择题 共 60 分)
16. ( 每空 2 分, 共 8 分)
(1) d
(2) a
(3) ②①③④
(4) <
17. ( 每空 2 分, 共 12 分)
(1) MnO2 +PbS+4HCl=PbCl2 + MnCl2 +S + 2H2O
( PbCl2 难溶于水, 容易覆盖在方铅矿表面, 减慢反应速率,)加入 NaCl 增大c(Cl-, )
有利于PbC12(s) +2Cl-(aq ) PbCl42-(a q )平衡正移, 将PbCl2(s )转化为PbCl42- (其它答案合理均给分)
( 2 ) 使 Fe3+ 沉淀成 Fe(OH)3 而除去
( 3 ) 降低PbCl2的溶解度; ( 1 分)使 PbC12(s) +2Cl-(aq ) PbCl42-(a q ) 平衡逆向移动,有利于PbCl2晶体而析出 ( I 分)
( 4 ) 盐酸(或 HCl) .
(5) b
18. ( 每空2分, 共14分)
(1) ①2a+2b+c
②温度过高(NH4)2SO3会分解(或水解), 浓度减小(或温度升高O2在溶液中溶解度降
低) 3 (NH4)2SO4 N2↑+4NH3↑+3SO2↑+6H2O↑
(2) ① K=
②SOCl2 水解产生 HCl, 抑制 Al3+的水解
( 3 ) 阳 2HSO3-+2e-+2H+ = S2O42-+2H2O
19. ( 1~4 小题每空 2 分每空 2 分, 共 14 分)
(l) 2NaClO3 + SO2 +H2SO4=2ClO2 +2NaHSO4
(2) 2ClO2+H2O2 + 2OH-= 2ClO2-+ O2 +2H2O
(3) 温度过高 NaClO2 会分解,温度过低晶体以 NaClO2?3H2O析出
(4) 缓慢滴加硫酸(搅拌、冰水浴均可)
(5) 向装置 C 所得溶液中滴加 NaOH 溶液, ( 1 分)边滴加边用 pH 计测溶液的 p,H 至溶液 pH=7 时停止滴加 NaOH 溶液,(1 分)将溶液蒸发浓缩, 冷却至 32.4°C以下结晶, ( 1 分)过滤, ( 1 分)用冰水洗涤晶体 2~3次, ( 1 分)低温烘干得到芒硝。(1 分)
20. ( 共 12 分)
(1) 0.8 ( 2 分)
(2) N2H4?2HCl +2V2O5+6HCl= 4VOCl2 +N2 ↑+ 6 H2O ( 2 分 )有氯气生成, 污染空气( 2 分)
(3) n(CO32-)=n(CaCO3)= =4.000×10-3mol
n (NH4+ )=n(NH3)= × = 5.000× 10一3mol
n(VO2+)=n(VO2+)
=n(Fe2+)= 0. 1000 mol?L-1×12.00 mL×10-3 L?mL-1 ×
=6.000×10-3mol ( 1 分)
n(OH-)=n(NH4+ )+ 2n(VO2+ ) 一2n(CO32-)
=5.000×l0-3 mol+2×6.000×10-3 mol-2×4.000×10-3 mol
=9.000× l 0-3mol (1 分)
m(CO32-)= 60 g?mol-1 ×4. 000× 10-3mol=0. 2400 g
m(NH4+)= 18 g?mo1-1 ×5. 000×10-3mol=0. 09000 g
m(VO2+)= 67 g?mo1-1 ×6.000×10-3 mol=0. 4020 g
m(OH-)= 17 g?mo1-1×9. 000×10-3mol=0. 1530 g
n(H2O)= =1. 000×10-2 mol ( 1分)
a :b :c:d :n= n(NH4+):n(VO2+ ): n(CO32-):n(OH-):n(H2O)= 5:6:4:9:10
氧钒碱式碳酸铵晶体样品的化学式为(NH4)5(VO )6(CO3)4(O H)9?l0H2O ( 1 分)
化学(选修)
注意事项:
1.本试卷分选择题和非选择题两部分,共100 分。考试时间 90 分钟。
2.答案全部写在答题卡上,写在试题纸上一律无效。
3.可能用到的相对原子质量: H -1 C -12 N -14 O-16 V-51
第 I 卷(选择题 共 40 分)
一、单项选择题(本题包括10小题 ,每小题 2 分 ,共20分。每小题只有一个选项符合题意)
1 .化学在抗击新冠肺炎中起到了重要作用。下列叙述错误的是
A. 医用消毒剂使用的酒精浓度越高消毒效果越好
B. 免洗洗手液的有效成分活性银离子能使蛋白质变性
C. 传播新冠病毒的气溶胶分散质粒子直径大小在 1nm ~ 100nm之间
D. 制作口罩的熔喷布的主要原料聚丙烯( PP) 是一种有机高分子材料
2.反应 CO2+ 2 NH3 CO(NH2) 2+ H2O可应用于工业合成尿素。 下列表示反应中相关微粒的化学用语正确的是
A. 中子数为 8 的碳原子:falseC
B. NH3的电子式:
C. 氧原子的结构示意图:
D. CO2的比例模型 :
3.下列有关物质的性质与用途具有对应关系的是
A. NH3具有还原性,可用作制冷剂
B. HClO溶液显酸性,可用于杀菌消毒
C. 浓硫酸具有吸水性,可用作干燥剂
D. Al2O3具有两性,可用作耐高温材料
4.室温下,下列各组离子在指定溶液中能大量共存的是
A. 0. lmol? L-1 NaAlO2溶液 :K+ 、OH-、Cl- 、SO42-
B. 0. lmol?L-1Na HCO3溶液 :Na + 、Ba2+ 、NO3- 、OH-
C. 0. lmol? L-1 NaHSO4溶液 :Fe2+ 、Mg2+ 、NO3- 、Cl-
D. 0. lmol? L-1 NaClO 溶液 :K+ 、SO32- 、S2-、Cl-
5.某兴趣小组为探究SO2的性质设计下列实验装置,能达到实验目的的是
A. 制取SO2 . B. 收集SO2 C. 验证SO2的漂白性 D. 吸收尾气
6.在给定条件下,下列选项所示的物质间转化均能实现的是
A. Na(s) Na2O2(s) Na2CO3(s)
B. Fe3O4( s ) Fe(s) FeC12 (s)
C.SiO2(s) SiCl4(g) Si(s)
D. S(s) SO3(g) H2SO4(aq)
7.. 下列指定反应的离子方程式正确的是
A. SO2 与过量氨水反应:SO2 + NH3?H2O=NH4+ + HSO3-
B. FeCl3溶液与铜片反应:Fe3++Cu=Fe2++Cu2+
C. Cu与稀硝酸反应:3Cu +8H++2NO3- =3Cu2++2NO↑+4H2O
D. MnO2与 浓盐酸共热反应:MnO2 +4H++ 4Cl- MnCl2+ Cl2↑+ 2H2O
8.短周期主族元素 X、Y、Z、W 的原子序数依次增大 ,已知 X 的最外层电子数是电子层数的 3 倍,X、W 同主族 ,Y 的原子半径在短周期主族元素中最大,Z 的最高化合价和最低化合价的代数和为零。下列说法正确的是
A. 由 X、Z 组成的化合物是离子化合物
B. X、Y 的简单离子半径:r(X2-) > r(Y+)
C. W 的简单气态氢化物的热稳定性比 X 的强
D. Z 的最高价氧化物对应水化物的酸性比W 的强
9.镉 ( Ni—Cd) 可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为 KOH 溶液,电池总反应为:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2。
下列有关说法正确的是
A. 放电时负极附近溶液的碱性不变
B. 充电过程是化学能转化为电能的过程
C. 放电时电解质溶液中的 OH- 向正极移动
D. 充电时阳极反应: Ni(OH)2 -e- +OH-=NiOOH +H2O
10. 以 TiO2为催化剂的光热化学循环分解 CO2反应为温室气体减排提供了一个新途径 ,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。下列说法正确的是
A. 过程①中钛氧键断裂会释放能量
B. 该反应中,光能和热能转化为化学能
C. 使用TiO2 作催化剂可以降低反应的焓变 ,从而提高化学反应速率
D. CO2 分解反应的热化学方程式为2 CO2( g)=2CO(g) +O2(g) ΔH= + 30kJ ? mol-1
不定项选择题(本题包括 5 小题,每题 4 分,共20 分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0 分;若正确答案包括两个选项,只选 一 个且正确的得 2 分 ,选两个且都正确的得满分,但只要选错一个该小题就为 0 分)
11. 下列说法正确的是
A. 可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀
B. 0. lmol K2Cr2O7被完全还原为Cr3+ 时,转移的电子数约为 1. 806 ×1023
C.向AgCl、AgBr的饱和溶液中滴加少量AgNO3溶液。溶液中false不变
D. 一定条件下 ,反应 2 NO( g)+2CO(g) =N2(g) + 2CO2(g) 能自发进行,该反应的ΔH >0
12. 下列图示与对应的叙述相符的是
图甲 图乙 图丙 图丁
A. 图甲表示压强对反应 2A( g)+2B(g) 3C(g)+ D( s ) 的影响,曲线 a 对应的压强大于 b
B. 根据图乙,除去 CuSO4溶液中的Fe3 +, 可向溶液中加适量 CuO, 调节pH =4, 过滤
C. 图丙表示 0. l 000mol ?L-1NaOH 溶液滴定 20. 00mL 0. l 000mol ?L-1 CH3COOH 溶液所得到的滴定曲线
D. 图丁中曲线 I 表示反应2SO2+O2SO3在催化剂存在条件下反应过程中能量的变化情况
13. 下列实验操作、现象和结论均正确的是
实验操作和现象
结论
A
向NaCl 和NaI 混合溶液中滴加少量 AgNO3 溶液,出现黄色沉淀
Ksp (AgCl) >Ksp (AgI)
B
将 Fe( NO3)2 样品溶于稀硫酸后,滴加 KSCN 溶液.溶液变为红色
样品已变质
C
向KI溶液中滴入少量新制氯水和四氯化碳,振荡、静置,溶液下层呈紫红色
Cl-的还原性强于I-
D
常温下,测得 0.lmol?L -1NaA 溶液的 pH 小于
0. l mol ? L-1NaB 溶液的pH
酸性:HA >HB
14. 已知邻苯二甲酸( H2A) 的Ka l= 1.1×10 -3 ,Ka 2 = 3. 9×10-6 常温下,用0. l 0mol ? L-1的 NaOH溶液滴定20. 0mL 0.l 0mol ? L-1的邻苯二甲酸氢钾( KHA) 溶液,溶液pH的变化曲线如图所示。下列叙述正确的是
A. a 点的混合溶液中:c(K+) >c(HA-)>c(Na+) >c(A2-)
B. b 点的混合溶液中:c(Na+) =c(A2-)+c(H2A)
C. c 点的混合溶液中:c(OH-) -c(H+) =c(HA-)+2c(H2A)
D. 从a 点到c 点水的电离程度逐渐增大
15. 一定条件下,测得反应3CO( g)+3H2(g) (CH3)2O(g) + CO2(g) 达平衡时 CO 的平衡转化率与温度和压强的关系如图所示。温度为 T 时,向体积为 l L 的恒容密闭容器中充入0. 4mol CO和0. 4mol H2,平衡时测得CO2 物质的量为0. l mol。下列说法正确的是
A. 该反应的ΔH <0_,图中压强p1>p2
B.压强为p2时,图中Q点所示条件下v(正) < v(逆)
C. 温度为 T 时,若向体积为l L 的恒压容器中充入0. 4mol CO和 0.4mol H2,达平衡时CO的转化率大于75%
D. 温度为T 时,若向原容器中充入0. lmol CO、0. 2mol(CH3 )2 O和0. 2mol CO2,则该反应的平衡常数大于104
第 II 卷(非选择题 共 60 分)
16. ( 8 分)25°C 时 ,三种弱电解质的电离平衡常数如下表:
化学式
HCOOH
CH3COOH
NH3·H2O
电离平衡常数
1. 77 ×10-4
1. 75 ×10-5
1.76×10-5
(1) 下列方法中,可以使0. l 0mol ? L-1CH3COOH 溶液中CH3COOH 电离程度增大的是 。
a. 通入少量 HCl 气体 b. 加入少量冰醋酸
c. 加入少量醋酸钠固体 d.. 加入少量水
(2)常温下,0 . l mol ? L-1的NH3·H2O溶液加水稀释过程 ,下列表达式的数据 一 定变小的是 。
a.c(OH-) b. false c. c(H+)·c(OH-) d.. false
(3) 同浓度的①HCOONa、② CH3COONa、③CH3COONH4 ④NH4Cl 溶液的 pH 由大到小的顺序为 。
( 4 ) 用相同浓度的 NaOH 溶液分别滴定等体积 pH均为3 的 HCOOH和 CH3COOH溶液至终点,消耗 NaOH 溶液的体积分别为V1 、V2,则 V1 V2(填“ >”、“<“或”=”)。
17.(12分)硫酸铅( PbSO4) 广泛应用于制造铅蓄电池、白色颜料等。由方铅矿(主要成分为PbS, 含FeS2等杂质 )和软锰矿(主要成分为 MnO2)制备 PbSO4 的工艺流程如下:
已知:① PbCl2难溶于冷水,易溶于热水
②PbC12 (s) + 2Cl-(aq) PbCl42-(aq) ΔH >0
③Ksp(PbSO4)=1.08 ×l0-8 ,Ksp(PbCl2) =1.6× l 0-5
(1) “浸取”过程中盐酸与 MnO2、PbS 发生反应生成 PhCl2 和S 的化学方程式为
;“浸取”时加入饱和 NaCl 溶液的原因是 。
( 2 ) “调 pH”的目的是 。
( 3 ) “沉降”时加入冰水的作用是 。
( 4 ) 流程中可循环使用的物质是 。
( 5 ) 20°C 时 ,PbCl2 ( s ) 在不同浓度盐酸中的最大溶解量( g? L-1)如题17图所示。下列叙述正确的是 (填序号)。
a 盐酸浓度越小 ,Ksp(PbCl2) 越小
b.x、y 两点对应的溶液中 c( Pb2 +) 不相等
c.当盐酸浓度为 l mol ? L-1 时 ,溶液中 c( Pb2+) 一 定最小
18. (14 分)硫酸厂尾气中含有大量SO2 , 回收并综合利用SO2对环境保护有重要意义。
(1) )利用氨水吸收烟气中的SO2 可转化为( NH4)2 SO4 。 相关反应的主要热化学方程式如下:
SO2 (g) +NH3?H2O(aq)=NH4HSO3 (aq) ΔH1 = a kJ ? mol-1
NH3?H2O (aq)+ NH4HSO3 (aq)=(NH4)2SO3(aq) +H2O(l) ΔH2 =b kJ ? mol-1
2 (NH4)2SO3 (aq) + O2 (g) =2(NH4) 2SO4 (aq) ΔH3 =c kJ?mol-1
①反应2 SO2 ( g) +4 NH3?H2O (aq)+O2(g)= 2(NH4) 2SO4 (aq) + 2H2O( l ) 的
ΔH= kJ ?mol-1
②空气氧化NH4HSO3的速率随温度的变化如题 18 图 -1 所示,当温度超过 60℃ 时,
(NH4)2SO3氧化速率下降的原因可能是 。研究发现,在500℃下硫酸铵分解过程中得到4 种产物,其含氮物质随时间变化关系如题18 图- 2 所示。写出该条件下硫酸铵分解的化学方程式: 。
(2) 工业上利用SO2尾气可制备亚硫酰氯( SOCl2) 。SOCl2 是 一种发烟液体,易水解,可用于农药、医药、染料、电池等生产,其制备原理为:S(s) +2Cl2(g) +SO2(g)
2 SOCl2 ( g)。
①该反应的平衡常数表达式为 。
②用SOCl2 与 A1Cl3 ? 6 H2O混合共热,可得到无水A1Cl3, 原因是 。
( 3 ) 用电解法处理含有SO2尾气的装置如题18 图 - 3 所示(电极材料均为惰性电极)。
该装置中的离子交换膜为 离子交换膜(填“阴”或“阳”);阴极的电极反应式为 。
19. ( 14 分)二氧化氯泡腾片是一种常用的含氯消毒剂,其主要成分是亚氯酸钠( NaClO2) 。 NaClO2的制备原理为:用 SO2与NaClO3 制取 ClO2 气体,再由ClO2 在强碱性条件下与过量的 H2O2 反应制得(装置如题19 图- 1 所示)。
已知: ①NaClO2碱性溶液稳定,酸性溶液会分解
② 无水NaClO2常温稳定,有水存在时加热到130°C 分解;
③ NaClO2 饱和溶液在温度低于38°C时 析出的晶体是NaClO2?3 H2O, 高于38 °C时 析出晶体是NaClO2。
( 1) 装置C 用于制备 ClO2气体,同时生成 NaHSO4 , 写出该反应的化学方程式: 。
( 2) 将C 中产生的ClO2 通入装置D 中制备 NaClO2 , 反应温度需控制在3°C' 写出该反应的离子方程式: 。
( 3 ) 反应结束后,将 D 中混合物减压蒸发浓缩,冷却结晶可获得NaClO2 晶体。结晶时温度需保持在40 ~55°C,原因是 。
(4)保持反应时间、反应物和溶剂的用量不变,实验中提高ClO2吸收率的措施有:
(写出一种即可)。
( 5 ) 装置C 所得溶液中主要溶质为 Na2SO4和 NaHSO4 , 直接排放会污染环境且浪费资源,经处理后可获得芒硝(Na2SO4·10 H2O ) 。请补充完整由装置 C 中所得溶液制取Na2SO4·10 H2O 的实验方案: (实验中须使用的试剂和仪器有:NaOH溶液、冰水、pH计)。已知:Na2SO4 的溶解度曲线如题19图 - 2 所示。
20. ( 12 分)工业上以钒炉渣(主要含 V2O3还有少量SiO2 、P2O5等杂质)为原料可以制备氧钒碱式碳酸铵晶体[ ( NH4)a( VO ) b( CO3)c( OH)d?nH2O) , 其中V 为+ 4 价。其生产工艺流程如下:
( 1 ) “沉钒”得到偏钒酸铵( NH4VO3),若滤液中 c( VO3-)=0.l mol ?L-1为使钒元素的沉降率达到98% , 至少应调节c( NH4+)为 mol? L-1。
已知:Ksp(NH4VO3 )=1.6 ×10-3。
( 2 ) “还原”V2O5过程中,生成VOCl2 和一种无色无污染的气体,该反应的化学方程为式
。
用浓盐酸与V2O5 反应也可以制得VOC12, 该方法的缺点是 。
(3 ) 为测定氧钒碱式碳酸铵样品的组成,进行下列实验:
①准确称量1. 0650g 产品于锥形瓶中,用20 mL 蒸馏水与30mL 稀硫酸溶解后,加水稀释至100. 00mL得到溶液 A。将溶解过程产生的气体全部通入足量澄清石灰水,生成白色沉淀0. 4000g。
②准确量取20. 00mL溶液 A, 加足量的 NaOH 溶液并充分加热,生成 NH3 22.4 mL( 标准状况)。
③ 准确量取20. 00mL 溶液A, 加入0. l000mol?L-1 KMnO4溶液将VO2+ 恰好氧化成VO2+ , 然后用 0. l000mol? L-1( NH4) 2Fe(SO4)2 标准溶液滴定至终点,消耗标准溶液的体积为12. 00mL。已知滴定反应为:VO2+ +Fe2+ +2H+ = VO2+ +Fe3+ + H2O。
通过计算确定该氧钒碱式碳酸铵晶体样品的化学式(写出计算过程)。
无锡市普通高中2020 年春学期高二期终调研考试试卷
化学(选修)参考答案及评分标准
第 I卷(选择题 共 40 分)
单项选择题: 本题包括10 小题, 每小题 2 分, 共 20 分。
1. A 2. D 3. C 4. A 5. C 6. A 7. C 8. B 9. D 10. B
不定项选择题: 本题包括 5 小题,每小题 4 分,共 20 分。
11. AC 12. B 13. D 14. CD 15. AC
第 II 卷(非选择题 共 60 分)
16. ( 每空 2 分, 共 8 分)
(1) d
(2) a
(3) ②①③④
(4) <
17. ( 每空 2 分, 共 12 分)
(1) MnO2 +PbS+4HCl=PbCl2 + MnCl2 +S + 2H2O
( PbCl2 难溶于水, 容易覆盖在方铅矿表面, 减慢反应速率,)加入 NaCl 增大c(Cl-, )
有利于PbC12(s) +2Cl-(aq ) PbCl42-(a q )平衡正移, 将PbCl2(s )转化为PbCl42- (其它答案合理均给分)
( 2 ) 使 Fe3+ 沉淀成 Fe(OH)3 而除去
( 3 ) 降低PbCl2的溶解度; ( 1 分)使 PbC12(s) +2Cl-(aq ) PbCl42-(a q ) 平衡逆向移动,有利于PbCl2晶体而析出 ( I 分)
( 4 ) 盐酸(或 HCl) .
(5) b
18. ( 每空2分, 共14分)
(1) ①2a+2b+c
②温度过高(NH4)2SO3会分解(或水解), 浓度减小(或温度升高O2在溶液中溶解度降
低) 3 (NH4)2SO4 N2↑+4NH3↑+3SO2↑+6H2O↑
(2) ① K=
②SOCl2 水解产生 HCl, 抑制 Al3+的水解
( 3 ) 阳 2HSO3-+2e-+2H+ = S2O42-+2H2O
19. ( 1~4 小题每空 2 分每空 2 分, 共 14 分)
(l) 2NaClO3 + SO2 +H2SO4=2ClO2 +2NaHSO4
(2) 2ClO2+H2O2 + 2OH-= 2ClO2-+ O2 +2H2O
(3) 温度过高 NaClO2 会分解,温度过低晶体以 NaClO2?3H2O析出
(4) 缓慢滴加硫酸(搅拌、冰水浴均可)
(5) 向装置 C 所得溶液中滴加 NaOH 溶液, ( 1 分)边滴加边用 pH 计测溶液的 p,H 至溶液 pH=7 时停止滴加 NaOH 溶液,(1 分)将溶液蒸发浓缩, 冷却至 32.4°C以下结晶, ( 1 分)过滤, ( 1 分)用冰水洗涤晶体 2~3次, ( 1 分)低温烘干得到芒硝。(1 分)
20. ( 共 12 分)
(1) 0.8 ( 2 分)
(2) N2H4?2HCl +2V2O5+6HCl= 4VOCl2 +N2 ↑+ 6 H2O ( 2 分 )有氯气生成, 污染空气( 2 分)
(3) n(CO32-)=n(CaCO3)= =4.000×10-3mol
n (NH4+ )=n(NH3)= × = 5.000× 10一3mol
n(VO2+)=n(VO2+)
=n(Fe2+)= 0. 1000 mol?L-1×12.00 mL×10-3 L?mL-1 ×
=6.000×10-3mol ( 1 分)
n(OH-)=n(NH4+ )+ 2n(VO2+ ) 一2n(CO32-)
=5.000×l0-3 mol+2×6.000×10-3 mol-2×4.000×10-3 mol
=9.000× l 0-3mol (1 分)
m(CO32-)= 60 g?mol-1 ×4. 000× 10-3mol=0. 2400 g
m(NH4+)= 18 g?mo1-1 ×5. 000×10-3mol=0. 09000 g
m(VO2+)= 67 g?mo1-1 ×6.000×10-3 mol=0. 4020 g
m(OH-)= 17 g?mo1-1×9. 000×10-3mol=0. 1530 g
n(H2O)= =1. 000×10-2 mol ( 1分)
a :b :c:d :n= n(NH4+):n(VO2+ ): n(CO32-):n(OH-):n(H2O)= 5:6:4:9:10
氧钒碱式碳酸铵晶体样品的化学式为(NH4)5(VO )6(CO3)4(O H)9?l0H2O ( 1 分)
同课章节目录
