鲁科版高二化学选修四第二章第二节 化学反应的限度(共19张PPT)
文档属性
| 名称 | 鲁科版高二化学选修四第二章第二节 化学反应的限度(共19张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-02 00:00:00 | ||
图片预览





文档简介
(共19张PPT)
教学目标:
1、了解化学平衡移动的概念
2、了解温度、浓度、压强对化学平衡的影响,能够判断化学平衡移动的方向。
第二讲
反应条件对化学平衡的影响
Q≠K
化学平衡的移动
平衡遭破坏
关键!!
哪些条件会对化学平衡产生影响?改变反应条件对化学平衡移动又具体有何影响呢?
[活动.探究]
温度对化学平衡的影响
红棕色
无色
(放热反应)
(吸热反应)
颜色变深
颜色变浅
向吸热方向移动
向放热方向移动
设计实验
操作
条件改变
现象
平衡移动方向
放入
热水
放入
冷水
升温
温度对平衡影响的规律
小结
降温
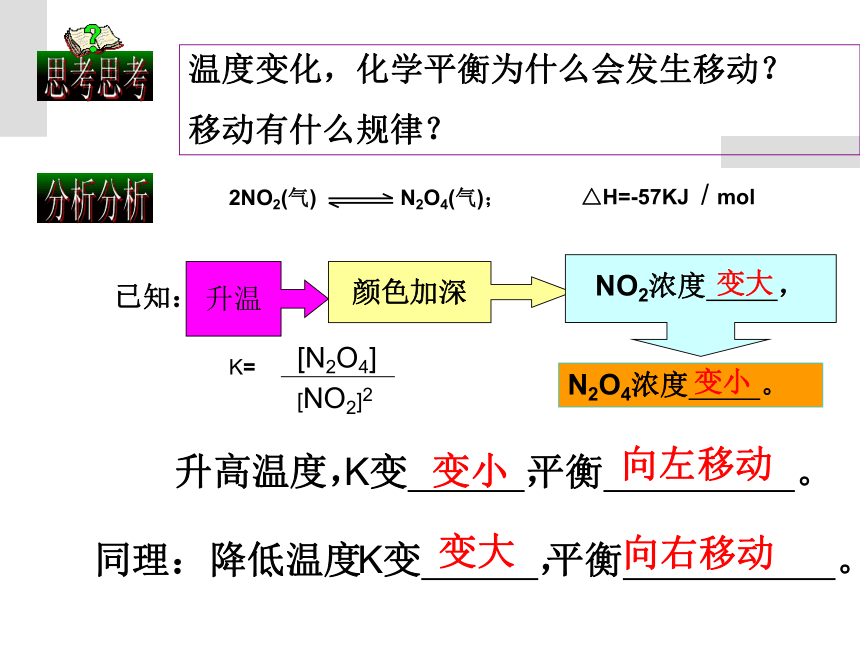
温度变化,化学平衡为什么会发生移动?
移动有什么规律?
已知:
N2O4浓度
。
K变
,
平衡
。
升温
颜色加深
NO2浓度
,
变大
变小
变小
向左移动
升高温度,
K变
,
变大
向右移动
同理:降低温度
平衡
。
影响K值大小的因素
K只随温度改变而改变,不随浓度改变而改变。
对于吸热反应,温度升高K增大,温度降低K减小
对于放热反应,温度升高K减小,温度降低K增大
温度一定,一个化学反应的平衡常数K是一个定值。
A:温度升高,会使化学平衡向着吸热反应的方向移动;
B:温度降低,会使化学平衡向着放热反应的方向移动。
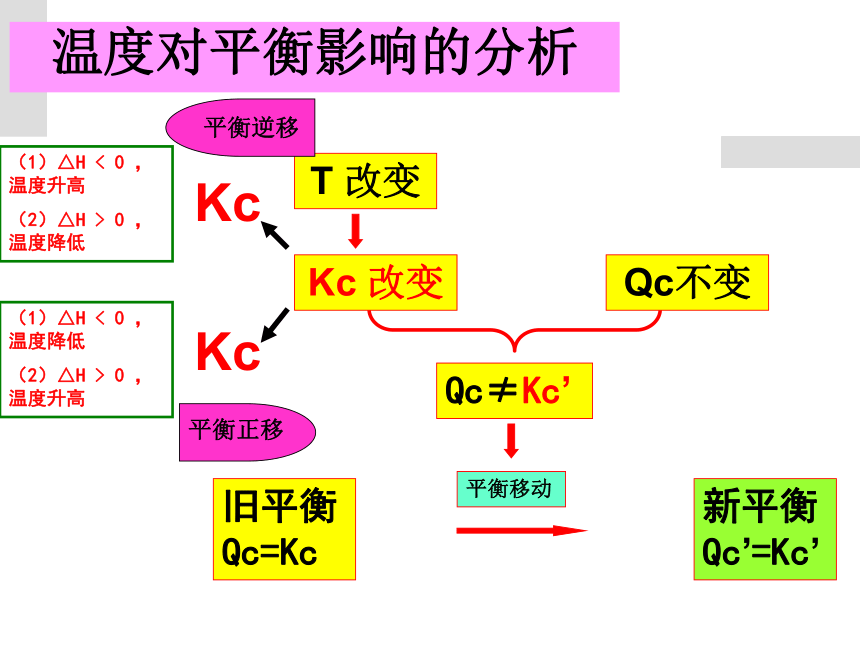
温度对平衡影响的分析
旧平衡Qc=Kc
Qc≠Kc’
平衡移动
新平衡Qc’=Kc’
T
改变
Kc
改变
Qc不变
(1)△H
<
0
,温度升高
(2)△H
>
0
,温度降低
(1)△H
<
0
,温度降低
(2)△H
>
0
,温度升高
Kc
Kc
平衡逆移
[观察.思考]
浓度对化学平衡的影响
A、3mL0.01mol/L
FeCl3
溶液+3mL0.01mol/L
KSCN溶液。
原理:
B、将A所得红色溶液平均分成三份,在第一份中加入少量1mol/L
FeCl3
溶液,第二份中加入少量1mol/LKSCN溶液,第三份作对比。
溶液颜色变深
溶液颜色变深
向正反应方向移动
向正反应方向移动
CFeCl3
增大
CKSCN
增大
操作
条件
改变
现象
平衡移动
方向
加1mol/L
FeCl3溶液
加
1mol/L
KSCN溶液
再向试管中各滴加0.01mol/LNaOH溶液3~5滴,观察现象.
上述实验说明什么?反应物、生成物浓度的改变对平衡状态的改变有何影响?
[思考与交流]
现象:两支试管的溶液颜色均变浅。
离子方程式:
Fe3+
+3SCN-
Fe(SCN)3
浅黄色
红色
2、浓度对化学平衡的影响
结论:(其它条件不变的情况下)
向正反应方向移动
向逆反应方向移动
向逆反应方向移动
Q
﹤
K
Q
﹤
K
Q
﹥K
Q
﹥K
向正反应方向移动
条件改变
浓度商和平衡常数的关系
平衡移动方向
C反增大
C生增大
C反减小
C生减小
浓度对化学平衡影响的原因
改变了浓度商(Q),使Q≠K,进而影响化学平衡
浓度对平衡影响的适用范围:
只适用于气体或溶液
说明:
改变纯固体、纯液体的量对化学平衡无影响。
平衡
状态
[H2]
mol/L
[CO2]
mol/L
[CO]
mol/L
[H2O]
mol/L
平衡常数Kc
1
0.0040
0.0040
0.0060
0.0060
2.25
条件
改变
[H2]
mol/L
[CO2]
mol/L
[CO]
mol/L
[H2O]
mol/L
改变1
0.0040+0.002
(0.006)
0.0040
0.0060
0.0060
改变2
0.0040-0.002
(0.002)
0.0040
0.0060
0.0060
平衡状态
[H2]
mol/L
[CO2]
mol/L
[CO]
mol/L
[H2O]
mol/L
平衡常数
Kc
改变
1
后的
新平衡
0.0055
0.0035
0.0065
0.0065
2.25
改变
2
后的
新平衡
0.0027
0.0047
0.0053
0.0053
2.25
温度(K)
序
号
初始浓度(mol/L)
平衡浓度(mol/L)
C0(H2)
C0(I2)
C0(HI)
[H2]
[I2]
[HI]
698.6
①
0.01067
0.01196
0
0.001831
0.003129
0.01767
54.50
②
0.01135
0.009044
0
0.003560
0.001250
0.01559
54.62
③
0.01134
0.007510
0
0.004565
0.007378
0.01354
54.43
④
0
0
0.004489
0.0004798
0.0004798
0.003531
54.16
⑤
0
0
0.010690
0.001141
0.001141
0.008410
54.33
798.6
⑥
0.01135
0.009040
0
0.004560
0.001950
0.008590
8.298
⑦
0
0
0.01655
0.003390
0.003390
0.009770
8.306
⑧
0
0
0.01258
0.002580
0.002580
0.007420
8.271
≠
Qc
改变Kc
不变
Qc
不变
Kc
改变
浓度改变
温度改变
Qc
Kc
三支针筒中均抽入10mlNO2气体,将针筒前端封闭。
原理:N2O4
2NO2
1、将第二支针筒活塞迅速推至5ml处(现象如下图中a
b
c
所示)
2、将第三支针筒活塞迅速拉至20ml处(现象如下图中A1
B1
C1
所示)
请观察针筒中气体颜色变化,并尝试用化学平衡移动的观点
进行解释。
A1
10ml
B1
20ml
C1
20ml
[观察.思考]
b
(5ml)
c
(5ml)
a
(10ml)
3、压强对化学平衡的影响:
在其它条件不变的情况下,
△vg=0,改变压强,平衡不移动
△vg?0,增大压强,平衡向气态物质系数减小方向移动
结论:
只适用于有气体参与的反应
适用条件:
早在1888年,法国科学家勒夏特列就发现了这其中的规律,并总结出著名的勒夏特列原理,也叫化学平衡移动原理:改变影响化学平衡的一个因素,平衡将向能够减弱这种改变的方向移动。
2.已知化学反应2A(?)+B(g)
2C(?)达到平衡,当增大压强时,平衡向逆反应方向移动,则
(
)
A.A是气体,C是固体
B.A、C均为气体
C.A、C均为固体
D.A是固体,C是气体
练习:
1.某一化学反应,反应物和生成物都是气体,改变下列条件一定能使化学平衡向正反应方向移动的是
(
)
A.增大反应物浓度
B.减小反应容器的体积
C.增大生成物浓度
D.升高反应温度
A
D
一定温度下,在密闭容器中发生的反应
2SO2(g)+O2(g)
2SO3(g)
,
△H
<0
逆向移动
正向移动
正向移动
正向移动
正向移动
√
×
√
√
×
提高SO2的转化率
条件改变
平衡移动方向
升温
降温
增c(SO2)
鼓入过量的空气
及时分离SO3
教学目标:
1、了解化学平衡移动的概念
2、了解温度、浓度、压强对化学平衡的影响,能够判断化学平衡移动的方向。
第二讲
反应条件对化学平衡的影响
Q≠K
化学平衡的移动
平衡遭破坏
关键!!
哪些条件会对化学平衡产生影响?改变反应条件对化学平衡移动又具体有何影响呢?
[活动.探究]
温度对化学平衡的影响
红棕色
无色
(放热反应)
(吸热反应)
颜色变深
颜色变浅
向吸热方向移动
向放热方向移动
设计实验
操作
条件改变
现象
平衡移动方向
放入
热水
放入
冷水
升温
温度对平衡影响的规律
小结
降温
温度变化,化学平衡为什么会发生移动?
移动有什么规律?
已知:
N2O4浓度
。
K变
,
平衡
。
升温
颜色加深
NO2浓度
,
变大
变小
变小
向左移动
升高温度,
K变
,
变大
向右移动
同理:降低温度
平衡
。
影响K值大小的因素
K只随温度改变而改变,不随浓度改变而改变。
对于吸热反应,温度升高K增大,温度降低K减小
对于放热反应,温度升高K减小,温度降低K增大
温度一定,一个化学反应的平衡常数K是一个定值。
A:温度升高,会使化学平衡向着吸热反应的方向移动;
B:温度降低,会使化学平衡向着放热反应的方向移动。
温度对平衡影响的分析
旧平衡Qc=Kc
Qc≠Kc’
平衡移动
新平衡Qc’=Kc’
T
改变
Kc
改变
Qc不变
(1)△H
<
0
,温度升高
(2)△H
>
0
,温度降低
(1)△H
<
0
,温度降低
(2)△H
>
0
,温度升高
Kc
Kc
平衡逆移
[观察.思考]
浓度对化学平衡的影响
A、3mL0.01mol/L
FeCl3
溶液+3mL0.01mol/L
KSCN溶液。
原理:
B、将A所得红色溶液平均分成三份,在第一份中加入少量1mol/L
FeCl3
溶液,第二份中加入少量1mol/LKSCN溶液,第三份作对比。
溶液颜色变深
溶液颜色变深
向正反应方向移动
向正反应方向移动
CFeCl3
增大
CKSCN
增大
操作
条件
改变
现象
平衡移动
方向
加1mol/L
FeCl3溶液
加
1mol/L
KSCN溶液
再向试管中各滴加0.01mol/LNaOH溶液3~5滴,观察现象.
上述实验说明什么?反应物、生成物浓度的改变对平衡状态的改变有何影响?
[思考与交流]
现象:两支试管的溶液颜色均变浅。
离子方程式:
Fe3+
+3SCN-
Fe(SCN)3
浅黄色
红色
2、浓度对化学平衡的影响
结论:(其它条件不变的情况下)
向正反应方向移动
向逆反应方向移动
向逆反应方向移动
Q
﹤
K
Q
﹤
K
Q
﹥K
Q
﹥K
向正反应方向移动
条件改变
浓度商和平衡常数的关系
平衡移动方向
C反增大
C生增大
C反减小
C生减小
浓度对化学平衡影响的原因
改变了浓度商(Q),使Q≠K,进而影响化学平衡
浓度对平衡影响的适用范围:
只适用于气体或溶液
说明:
改变纯固体、纯液体的量对化学平衡无影响。
平衡
状态
[H2]
mol/L
[CO2]
mol/L
[CO]
mol/L
[H2O]
mol/L
平衡常数Kc
1
0.0040
0.0040
0.0060
0.0060
2.25
条件
改变
[H2]
mol/L
[CO2]
mol/L
[CO]
mol/L
[H2O]
mol/L
改变1
0.0040+0.002
(0.006)
0.0040
0.0060
0.0060
改变2
0.0040-0.002
(0.002)
0.0040
0.0060
0.0060
平衡状态
[H2]
mol/L
[CO2]
mol/L
[CO]
mol/L
[H2O]
mol/L
平衡常数
Kc
改变
1
后的
新平衡
0.0055
0.0035
0.0065
0.0065
2.25
改变
2
后的
新平衡
0.0027
0.0047
0.0053
0.0053
2.25
温度(K)
序
号
初始浓度(mol/L)
平衡浓度(mol/L)
C0(H2)
C0(I2)
C0(HI)
[H2]
[I2]
[HI]
698.6
①
0.01067
0.01196
0
0.001831
0.003129
0.01767
54.50
②
0.01135
0.009044
0
0.003560
0.001250
0.01559
54.62
③
0.01134
0.007510
0
0.004565
0.007378
0.01354
54.43
④
0
0
0.004489
0.0004798
0.0004798
0.003531
54.16
⑤
0
0
0.010690
0.001141
0.001141
0.008410
54.33
798.6
⑥
0.01135
0.009040
0
0.004560
0.001950
0.008590
8.298
⑦
0
0
0.01655
0.003390
0.003390
0.009770
8.306
⑧
0
0
0.01258
0.002580
0.002580
0.007420
8.271
≠
Qc
改变Kc
不变
Qc
不变
Kc
改变
浓度改变
温度改变
Qc
Kc
三支针筒中均抽入10mlNO2气体,将针筒前端封闭。
原理:N2O4
2NO2
1、将第二支针筒活塞迅速推至5ml处(现象如下图中a
b
c
所示)
2、将第三支针筒活塞迅速拉至20ml处(现象如下图中A1
B1
C1
所示)
请观察针筒中气体颜色变化,并尝试用化学平衡移动的观点
进行解释。
A1
10ml
B1
20ml
C1
20ml
[观察.思考]
b
(5ml)
c
(5ml)
a
(10ml)
3、压强对化学平衡的影响:
在其它条件不变的情况下,
△vg=0,改变压强,平衡不移动
△vg?0,增大压强,平衡向气态物质系数减小方向移动
结论:
只适用于有气体参与的反应
适用条件:
早在1888年,法国科学家勒夏特列就发现了这其中的规律,并总结出著名的勒夏特列原理,也叫化学平衡移动原理:改变影响化学平衡的一个因素,平衡将向能够减弱这种改变的方向移动。
2.已知化学反应2A(?)+B(g)
2C(?)达到平衡,当增大压强时,平衡向逆反应方向移动,则
(
)
A.A是气体,C是固体
B.A、C均为气体
C.A、C均为固体
D.A是固体,C是气体
练习:
1.某一化学反应,反应物和生成物都是气体,改变下列条件一定能使化学平衡向正反应方向移动的是
(
)
A.增大反应物浓度
B.减小反应容器的体积
C.增大生成物浓度
D.升高反应温度
A
D
一定温度下,在密闭容器中发生的反应
2SO2(g)+O2(g)
2SO3(g)
,
△H
<0
逆向移动
正向移动
正向移动
正向移动
正向移动
√
×
√
√
×
提高SO2的转化率
条件改变
平衡移动方向
升温
降温
增c(SO2)
鼓入过量的空气
及时分离SO3
