鲁科版高二化学选修四第1章第1节《化学反应的热效应》课件(共18张PPT)
文档属性
| 名称 | 鲁科版高二化学选修四第1章第1节《化学反应的热效应》课件(共18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 605.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-02 06:22:36 | ||
图片预览





文档简介
(共18张PPT)
第一章化学反应与能量转化
第1节化学反应的热效应
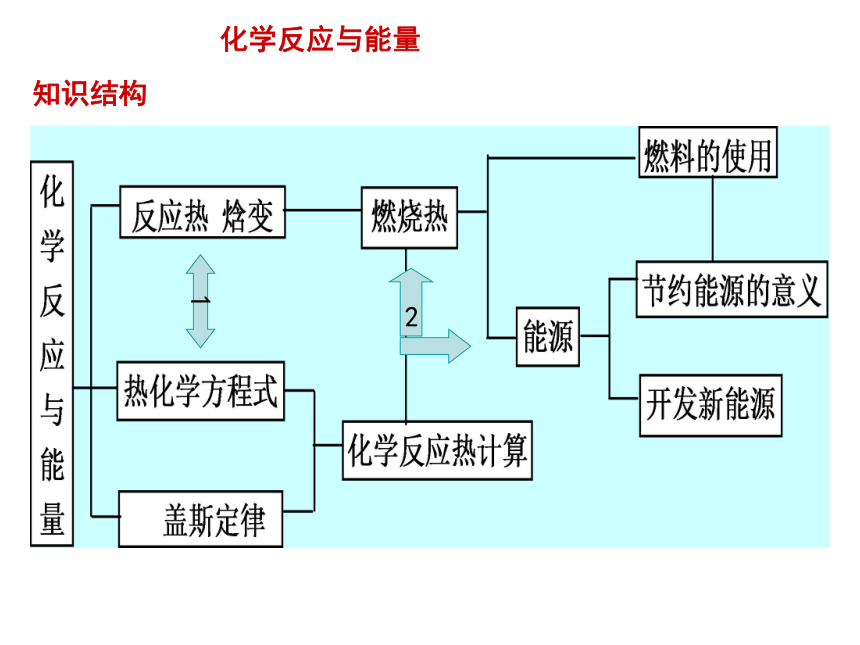
知识结构
化学反应与能量
一、反应热的涵义
1、定义:化学上规定,当化学反应在一定的温度下进行时,反应所释放或吸收的热量为该反应在此温度下的热效应。
2、符号:用Q表示
Q<0,表示放热;Q>0,表示吸热;
3、单位:J/mol或kJ/mol
4、反应热的计算公式
Q=
-
C(T2
-T1)=-
C0m(T2-T1)
C—热容,当物质吸收热量温度升高时,温度每升高1K所吸收的热量,称为该物质的热容;
C0—比热容,单位质量物质的热容;
T—热力学温度,也叫开尔文温度,
单位为k,T(k)=t(0c)+273.15
练1、下列说法正确的是
A.需要加热方能发生的反应一定是吸热反应
B.放热的反应在常温下一定很易发生
C.反应是放热的还是吸热的必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应在一定的条件下也能发生
C
D
5、中和热
(1)定义:在稀溶液中,酸跟碱发生中和反应,生成1mol水时的反应热叫做中和热。
(2)中和热的表示:
H+(aq)+OH-(aq)=H2O
(1)
△H=-57.3kJ/mol
(3)要点:
Ⅰ、条件:稀溶液
Ⅱ、反应物:
(强)酸与(强)碱。中和热不包括
离子在水溶液中的生成热、电解质电离的吸热所伴随
的热效应
Ⅲ、生成1mol水。中和反应的实质是H+和OH-化合生成H20,若反应过程中有其他物质生成,这部分反应热也不在中和热之内
Ⅳ、放出的热量:57.3kJ/mol
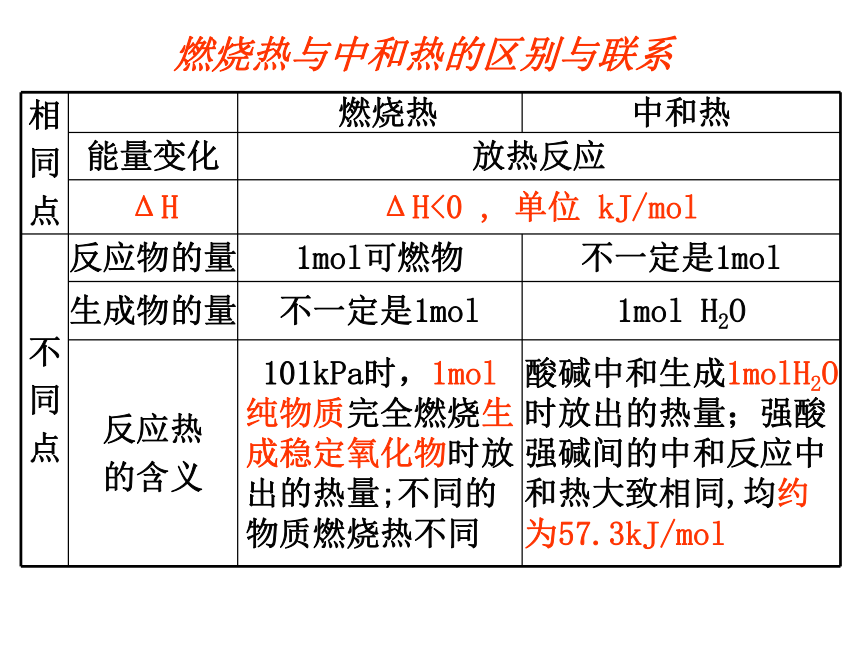
燃烧热与中和热的区别与联系
相
同
点
燃烧热
中和热
能量变化
放热反应
ΔH
ΔH<0
,
单位
kJ/mol
不
同
点
反应物的量
1mol可燃物
不一定是1mol
生成物的量
不一定是1mol
1mol
H2O
反应热
的含义
101kPa时,1mol纯物质完全燃烧生成稳定氧化物时放出的热量;不同的物质燃烧热不同
酸碱中和生成1molH2O时放出的热量;强酸强碱间的中和反应中和热大致相同,均约为57.3kJ/mol
用来描述物质所具有能量的物理量。
符号:H,单位:kJ/mol
作用:用焓的变化来描述与反应热有关的能量变化
3、焓变与反应热的关系
在恒温、恒压的条件下,化学反应过程
中能量变化全部转化为热能,则焓变等于
Qp。
反应产物的总焓与反应物的总焓之差,称为反应焓变。
?H=H(反应产物)-
H(反应物)
二、化学反应的焓变
1、焓:
2、焓变:
当?H为“-”(
?H<0)时,为放热反应
当?H为“+”(
?H>0)时,为吸热反应
焓
焓
4、热化学方程式:
(1)
概念:把一个化学反应中物质的变化和反应的焓变同时表示出来的化学方程式叫热化学方程式。
(2)书写热化学方程式应注意以下几点
Ⅰ、要在反应物和生成物的化学式后面用括号注明各
物质的聚集状态。一般用英文字母g、l、s分别表示
气态、液态和固态,水溶液中的溶质则用aq。
Ⅲ、?H的单位是kJ/mol
或J/mol。
Ⅳ、根据焓的性质,若化学方程式中各物
质的系数加倍,则?H数值的绝对值也加
倍;若反应逆向进行,则?H的数值改变
符号,但绝对值不变。
练2、已知在1×105
Pa,298K条件下,2mol氢气燃烧生成水蒸气放出
484kJ热量,下列热化学方程式正确的是
A.
H2O(g)=H2
(g)+1/2O2
(g);
ΔH=+242kJ·mol-1
B.
2H2(g)+O2(g)=2H2O(l);
ΔH=-484kJ·mol-1
C.
H2
(g)+1/2O2
(g)=H2O(g);
ΔH=+242kJ·mol-1
D.
2H2
(g)+O2
(g)=2H2O(g);
ΔH=+484kJ·mol-1
A
5、热化学方程式表示的意义
表示的意义:
在298K时,1molH2(g)和0.5molO2(g)反应
生成1mol水蒸气放热241.8KJ。
练3、热化学方程式
C(s)+H2O(g)
CO(g)+H2(g);△H
=+131.3kJ/mol
表示( )
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
C
练4、相同温度时,下列两个反应的反应热分别用△H1、△H2表示,关系正确的是
①
H2
(g)+1/2O2(g)=H2O(l)
△H1=
-Q1
kJ/mol
②
2H2(g)+O2(g)=2H2O(l)
△H2=
-Q2
kJ/mol
(A)
Q1
>Q2
(B)2Q1
=Q2
(C)
2
Q1
(D)Q1
=Q2
B
▲若一个化学方程式可由另外几个化学方程式相加减而得到,则该反应的焓变即为这几个化学反应焓变的代数和。
重点难点
化学反应的热效应和键能的关系;盖斯定律
三、盖斯定律及其应用
化学反应不管是一步完成还是分几步完成,其反应热是相同的。
即:化学反应的反应热,只与反应的始态(各反应物)和终态(各生成物)有关,而与反应具体进行的途径无关。
应用:
间接计算一些无法直接测定的反应热
练5、已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
据此判断,下列说法正确的是(
)
A.
由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.
由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.
由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.
由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
A
练6、已知
①
CO(g)
+
1/2
O2(g)
====CO2(g)
ΔH1=
-283.0
kJ/mol
②
H2(g)
+
1/2
O2(g)
====H2O(l)
ΔH2=
-285.8
kJ/mol
③C2H5OH(l)
+
3
O2(g)
====
2
CO2(g)
+
3
H2O(l)
ΔH3=-1370
J/mol
试计算④2CO(g)+
4
H2(g)====
H2O(l)+
C2H5OH(l)
的ΔH
【解】:根据盖斯定律,反应④不论是一步完成还是分几步完成,其反应热效应都是相同的。下面就看看反应④能不能由①②③三个反应通过加减乘除组合而成,也就是说,看看反应④能不能分成①②③几步完成。
①×2
+
②×4
-
③
=
④
所以,ΔH=ΔH1×2
+ΔH2×4
-ΔH3
?????=-283.2×2
-285.8×4
+1370
=-339.2
kJ/mol
第一章化学反应与能量转化
第1节化学反应的热效应
知识结构
化学反应与能量
一、反应热的涵义
1、定义:化学上规定,当化学反应在一定的温度下进行时,反应所释放或吸收的热量为该反应在此温度下的热效应。
2、符号:用Q表示
Q<0,表示放热;Q>0,表示吸热;
3、单位:J/mol或kJ/mol
4、反应热的计算公式
Q=
-
C(T2
-T1)=-
C0m(T2-T1)
C—热容,当物质吸收热量温度升高时,温度每升高1K所吸收的热量,称为该物质的热容;
C0—比热容,单位质量物质的热容;
T—热力学温度,也叫开尔文温度,
单位为k,T(k)=t(0c)+273.15
练1、下列说法正确的是
A.需要加热方能发生的反应一定是吸热反应
B.放热的反应在常温下一定很易发生
C.反应是放热的还是吸热的必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应在一定的条件下也能发生
C
D
5、中和热
(1)定义:在稀溶液中,酸跟碱发生中和反应,生成1mol水时的反应热叫做中和热。
(2)中和热的表示:
H+(aq)+OH-(aq)=H2O
(1)
△H=-57.3kJ/mol
(3)要点:
Ⅰ、条件:稀溶液
Ⅱ、反应物:
(强)酸与(强)碱。中和热不包括
离子在水溶液中的生成热、电解质电离的吸热所伴随
的热效应
Ⅲ、生成1mol水。中和反应的实质是H+和OH-化合生成H20,若反应过程中有其他物质生成,这部分反应热也不在中和热之内
Ⅳ、放出的热量:57.3kJ/mol
燃烧热与中和热的区别与联系
相
同
点
燃烧热
中和热
能量变化
放热反应
ΔH
ΔH<0
,
单位
kJ/mol
不
同
点
反应物的量
1mol可燃物
不一定是1mol
生成物的量
不一定是1mol
1mol
H2O
反应热
的含义
101kPa时,1mol纯物质完全燃烧生成稳定氧化物时放出的热量;不同的物质燃烧热不同
酸碱中和生成1molH2O时放出的热量;强酸强碱间的中和反应中和热大致相同,均约为57.3kJ/mol
用来描述物质所具有能量的物理量。
符号:H,单位:kJ/mol
作用:用焓的变化来描述与反应热有关的能量变化
3、焓变与反应热的关系
在恒温、恒压的条件下,化学反应过程
中能量变化全部转化为热能,则焓变等于
Qp。
反应产物的总焓与反应物的总焓之差,称为反应焓变。
?H=H(反应产物)-
H(反应物)
二、化学反应的焓变
1、焓:
2、焓变:
当?H为“-”(
?H<0)时,为放热反应
当?H为“+”(
?H>0)时,为吸热反应
焓
焓
4、热化学方程式:
(1)
概念:把一个化学反应中物质的变化和反应的焓变同时表示出来的化学方程式叫热化学方程式。
(2)书写热化学方程式应注意以下几点
Ⅰ、要在反应物和生成物的化学式后面用括号注明各
物质的聚集状态。一般用英文字母g、l、s分别表示
气态、液态和固态,水溶液中的溶质则用aq。
Ⅲ、?H的单位是kJ/mol
或J/mol。
Ⅳ、根据焓的性质,若化学方程式中各物
质的系数加倍,则?H数值的绝对值也加
倍;若反应逆向进行,则?H的数值改变
符号,但绝对值不变。
练2、已知在1×105
Pa,298K条件下,2mol氢气燃烧生成水蒸气放出
484kJ热量,下列热化学方程式正确的是
A.
H2O(g)=H2
(g)+1/2O2
(g);
ΔH=+242kJ·mol-1
B.
2H2(g)+O2(g)=2H2O(l);
ΔH=-484kJ·mol-1
C.
H2
(g)+1/2O2
(g)=H2O(g);
ΔH=+242kJ·mol-1
D.
2H2
(g)+O2
(g)=2H2O(g);
ΔH=+484kJ·mol-1
A
5、热化学方程式表示的意义
表示的意义:
在298K时,1molH2(g)和0.5molO2(g)反应
生成1mol水蒸气放热241.8KJ。
练3、热化学方程式
C(s)+H2O(g)
CO(g)+H2(g);△H
=+131.3kJ/mol
表示( )
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
C
练4、相同温度时,下列两个反应的反应热分别用△H1、△H2表示,关系正确的是
①
H2
(g)+1/2O2(g)=H2O(l)
△H1=
-Q1
kJ/mol
②
2H2(g)+O2(g)=2H2O(l)
△H2=
-Q2
kJ/mol
(A)
Q1
>Q2
(B)2Q1
=Q2
(C)
2
Q1
=Q2
B
▲若一个化学方程式可由另外几个化学方程式相加减而得到,则该反应的焓变即为这几个化学反应焓变的代数和。
重点难点
化学反应的热效应和键能的关系;盖斯定律
三、盖斯定律及其应用
化学反应不管是一步完成还是分几步完成,其反应热是相同的。
即:化学反应的反应热,只与反应的始态(各反应物)和终态(各生成物)有关,而与反应具体进行的途径无关。
应用:
间接计算一些无法直接测定的反应热
练5、已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
据此判断,下列说法正确的是(
)
A.
由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.
由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.
由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.
由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
A
练6、已知
①
CO(g)
+
1/2
O2(g)
====CO2(g)
ΔH1=
-283.0
kJ/mol
②
H2(g)
+
1/2
O2(g)
====H2O(l)
ΔH2=
-285.8
kJ/mol
③C2H5OH(l)
+
3
O2(g)
====
2
CO2(g)
+
3
H2O(l)
ΔH3=-1370
J/mol
试计算④2CO(g)+
4
H2(g)====
H2O(l)+
C2H5OH(l)
的ΔH
【解】:根据盖斯定律,反应④不论是一步完成还是分几步完成,其反应热效应都是相同的。下面就看看反应④能不能由①②③三个反应通过加减乘除组合而成,也就是说,看看反应④能不能分成①②③几步完成。
①×2
+
②×4
-
③
=
④
所以,ΔH=ΔH1×2
+ΔH2×4
-ΔH3
?????=-283.2×2
-285.8×4
+1370
=-339.2
kJ/mol
