鲁科版高二化学选修四3.1水溶液(共20张PPT)
文档属性
| 名称 | 鲁科版高二化学选修四3.1水溶液(共20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 605.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-02 00:00:00 | ||
图片预览







文档简介
(共20张PPT)
第三章
物质在水溶液中的行为
第一节:水溶液
第一讲:水的电离
电解质在水溶液中的存在形态
联想·质疑:
酸、碱、盐的水溶液能导电,纯水能导电吗?
有人测量了经过28次蒸馏的水的电导值,结果
不为零。
一、水的电离
定性:精确的实验证明,纯水能微弱地电离,生成自由移动的H+和OH-,所以水是一种极弱的电解质。
水的电离是水分子和水分子相互作用发生。
电离方程式是:
定量:25℃时,1L纯水(约55.6mol的H2O)中只有1×10-7mol的H2O发生电离,因此25℃时的纯水中[H+]和[OH-]各等于1×10-7mol·L-1。其电离度约为1.8×10-7%
水的电离是一个可逆的过程,在一定温度下可以达到电离平衡。其过程遵循化学平衡移动原理。电离平衡常数为:
变形为:K
·
[H2O]=
[H+]
[OH-]
实验证明25℃时,KW=
[H+][OH-]=1×10-14mol2·L-2
KW叫水的离子积常数,简称水的离子积
在一定温度下,
K·
[H2O]是常数,则[H+][OH-]也为常数:
KW=
[H+][OH-]
分析下表中的数据有何规律,并解释之
观察与思考:
分析上表数据可得出怎样的结论?
t/℃
K
W
/mol2·L-2
25
1.0×10-14
55
7.3×10-14
80
2.5×10-13
100
5.5×10-13
向右
增大
增大
增大
向左
向左
不变
不变
增大
减小
减小
增大
向右
不变
减小
增大
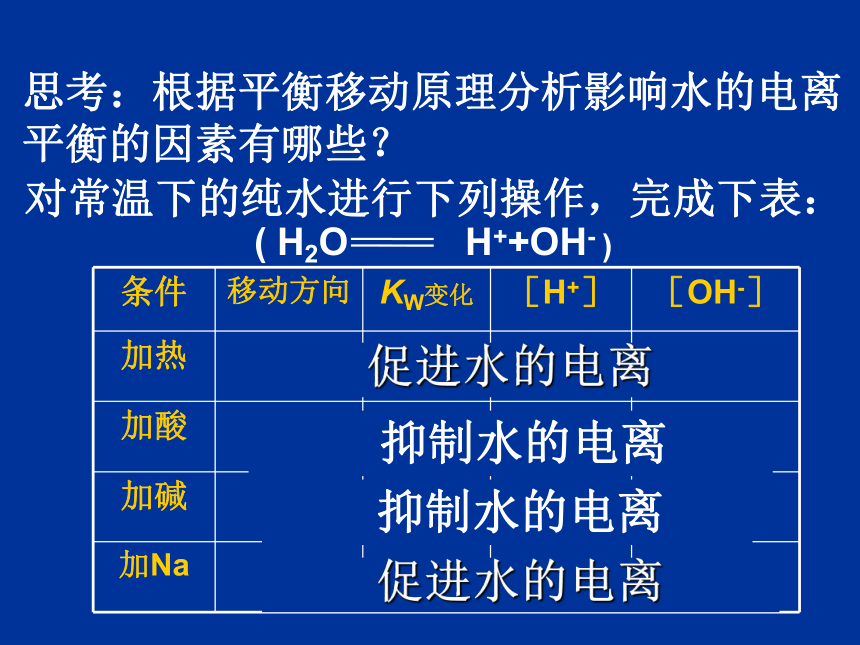
思考:根据平衡移动原理分析影响水的电离平衡的因素有哪些?
抑制水的电离
促进水的电离
抑制水的电离
促进水的电离
条件
移动方向
KW变化
[H+]
[OH-]
加热
加酸
加碱
加Na
(1)Kw只随温度变化,温度升高则Kw增大。若没有指明温度,通常是指在25℃时,即认为Kw=1×10-14(mol/L)2。
(2)水的离子积是水电离平衡时的性质,它不仅适用于纯水,也适用于任何酸、碱、盐的稀溶液。即稀水溶液中的[H+]与[OH-]的乘积是一个常数。
(3)任何稀的水溶液中,水电离产生的[H+]和
[OH-]一定相等
注意:
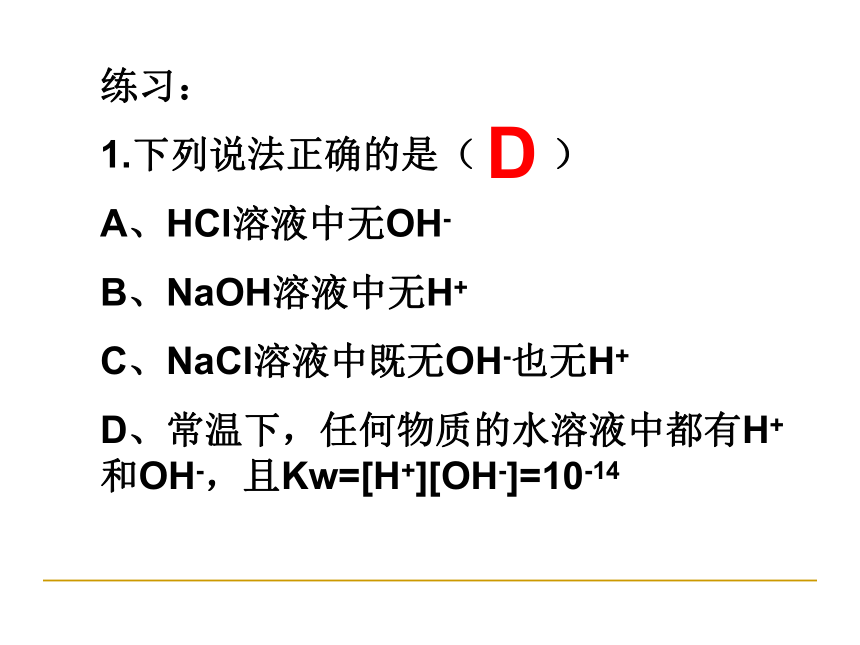
练习:
1.下列说法正确的是(
)
A、HCl溶液中无OH-
B、NaOH溶液中无H+
C、NaCl溶液中既无OH-也无H+
D、常温下,任何物质的水溶液中都有H+和OH-,且Kw=[H+][OH-]=10-14
D
2.Kw仅仅是温度的函数。下列关于Kw与温度关系的叙述中,正确的是(
)
A、温度越高,
Kw越大
B、温度越低,
Kw越大
C、随着温度的升高,
Kw可能增大,也可能减小
D、随着温度的升高,
Kw肯定增大,H+
和OH-浓度同时升高
A
D
3、水的电离过程为H2O
H+
+
OH-,在不同温度下其离子积为KW25℃=1×10-14,
KW35℃
=2.1
×10-14。则下列叙述正确的是(
)
A、[H+]
随着温度的升高而降低
B、在35℃时,纯水中
[H+]
>[OH-]
C、水的电离常数K25
℃
>K35
℃
D、水的电离是一个吸热过程
D
4:某温度下,纯水的H+浓度为5.0×10-7mol/L,则OH-的浓度为
,水的离子积是
。
5、室温下,
1mL
0.05mol/L的H2SO4中有水电离产生的H+,其浓度接近于(
)
A
1.0×10-4mol/L
B
1.0×10-8mol/L
C
1.0×10-13mol/L
D
1.0×10-10mol/L
5.0×10-7mol/L
2.5×10-13(mol/L)2
C
观察思考—(实验)
强
强
强
弱
亮
亮
亮
暗
1.可溶性电解质溶液为何能导电?
2.以上水溶液导电能力有何不同?溶液导电能力取决于什么?
3.氯化氢、醋酸等电解质在溶于水时发生了哪些变化?它们最终的存在形式如何?
暗
弱
等体积的溶液浓度(mol/L)
电解质溶液
灯泡亮度
导电能力
0.5
HCl
0.5
NaOH
0.5
NaCl
0.5
CH3COOH
0.5
NH3.H2O
相关知识回顾
电解质与非电解质
电解质:在水溶液或熔融状态下能够导电的化合物。
非电解质:在水溶液和熔融状态下不能导电的化合物。
下列物质哪些是电解质?哪些是非电解质?
NaCl
KNO3溶液
Cl2
熔融KNO3
盐酸
Cu
CO2
NH3
√
√
√
√
注意事项
1、电解质和非电解质都是化合物,单质既不是电解质也不是非电解质。
2、在水溶液里能够导电或熔融状态下能够导电,两个条件中只要具备一个的化合物即称为电解质,不需两个条件同事具备。
3、在水溶液或熔融状态时,化合物本身电离出自由移动的离子而导电时,才是电解质。
4、电解质溶液的导电能力由自由移动的离子浓度与离子所带电荷数决定。
5、电解质不一定导电,导电物质不一定是电解质,非电解质不导电,但不导电的物质不一定是非电解质。
二、电解质在水溶液中的存在形态
1.强电解质:在稀的水溶液里能完全电离的电解质。
包括强酸(如HCl、H2SO4、HNO3等)、强碱【如KOH、NaOH、Ca(OH)2、Ba(OH)2等】和绝大多数盐(NaCl、Na2SO4、BaSO4等。)
存在形态:水合离子。
2.弱电解质:在稀的水溶液里部分电离的电解质。
包括弱酸(如CH3COOH、H2CO3、H3PO4、HF、HCN等)、弱碱(如NH3·H2O等)和水。
存在形态:水合分子(主要)和水合离子。
强电解质的电离过程是不可逆的,电离方程式用“=”,如:HCl=H++Cl-
电解质溶于水后形成的离子或分子并不是单独存在的,而是与水分子相互吸引,相互结合,以“水合离子”或“水合分子”的形态存在。这种溶质分子或离子与溶剂相互吸引的作用叫做溶剂化作用。
3、溶剂化作用:
判断正误:
1、
任何水溶液中都存在水的电离平衡。
2、任何水溶液中(不论酸、碱或中性)
,都存在
Kw=10-14
mol2/L2
3、某温度下,纯水中H+浓度为1×10-6mol/L,则
OH-浓度为1×10-8mol/L
√
×
×
4、某温度下,某液体[H+]=
10-7mol/L,则该溶液
一定是纯水。
×
1.计算250C时,下列溶液中的[H+]和[OH-]
(1)0.1mol/L的盐酸溶液
(2)0.1mol/L的Ba(OH)2
溶液
[H+]=
0.1mol/L
[OH-]=Kw/[H+]=1.0×10-13
mol/L
[OH-]=
0.1mol/L
×2=0.2mol/L
[H+]=Kw/[OH-]=5×10-14
mol/L
2.弱电解质与强电解质的本质区别在于( )
A.离子数目的多少
B.物质的量浓度相同时,溶液的导电能力强弱
C.在水溶液中是否完全电离
D.电离方程式的写法不同
C
小
结
一、水的电离
KW
=[H+]
·[OH-]
强电解质:完全电离
以水合离子存在
弱电解质:
不完全电离
以水合离子和水合分子存在
二、电解质在水溶液中的存在形态
Kw只随温度变化;它不仅适用于纯水,也适用于任何酸、碱、盐的稀溶液。即稀水溶液中的[H+]与[OH-]的乘积是一个常数。
第三章
物质在水溶液中的行为
第一节:水溶液
第一讲:水的电离
电解质在水溶液中的存在形态
联想·质疑:
酸、碱、盐的水溶液能导电,纯水能导电吗?
有人测量了经过28次蒸馏的水的电导值,结果
不为零。
一、水的电离
定性:精确的实验证明,纯水能微弱地电离,生成自由移动的H+和OH-,所以水是一种极弱的电解质。
水的电离是水分子和水分子相互作用发生。
电离方程式是:
定量:25℃时,1L纯水(约55.6mol的H2O)中只有1×10-7mol的H2O发生电离,因此25℃时的纯水中[H+]和[OH-]各等于1×10-7mol·L-1。其电离度约为1.8×10-7%
水的电离是一个可逆的过程,在一定温度下可以达到电离平衡。其过程遵循化学平衡移动原理。电离平衡常数为:
变形为:K
·
[H2O]=
[H+]
[OH-]
实验证明25℃时,KW=
[H+][OH-]=1×10-14mol2·L-2
KW叫水的离子积常数,简称水的离子积
在一定温度下,
K·
[H2O]是常数,则[H+][OH-]也为常数:
KW=
[H+][OH-]
分析下表中的数据有何规律,并解释之
观察与思考:
分析上表数据可得出怎样的结论?
t/℃
K
W
/mol2·L-2
25
1.0×10-14
55
7.3×10-14
80
2.5×10-13
100
5.5×10-13
向右
增大
增大
增大
向左
向左
不变
不变
增大
减小
减小
增大
向右
不变
减小
增大
思考:根据平衡移动原理分析影响水的电离平衡的因素有哪些?
抑制水的电离
促进水的电离
抑制水的电离
促进水的电离
条件
移动方向
KW变化
[H+]
[OH-]
加热
加酸
加碱
加Na
(1)Kw只随温度变化,温度升高则Kw增大。若没有指明温度,通常是指在25℃时,即认为Kw=1×10-14(mol/L)2。
(2)水的离子积是水电离平衡时的性质,它不仅适用于纯水,也适用于任何酸、碱、盐的稀溶液。即稀水溶液中的[H+]与[OH-]的乘积是一个常数。
(3)任何稀的水溶液中,水电离产生的[H+]和
[OH-]一定相等
注意:
练习:
1.下列说法正确的是(
)
A、HCl溶液中无OH-
B、NaOH溶液中无H+
C、NaCl溶液中既无OH-也无H+
D、常温下,任何物质的水溶液中都有H+和OH-,且Kw=[H+][OH-]=10-14
D
2.Kw仅仅是温度的函数。下列关于Kw与温度关系的叙述中,正确的是(
)
A、温度越高,
Kw越大
B、温度越低,
Kw越大
C、随着温度的升高,
Kw可能增大,也可能减小
D、随着温度的升高,
Kw肯定增大,H+
和OH-浓度同时升高
A
D
3、水的电离过程为H2O
H+
+
OH-,在不同温度下其离子积为KW25℃=1×10-14,
KW35℃
=2.1
×10-14。则下列叙述正确的是(
)
A、[H+]
随着温度的升高而降低
B、在35℃时,纯水中
[H+]
>[OH-]
C、水的电离常数K25
℃
>K35
℃
D、水的电离是一个吸热过程
D
4:某温度下,纯水的H+浓度为5.0×10-7mol/L,则OH-的浓度为
,水的离子积是
。
5、室温下,
1mL
0.05mol/L的H2SO4中有水电离产生的H+,其浓度接近于(
)
A
1.0×10-4mol/L
B
1.0×10-8mol/L
C
1.0×10-13mol/L
D
1.0×10-10mol/L
5.0×10-7mol/L
2.5×10-13(mol/L)2
C
观察思考—(实验)
强
强
强
弱
亮
亮
亮
暗
1.可溶性电解质溶液为何能导电?
2.以上水溶液导电能力有何不同?溶液导电能力取决于什么?
3.氯化氢、醋酸等电解质在溶于水时发生了哪些变化?它们最终的存在形式如何?
暗
弱
等体积的溶液浓度(mol/L)
电解质溶液
灯泡亮度
导电能力
0.5
HCl
0.5
NaOH
0.5
NaCl
0.5
CH3COOH
0.5
NH3.H2O
相关知识回顾
电解质与非电解质
电解质:在水溶液或熔融状态下能够导电的化合物。
非电解质:在水溶液和熔融状态下不能导电的化合物。
下列物质哪些是电解质?哪些是非电解质?
NaCl
KNO3溶液
Cl2
熔融KNO3
盐酸
Cu
CO2
NH3
√
√
√
√
注意事项
1、电解质和非电解质都是化合物,单质既不是电解质也不是非电解质。
2、在水溶液里能够导电或熔融状态下能够导电,两个条件中只要具备一个的化合物即称为电解质,不需两个条件同事具备。
3、在水溶液或熔融状态时,化合物本身电离出自由移动的离子而导电时,才是电解质。
4、电解质溶液的导电能力由自由移动的离子浓度与离子所带电荷数决定。
5、电解质不一定导电,导电物质不一定是电解质,非电解质不导电,但不导电的物质不一定是非电解质。
二、电解质在水溶液中的存在形态
1.强电解质:在稀的水溶液里能完全电离的电解质。
包括强酸(如HCl、H2SO4、HNO3等)、强碱【如KOH、NaOH、Ca(OH)2、Ba(OH)2等】和绝大多数盐(NaCl、Na2SO4、BaSO4等。)
存在形态:水合离子。
2.弱电解质:在稀的水溶液里部分电离的电解质。
包括弱酸(如CH3COOH、H2CO3、H3PO4、HF、HCN等)、弱碱(如NH3·H2O等)和水。
存在形态:水合分子(主要)和水合离子。
强电解质的电离过程是不可逆的,电离方程式用“=”,如:HCl=H++Cl-
电解质溶于水后形成的离子或分子并不是单独存在的,而是与水分子相互吸引,相互结合,以“水合离子”或“水合分子”的形态存在。这种溶质分子或离子与溶剂相互吸引的作用叫做溶剂化作用。
3、溶剂化作用:
判断正误:
1、
任何水溶液中都存在水的电离平衡。
2、任何水溶液中(不论酸、碱或中性)
,都存在
Kw=10-14
mol2/L2
3、某温度下,纯水中H+浓度为1×10-6mol/L,则
OH-浓度为1×10-8mol/L
√
×
×
4、某温度下,某液体[H+]=
10-7mol/L,则该溶液
一定是纯水。
×
1.计算250C时,下列溶液中的[H+]和[OH-]
(1)0.1mol/L的盐酸溶液
(2)0.1mol/L的Ba(OH)2
溶液
[H+]=
0.1mol/L
[OH-]=Kw/[H+]=1.0×10-13
mol/L
[OH-]=
0.1mol/L
×2=0.2mol/L
[H+]=Kw/[OH-]=5×10-14
mol/L
2.弱电解质与强电解质的本质区别在于( )
A.离子数目的多少
B.物质的量浓度相同时,溶液的导电能力强弱
C.在水溶液中是否完全电离
D.电离方程式的写法不同
C
小
结
一、水的电离
KW
=[H+]
·[OH-]
强电解质:完全电离
以水合离子存在
弱电解质:
不完全电离
以水合离子和水合分子存在
二、电解质在水溶液中的存在形态
Kw只随温度变化;它不仅适用于纯水,也适用于任何酸、碱、盐的稀溶液。即稀水溶液中的[H+]与[OH-]的乘积是一个常数。
