苏教版高一化学必修1专题3第一单元从铝土矿到铝合金 课件 (共35张PPT)
文档属性
| 名称 | 苏教版高一化学必修1专题3第一单元从铝土矿到铝合金 课件 (共35张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-02 09:35:15 | ||
图片预览











文档简介
(共35张PPT)
第一单元从铝土矿到铝合金
铝的性质
铝盆
导弹
飞机
铝线
铝壶
易拉罐
铝箔
银白色固体,有金属光泽
质软
熔点低
密度小(2.7g·cm-3)
良好的导电性
良好的导热性
良好的延展性
铝的物理性质
导热性
导电性
密度小
它们分别利用了铝的哪些物理性质
铝的物理性质
铝的原子结构示意图为:
K
Ca
Na
Mg
Zn
Fe
Sn
Pb
H
Cu
Hg
…
Al
结论:Al的化学性质活泼,具有较强还原性
铝的原子结构
生锈的铁锅
光洁的铝锅
根据金属活动性顺序表,铝比铁活泼,但铝为什么却不像铁那样容易被腐蚀?
1、与(O2、S、Cl2等)非金属的反应
[现象]:
铝在氧气中剧烈燃烧,放出大量的热、发出耀眼的白光。
反应方程式:
铝的化学性质
2.铝锅为什么可以用来煮饭?
答:铝具有良好的导热性能、常温下铝的表面被氧化,
生成一层致密氧化物薄膜。
思维拓展
2Al+6HCl=
2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
铝条未发生明显变化
铝条未发生明显变化
铝条上产生大量无色的气泡
铝条上产生大量无色的气泡
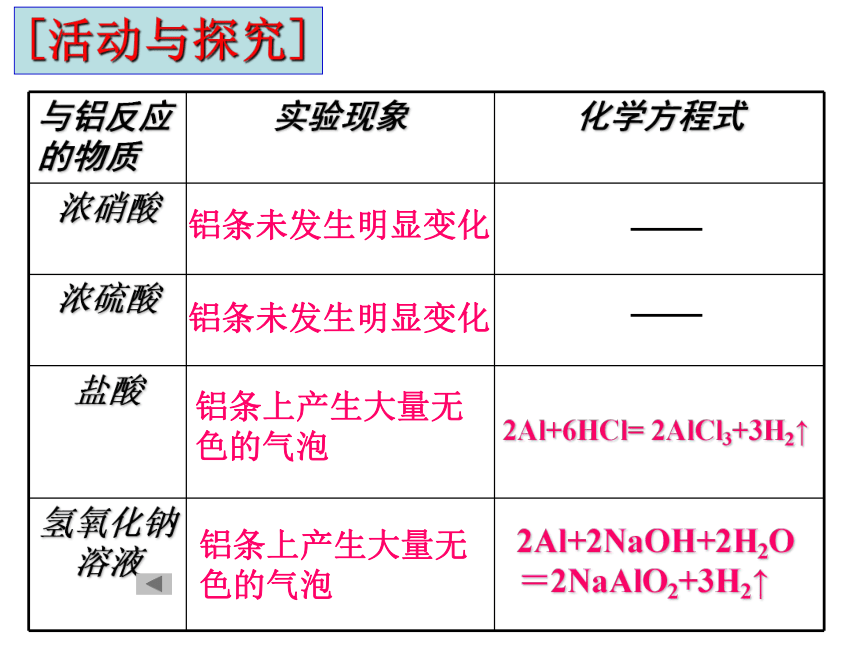
[活动与探究]
与铝反应的物质
实验现象
化学方程式
浓硝酸
浓硫酸
盐酸
氢氧化钠溶液
在上述反应中,铝表现出哪些性质?
[交流与讨论]
常温下,铝能与稀盐酸、氢氧化钠溶液反应放出气体。
铝放入浓硫酸、浓硝酸中均未发生明显变化。
(常温下,铝遇浓硫酸、浓硝酸时在表面生成致密的氧化膜阻止了反应的继续进行而发生钝化)
2Al+6HCl=
2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
原因?
(2)
(1)
2.与酸反应
A.与非氧化性酸反应
B.与强氧化性酸反应较复杂,但不生成
氢气
2Al+6H+
==
2Al3++3H2
↑
C.与冷的浓硫酸、浓硝酸钝化
铝的化学性质
运输浓硫酸的铝槽车
3.铝与强碱溶液反应
4.铝与硫酸铜等盐溶液反应
铝的化学性质
标出铝与氢氧化钠溶液反应的电子转移情况。
2Al+6H2O+2NaOH==2NaAlO2+3H2↑+4H2O
失2×3
e-
得6×e-
[试试看]:
2Al+6H2O+2OH-==2AlO2-
+3H2↑+
4H2O
6e-
铝单质与碱的反应
(3)电子转移情况
4、与某些氧化物反应
[现象]:
放出大量的热、发出耀眼的光芒、有熔融物生成。
—铝热反应
铝的化学性质
反应生成的铁熔化,温度可达3000℃。
用途:①冶炼难熔的金属;②焊接钢轨。
铝热剂:
铝粉和某些金属氧化物(Fe2O3、Fe3O4、V2O5、Cr2O3、MnO2)组成的混合物。
铝热反应用于焊接钢轨
铝热反应用于“定向爆破”
,主要是利用铝热反应熔断钢筋
使楼房定向倒塌.
[试一试]:
写出Al分别与Cr2O3
、MnO2
、V2O5
的反应
铝热反应
1.铝不仅可与氧化铁发生铝热反应,用其他金属氧化物,
如
V2O5、Cr2O3、MnO2
等代替氧化铁也可发生铝热反应。
2Al+Fe2O3
4Al+3MnO2
2Al+Cr2O3
2Fe+Al2O3(可用于野外金属铁的焊接、切割)
3Mn+2Al2O3(可用于冶炼金属锰)
2Cr+Al2O3(可用于冶炼金属铬)
2.通过铝热反应只能还原得到金属性比铝弱的金属单质,
而不能还原得到金属性比铝强的金属单质,如铝和氧化镁不能
发生反应。
3.铝制品能否长期存放食物?为什么?
思维拓展
因为食物中含有的酸、碱、盐会与氧化铝、铝反应,腐蚀铝制品。
清洗铝锅不要用钢丝等磨损性大的东西擦洗。
不能
一、铝的物理性质
二、铝的化学性质:
1、与非金属单质反应
2、与酸溶液反应
3、与盐溶液反应
4、与强碱溶液反应
5、与某些金属氧化物反应
特性
通性
还原性
小
结
密度小,强度高、塑性好、制造工艺简单、
建筑业、交通运输业、电子行业
导电性
还原性
铝的用途
成本低、抗腐蚀能力强
燃烧弹,信号弹
用途
燃烧弹,信号弹
用途
铝是食物污染物之一
与老年性痴呆症有密切关系。
对人体的心、肝、肾功能都有损害。
铝与人
类健康
影响脑细胞功能,导致记忆力下降,思维能力迟钝。
1989年正式将铝确定为食品污染物而加以控制,提出成年人每天允许铝摄入量为60
mg。
世界每年从废铝回收的铝量约为400万吨,相当于每年铝产量的25%左右。
铝的再生-“新世纪材料的亮点”
生产1吨再生铝与新生产1吨铝相比较
类别
优点
能源消耗
能耗仅为新铝生产的2.6%
水
可节约10.5吨
固体材料
少用11吨
CO2
比电解铝时少排放91%
废液、废渣
少处理1.9吨
①在一次国宴上,大臣们用的是金制餐具,而拿破仑用的是铝制餐具,令在场的贵妇人们羡慕不已。
②1889年伦敦化学会把铝制的花瓶和杯子作为贵重的礼物送给门捷列夫,表彰他发现了元素周期律为人类作出的巨大贡献。
化学史
Al
与
NaOH
溶液的反应实质
【例
1】Al
溶于
NaOH
溶液中,当有
3
mol
的电子发生了
转移,作氧化剂的
H2O
的物质的量为(
)
C
A.1
mol
B.2
mol
C.3
mol
D.6
mol
【配对训练】
1.Al
溶于
NaOH
溶液中,当有
6
mol
H2O
作氧化剂时,电
子发生了转移的物质的量为(
)
B
A.3
mol
B.6
mol
C.12
mol
D.18
mol
解析:由
Al
与
NaOH
反应实质可知:6
mol
H2O
作氧化剂
时,电子发生了转移的物质的量为
6
mol。
铝的性质及与酸、碱反应的有关计算
【例2】相同质量的两块铝,分别与足量的稀
H2SO4和
NaOH
溶液反应,产生气体的体积比是(
)
D
A.2∶3
B.3∶2
C.2∶1
D.1∶1
【方法规律】铝与酸或碱反应的实质是铝失去电子,氢得
到电子,铝的量相同,则氢气的量相等。
1.
铝及其化合物因其有优良的性能决定了具有
下列用途:
①制包装糖果和食品用的铝箔
②制易拉罐
③制电线电缆
④制备牙膏皮
⑤制炊具
⑥铝合金门窗
⑦制飞机构件
(1)由铝的良好的延展性决定的是
(2)由铝的良好的导电导热性决定的是
(3)由铝的合金的密度小,强度高,抗腐蚀
能力强的性质决定的是
(4)铝元素在人体中积累可使人慢性中毒,在
食品污染源中加以控制的是
①②③④
③⑤
⑥⑦
①②④⑤
巩固与练习
2.(江苏高考)铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为(
)
A.1:1
B.2:1
C.3:1
D.1:3
3.
除去镁粉中混有的少量铝粉,可选用下列溶
液中的(
)
A
盐酸
B
稀硝酸
C
氨水
D
浓氢氧化钾溶液
C
D
4.甲、乙两烧杯中各盛有100mL3mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=
1:2,则加入铝粉的质量为
(
)
A
5.4g
B
3.6g
C
2.7g
D
1.8g
A
5.(上海高考)将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是(
)
A.稀硝酸
B.稀盐酸
C.硝酸铜
D.氢氧化钠
C
6.由Na、Mg、Al、Zn四种金属单质中的两种组成的混合物共12克,跟足量盐酸反应,产生5.6L
H2
(标况),由此可判断混合物中必定含有(
)
A.Na
B.Mg
C.Al
D.Zn
D
第一单元从铝土矿到铝合金
铝的性质
铝盆
导弹
飞机
铝线
铝壶
易拉罐
铝箔
银白色固体,有金属光泽
质软
熔点低
密度小(2.7g·cm-3)
良好的导电性
良好的导热性
良好的延展性
铝的物理性质
导热性
导电性
密度小
它们分别利用了铝的哪些物理性质
铝的物理性质
铝的原子结构示意图为:
K
Ca
Na
Mg
Zn
Fe
Sn
Pb
H
Cu
Hg
…
Al
结论:Al的化学性质活泼,具有较强还原性
铝的原子结构
生锈的铁锅
光洁的铝锅
根据金属活动性顺序表,铝比铁活泼,但铝为什么却不像铁那样容易被腐蚀?
1、与(O2、S、Cl2等)非金属的反应
[现象]:
铝在氧气中剧烈燃烧,放出大量的热、发出耀眼的白光。
反应方程式:
铝的化学性质
2.铝锅为什么可以用来煮饭?
答:铝具有良好的导热性能、常温下铝的表面被氧化,
生成一层致密氧化物薄膜。
思维拓展
2Al+6HCl=
2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
铝条未发生明显变化
铝条未发生明显变化
铝条上产生大量无色的气泡
铝条上产生大量无色的气泡
[活动与探究]
与铝反应的物质
实验现象
化学方程式
浓硝酸
浓硫酸
盐酸
氢氧化钠溶液
在上述反应中,铝表现出哪些性质?
[交流与讨论]
常温下,铝能与稀盐酸、氢氧化钠溶液反应放出气体。
铝放入浓硫酸、浓硝酸中均未发生明显变化。
(常温下,铝遇浓硫酸、浓硝酸时在表面生成致密的氧化膜阻止了反应的继续进行而发生钝化)
2Al+6HCl=
2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
原因?
(2)
(1)
2.与酸反应
A.与非氧化性酸反应
B.与强氧化性酸反应较复杂,但不生成
氢气
2Al+6H+
==
2Al3++3H2
↑
C.与冷的浓硫酸、浓硝酸钝化
铝的化学性质
运输浓硫酸的铝槽车
3.铝与强碱溶液反应
4.铝与硫酸铜等盐溶液反应
铝的化学性质
标出铝与氢氧化钠溶液反应的电子转移情况。
2Al+6H2O+2NaOH==2NaAlO2+3H2↑+4H2O
失2×3
e-
得6×e-
[试试看]:
2Al+6H2O+2OH-==2AlO2-
+3H2↑+
4H2O
6e-
铝单质与碱的反应
(3)电子转移情况
4、与某些氧化物反应
[现象]:
放出大量的热、发出耀眼的光芒、有熔融物生成。
—铝热反应
铝的化学性质
反应生成的铁熔化,温度可达3000℃。
用途:①冶炼难熔的金属;②焊接钢轨。
铝热剂:
铝粉和某些金属氧化物(Fe2O3、Fe3O4、V2O5、Cr2O3、MnO2)组成的混合物。
铝热反应用于焊接钢轨
铝热反应用于“定向爆破”
,主要是利用铝热反应熔断钢筋
使楼房定向倒塌.
[试一试]:
写出Al分别与Cr2O3
、MnO2
、V2O5
的反应
铝热反应
1.铝不仅可与氧化铁发生铝热反应,用其他金属氧化物,
如
V2O5、Cr2O3、MnO2
等代替氧化铁也可发生铝热反应。
2Al+Fe2O3
4Al+3MnO2
2Al+Cr2O3
2Fe+Al2O3(可用于野外金属铁的焊接、切割)
3Mn+2Al2O3(可用于冶炼金属锰)
2Cr+Al2O3(可用于冶炼金属铬)
2.通过铝热反应只能还原得到金属性比铝弱的金属单质,
而不能还原得到金属性比铝强的金属单质,如铝和氧化镁不能
发生反应。
3.铝制品能否长期存放食物?为什么?
思维拓展
因为食物中含有的酸、碱、盐会与氧化铝、铝反应,腐蚀铝制品。
清洗铝锅不要用钢丝等磨损性大的东西擦洗。
不能
一、铝的物理性质
二、铝的化学性质:
1、与非金属单质反应
2、与酸溶液反应
3、与盐溶液反应
4、与强碱溶液反应
5、与某些金属氧化物反应
特性
通性
还原性
小
结
密度小,强度高、塑性好、制造工艺简单、
建筑业、交通运输业、电子行业
导电性
还原性
铝的用途
成本低、抗腐蚀能力强
燃烧弹,信号弹
用途
燃烧弹,信号弹
用途
铝是食物污染物之一
与老年性痴呆症有密切关系。
对人体的心、肝、肾功能都有损害。
铝与人
类健康
影响脑细胞功能,导致记忆力下降,思维能力迟钝。
1989年正式将铝确定为食品污染物而加以控制,提出成年人每天允许铝摄入量为60
mg。
世界每年从废铝回收的铝量约为400万吨,相当于每年铝产量的25%左右。
铝的再生-“新世纪材料的亮点”
生产1吨再生铝与新生产1吨铝相比较
类别
优点
能源消耗
能耗仅为新铝生产的2.6%
水
可节约10.5吨
固体材料
少用11吨
CO2
比电解铝时少排放91%
废液、废渣
少处理1.9吨
①在一次国宴上,大臣们用的是金制餐具,而拿破仑用的是铝制餐具,令在场的贵妇人们羡慕不已。
②1889年伦敦化学会把铝制的花瓶和杯子作为贵重的礼物送给门捷列夫,表彰他发现了元素周期律为人类作出的巨大贡献。
化学史
Al
与
NaOH
溶液的反应实质
【例
1】Al
溶于
NaOH
溶液中,当有
3
mol
的电子发生了
转移,作氧化剂的
H2O
的物质的量为(
)
C
A.1
mol
B.2
mol
C.3
mol
D.6
mol
【配对训练】
1.Al
溶于
NaOH
溶液中,当有
6
mol
H2O
作氧化剂时,电
子发生了转移的物质的量为(
)
B
A.3
mol
B.6
mol
C.12
mol
D.18
mol
解析:由
Al
与
NaOH
反应实质可知:6
mol
H2O
作氧化剂
时,电子发生了转移的物质的量为
6
mol。
铝的性质及与酸、碱反应的有关计算
【例2】相同质量的两块铝,分别与足量的稀
H2SO4和
NaOH
溶液反应,产生气体的体积比是(
)
D
A.2∶3
B.3∶2
C.2∶1
D.1∶1
【方法规律】铝与酸或碱反应的实质是铝失去电子,氢得
到电子,铝的量相同,则氢气的量相等。
1.
铝及其化合物因其有优良的性能决定了具有
下列用途:
①制包装糖果和食品用的铝箔
②制易拉罐
③制电线电缆
④制备牙膏皮
⑤制炊具
⑥铝合金门窗
⑦制飞机构件
(1)由铝的良好的延展性决定的是
(2)由铝的良好的导电导热性决定的是
(3)由铝的合金的密度小,强度高,抗腐蚀
能力强的性质决定的是
(4)铝元素在人体中积累可使人慢性中毒,在
食品污染源中加以控制的是
①②③④
③⑤
⑥⑦
①②④⑤
巩固与练习
2.(江苏高考)铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为(
)
A.1:1
B.2:1
C.3:1
D.1:3
3.
除去镁粉中混有的少量铝粉,可选用下列溶
液中的(
)
A
盐酸
B
稀硝酸
C
氨水
D
浓氢氧化钾溶液
C
D
4.甲、乙两烧杯中各盛有100mL3mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=
1:2,则加入铝粉的质量为
(
)
A
5.4g
B
3.6g
C
2.7g
D
1.8g
A
5.(上海高考)将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是(
)
A.稀硝酸
B.稀盐酸
C.硝酸铜
D.氢氧化钠
C
6.由Na、Mg、Al、Zn四种金属单质中的两种组成的混合物共12克,跟足量盐酸反应,产生5.6L
H2
(标况),由此可判断混合物中必定含有(
)
A.Na
B.Mg
C.Al
D.Zn
D
