江苏省苏州市2019-2020学年高二下学期期末考试化学试题
文档属性
| 名称 | 江苏省苏州市2019-2020学年高二下学期期末考试化学试题 |  | |
| 格式 | docx | ||
| 文件大小 | 604.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-03 22:14:03 | ||
图片预览



文档简介
1248410010718800江苏省苏州市2019-2020学年高二下学期期末考试化学试题
注意事项:考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共8页,包含选择题(第1题-第12题,共32分)、非选择题(第13题-第18题,共68分)两部分。本次考试满分为100分,考试时间为90分钟。考试结束后,请将答题纸交回。
2.答题前,请您务必将自己的学校、班级、姓名、调研序列号等用书写黑色字迹的0.5亳米签字笔填写在答题纸上。
3.请认真核对答题纸表头规定填写或填涂的项目是否准确。
4.作答选择题必须用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,请用橡皮擦干净后,再选涂其他答案。作答非选择题必须用书写黑色字迹的0.5毫米签字笔写在答题纸上指定位置,在其他位置作答一律无效。
相对原子质量:H-1 ?C-12 ?N-14? O-16? Na-23 ?Cl-35.5?K-39
选择题 (32分)
单项选择题:本题包括8小题,每小题2分,?共计16分。每小题只有一个选项符合题意。
1.下列有关化学用语表示正确的是
A.N2H4的结构式:
B.Fe?的原子结构示意图:
C.SO2?分子的空间结构模型:
D.基态N原子的轨道表示式:
2.室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1?mol/LNaOH溶液:Na+、?K+、?CO32-、AlO2-
B.0.1?mol/L?Fe2(SO4)3溶液:Cu2+、?NH4+、SCN-、SO42-
C.0.1?mol/L Na2S溶液:?Na+、?K+、?ClO-、OH-
D.0.1?mol/L?NH4HCO3溶液:Ba2+、?K+、OH-、NO3-
3.下列指定反应的离子方程式正确的是
A.钠与水反应:Na+?H2O=Na+?+OH-?+H2↑
B.向AlCl3溶液中加入过量氨水:Al3++?4NH3·H2O?=?AlO2-?+?4NH4?++?2H2O
C.FeCl3溶液净水原理:Fe3+?+?3H2O=Fe(OH)3↓+3H+
D.用饱和Na2CO3溶液处理重晶石:BaSO4+CO32-=?BaCO3+?SO42-
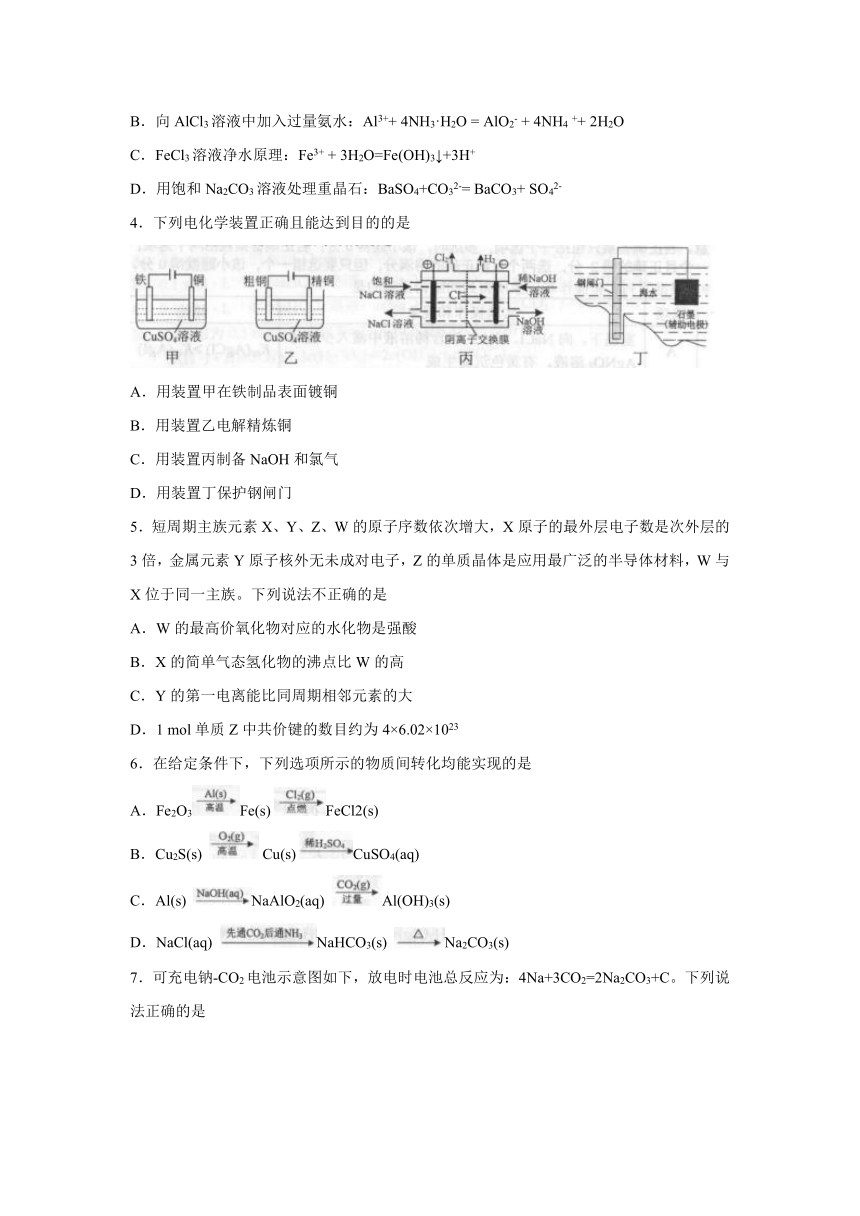
4.下列电化学装置正确且能达到目的的是
A.用装置甲在铁制品表面镀铜
B.用装置乙电解精炼铜
C.用装置丙制备NaOH和氯气
D.用装置丁保护钢闸门
5.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是次外层的3倍,金属元素Y原子核外无未成对电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法不正确的是
A.W的最高价氧化物对应的水化物是强酸
B.X的简单气态氢化物的沸点比W的高
C.Y的第一电离能比同周期相邻元素的大
D.1 mol单质Z中共价键的数目约为4×6.02×1023
6.在给定条件下,下列选项所示的物质间转化均能实现的是
A.Fe2O3Fe(s)?FeCl2(s)
B.Cu2S(s) ?Cu(s)?CuSO4(aq)
C.Al(s) NaAlO2(aq) Al(OH)3(s)
D.NaCl(aq) NaHCO3(s) Na2CO3(s)
7.可充电钠-CO2电池示意图如下,放电时电池总反应为:4Na+3CO2=2Na2CO3+C。下列说法正确的是
A.该电池也可用水作溶剂
B.放电时,正极的电极反应为:4Na++?3CO2+4e-=2Na2CO3+?C
C.充电时,钠箔与外接电源的正极相连
D.每吸收1 mol CO2,理论上电路中转移4 mol e-
8.下列说法正确的是
A.工业合成氨采用500°C左右的高温,目的是提高氨的产率
B.铅蓄电池放电时的负极和充电时的阳极均发生还原反应
C.保存FeSO4溶液时,应在其中加入稀HNO3以抑制Fe2+水解
D.工业上用蒸干MgCl2溶液的方法制取无水氯化镁
不定项选择题:本题包括4小题,每小题4分,共计16分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
9.根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
室温下,向NaCl、Nal的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成
Ksp(AgCl)>Ksp(AgI)
B
室温下,向溶液X中滴加少量双氧水,再加入KSCN溶液,变红
溶液X中一定含Fe2+
C
用洁净铂丝蘸取溶液Y在火焰上灼烧,火焰呈黄色
溶液Y中含Na+不含K+
D
室温测定浓度均为0.1?mol/L的CH3COONa溶液和NaNO2溶液的pH,CH3COONa?溶液的pH大
HNO2电离出H+的能力比CH3COOH强
10.下列图示或根据图示所得出的结论正确的是
A.图甲表示相同pH的盐酸和醋酸加水稀释过程中pH的变化,则曲线a代表醋酸
B.图乙表示温度不变,向0.1?mol/LNH4Cl溶液中滴加0.1?mol/L盐酸时,溶液中随盐酸体积的变化关系
C.图丙表示密闭容器中CH4(g)+H2O(g)CO(g)+3H2(g)到达平衡时,CH4?的平衡转化率与压强、温度的变化关系曲线,说明p1<p2
D.图丁表示0.100?mol/L?NaOH溶液滴定20.00?mL?01000 mol/L醋酸溶液滴定曲线
11.25℃时,?将氨水与氯化铵溶液混合得到c(NH3·H2O)+?c(NH4+)=0.1?mol/L的溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如下图所示。下列有关离子浓度关系叙述一定正确的是
A.W点表示溶液中:c(NH3·H2O)+c(H+)=c(Cl-?)+c(OH-)
B.pH=7.0?溶液中:c(NH3·H2O)>c(NH4+)>c(H+)= c(OH-)
C.pH=10.5?溶液中:c(Cl-?)+c(OH-)+c(NH3·H2O)<0.1?mol/L
D.向W点所表示的1 L溶液中加入0.05?mol?NaOH固体(忽略溶液体积变化)?:c(Na+)>c(Cl-)>c(OH-)>c(NH4+)
12.在3个初始温度均为T?℃的密闭容器中发生反应:2SO2(g)?+?O2(g) 2SO3(g)?(正反应放热)。下列说法正确的是
容器编号
容器类型
初始体积
起始物质的量/mol
平衡时SO3的物质的量/mol
SO2
O2
SO3
I
恒温恒容
1.0 L
2
1
0
1.6
II
绝热恒容
1.0 L
2
1
0
a
III
恒温恒压
0.5 L
0
0
1
b
A.a>1.6
B.b<0.8
C.平衡时v正(SO2):v(I)D.若起始时向容器I中充入1.0?mol?SO2?(g)、0.20?mol?O2(g)和4.0?mol?SO3(g),则反应将向正反应方向进行
非选择题 (68分)
13.?(8分)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1。在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,原理为:2XCl+2CO+2H2O=X2Cl2·2CO·2H2O
(1)X原子基态核外电子排布式为__________。
(2)C、H、O三种元素的电负性由大到小的顺序为__________。
(3)H2O中氧原子的轨道杂化类型为______________。
(4)X2Cl2·2CO·2H2O是一种配合物,结构如题13图-1所示,每个X原子能与其它原子形成3个配位键,在图中用“→”标出相应的配位键__________。CO与N2分子的结构相似,则1?mol?X2Cl2·2CO·2H2O含有σ键的数目为__________。
(5)化合物XCl晶体的晶胞如题13图-2所示,距离每个X离子最近的Cl-的个数为___________。
14.(10?分)汽车尾气中含有CO、NOx等污染物,减少汽车尾气污染是重要研究课题。
(1)己知:?N2(g)+O2(g)=2NO(g) △H=?+?180.5?kJ/mol
2C(s)?+?O2(g)==?2CO(g) △H=?-?221.0?kJ/mol
C(s)?+?O2(g)=CO2(g) △H=?-?393.5?kJ/mol
2CO(g)+?2NO(g)=N2(g)+2CO2(g)?△H=?_______?kJ/mol。
(2)某温度下,为探究2CO(g)+2NO(g)N2(g)+2CO2(g)的反应速率,用气体传感器测得不同时间的CO和NO浓度如下表:
时间/s
0
1
2
3
4
5
c(CO)/10-4?mol/L
36.0
30.5
28.5
27.5
27.0
27.0
c(NO)/10-4?mol/L
10.0
4.50
2.50
1.50
1.00
1.00
①前2 s内,上述反应的平均反应速率v(NO)=_____。
②该温度下,上述反应的平衡常数K=________。
③对于上述反应,下列叙述正确的是______(填字母)?。
A.反应在低温下能自发进行
B.当2v正(CO)=v逆(N2)时,反应达到平衡状态
C.研究反应的高效催化剂意义重大
D.反应达到平衡时,CO、NO的转化率相等
(3)CO浓度分析仪以燃料电池为工作原理,其装置如题14图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。写出多孔电极a的电极反应式:___________。
15.(11分)蓝色钾盐水合物KaCub(C2O4)c·H2O?(铜元素为+2价)的组成可通过下列实验确定:
步骤①:称取一定质量的样品置于锥形瓶中,加入适量2?mol/L稀硫酸,微热使样品溶解。再加入30?mL水加热,用0.0200?mol/L?KMnO4溶液滴定至终点,消耗KMnO4溶液12.00?mL?(MnO4-的还原产物为Mn2+)。
步骤②:充分加热滴定后的溶液,冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI,发生反应2Cu2++4I-?=?2CuI↓+?I2。
步骤③:加入少量淀粉溶液作指示剂,用0.0200?mol/L?Na2S2O3标准溶液滴定至终点,消耗标准溶液15.00?mL。发生反应I2+?2S2O32-?=2I-?+?S4O62-
(1)若步骤②中未对滴定后的溶液进行加热,则测出的Cu2+的物质的量将______(填“偏大”、“偏小”?或“不变”)。
(2)步骤③中滴定终点的现象是________ 。
(3)通过计算确定a:b:c=______。?(?写出计算过程)
16.(14?分)Na2CO3和NaHCO3在生活和生产中应用广泛。
(1)室温时下列指定溶液中微粒物质的量浓度关系正确的是_______?(填字母)。
A.0.1?mol/L的Na2CO3溶液:?c(Na+)+c(H+)=?c(OH-)+c(HCO3-)+c(CO32-?)
B.0.1?mol/L的NaHCO3溶液:c(Na+)=c(CO32-?)+c(HCO3-)+c(H2CO3)
C.0.1mol/L的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-?)>c(H2CO3)
D.浓度均为0.1?mol/L的Na2CO3和NaHCO3混合溶液:2c(H+)+c(HCO3-)+3c(H2CO3)=2c(OH-)+c(CO32-?)
(2)水垢中的CaSO4可用Na2CO3溶液处理。当两种沉淀共存时,=_____。 [Ksp(CaCO3)?=5.0×10-9、Ksp(CaSO4)=7.0×10-9]]
(3)25℃时,碳酸及其盐溶液中含碳元素微粒的分布分数随溶液pH变化的关系如题16图所示。
①纯碱溶液去油污的原理是_______(?用离子方程式表示)。25℃时,?该反应的平衡常数表示为K,则pKh≈_______?(pKh=-lgKh)。
②25℃时,下列三种溶液
A.0.1?mol/L的NaHCO3溶液;
B.0.1??mol/L的Na2CO3溶液;
C.0.1??mol/L的NaCN溶液。
pH由大到小的顺序为________(填字母)?。[25℃时,?Ka(HCN)=10-9.3]
(4)NaHCO3可用于铝土矿(主要成分为Al2O3,含SiO2和Fe2O3)制铝。流程如下:
①滤渣中除含SiO2转化得到的铝硅酸钠外,还含__________ (填化学式)?。
②写出“沉淀”步骤发生反应的离子方程式__________和_________。
17.(12分)铜制印刷电路板蚀刻液的选择及再生回收是研究热点。
(1)用HCl-FeCl3溶液作蚀刻液
①该溶液蚀刻铜板时发生主要反应的离子方程式为_________。
②从废液中可回收铜并使蚀刻液再生,再生所用的试剂有Fe和_________。(填化学式)
(2)用HCl-CuCl2溶液作蚀刻液
蚀刻铜后的废液中含Cu+,题17图-1所示方法可使蚀刻液再生并回收金属铜。第一步BDD电极上生成强氧化性的氢氧自由基(HO-):H2O-e-=?HO※+H+;
第二步HO-氧化Cu+实现CuCl2蚀刻液再生:_________(填离子方程式)?。
(3)用碱性CuCl2溶液(用NH3·H2O-NH4Cl调节pH)作蚀刻液
原理为:CuCl2+?4NH3·H2O=Cu(NH3)4Cl2+?4H2O
Cu(NH3)4Cl2+?Cu=2Cu(NH3)2Cl
①过程中只须及时补充NH3·H2O和NH4Cl就可以使蚀刻液再生,保持蚀刻能力。蚀刻液再生过程中作氧化剂的是_________(填化学式)?。
②50°C,c(CuCl2)=2.5?mol/L,pH对蚀刻速率的影响如题17图-2所示。适宜pH约为8.3~9.0,pH过小或过大,蚀刻速率均会减小的原因是__________。
18.(13分)?CO2是廉价的碳资源,将其甲烷化具有重要意义。
热化学转化法:原理为CO2(g)+4H2(g)CH4(g)+2H2O(g)? △H
(1)每生成0.4?mol CH4 (g),放出66?kJ的热量。则△H =_____________。
(2)其他条件不变,压强对CO2的转化率及CH4的选择性的影响如题18图-1所示。
CO2甲烷化反应选择0.1MPa?(1个大气压)而不选择更高压强的原因是_______。
电化学转化法:在多晶Cu催化下,电解CO2制备CH4的原理如题18图-2所示。
(3)铂电极上产生的气体为_____________(填化学式)?。
(4)电解结束时阴、阳极室的KHCO3溶液的浓度基本保持不变。在电解过程中,HCO3-移向_________?(填“阴”或“阳”)极室。写出阴极的电极反应式______ 。
(5)电解过程中应持续通入CO2,同时温度应控制在10°C左右,使CO2优先于H+在电极上发生反应。该电解过程不在室温下进行的原因是_________。
注意事项:考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共8页,包含选择题(第1题-第12题,共32分)、非选择题(第13题-第18题,共68分)两部分。本次考试满分为100分,考试时间为90分钟。考试结束后,请将答题纸交回。
2.答题前,请您务必将自己的学校、班级、姓名、调研序列号等用书写黑色字迹的0.5亳米签字笔填写在答题纸上。
3.请认真核对答题纸表头规定填写或填涂的项目是否准确。
4.作答选择题必须用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,请用橡皮擦干净后,再选涂其他答案。作答非选择题必须用书写黑色字迹的0.5毫米签字笔写在答题纸上指定位置,在其他位置作答一律无效。
相对原子质量:H-1 ?C-12 ?N-14? O-16? Na-23 ?Cl-35.5?K-39
选择题 (32分)
单项选择题:本题包括8小题,每小题2分,?共计16分。每小题只有一个选项符合题意。
1.下列有关化学用语表示正确的是
A.N2H4的结构式:
B.Fe?的原子结构示意图:
C.SO2?分子的空间结构模型:
D.基态N原子的轨道表示式:
2.室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1?mol/LNaOH溶液:Na+、?K+、?CO32-、AlO2-
B.0.1?mol/L?Fe2(SO4)3溶液:Cu2+、?NH4+、SCN-、SO42-
C.0.1?mol/L Na2S溶液:?Na+、?K+、?ClO-、OH-
D.0.1?mol/L?NH4HCO3溶液:Ba2+、?K+、OH-、NO3-
3.下列指定反应的离子方程式正确的是
A.钠与水反应:Na+?H2O=Na+?+OH-?+H2↑
B.向AlCl3溶液中加入过量氨水:Al3++?4NH3·H2O?=?AlO2-?+?4NH4?++?2H2O
C.FeCl3溶液净水原理:Fe3+?+?3H2O=Fe(OH)3↓+3H+
D.用饱和Na2CO3溶液处理重晶石:BaSO4+CO32-=?BaCO3+?SO42-
4.下列电化学装置正确且能达到目的的是
A.用装置甲在铁制品表面镀铜
B.用装置乙电解精炼铜
C.用装置丙制备NaOH和氯气
D.用装置丁保护钢闸门
5.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是次外层的3倍,金属元素Y原子核外无未成对电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法不正确的是
A.W的最高价氧化物对应的水化物是强酸
B.X的简单气态氢化物的沸点比W的高
C.Y的第一电离能比同周期相邻元素的大
D.1 mol单质Z中共价键的数目约为4×6.02×1023
6.在给定条件下,下列选项所示的物质间转化均能实现的是
A.Fe2O3Fe(s)?FeCl2(s)
B.Cu2S(s) ?Cu(s)?CuSO4(aq)
C.Al(s) NaAlO2(aq) Al(OH)3(s)
D.NaCl(aq) NaHCO3(s) Na2CO3(s)
7.可充电钠-CO2电池示意图如下,放电时电池总反应为:4Na+3CO2=2Na2CO3+C。下列说法正确的是
A.该电池也可用水作溶剂
B.放电时,正极的电极反应为:4Na++?3CO2+4e-=2Na2CO3+?C
C.充电时,钠箔与外接电源的正极相连
D.每吸收1 mol CO2,理论上电路中转移4 mol e-
8.下列说法正确的是
A.工业合成氨采用500°C左右的高温,目的是提高氨的产率
B.铅蓄电池放电时的负极和充电时的阳极均发生还原反应
C.保存FeSO4溶液时,应在其中加入稀HNO3以抑制Fe2+水解
D.工业上用蒸干MgCl2溶液的方法制取无水氯化镁
不定项选择题:本题包括4小题,每小题4分,共计16分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
9.根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
室温下,向NaCl、Nal的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成
Ksp(AgCl)>Ksp(AgI)
B
室温下,向溶液X中滴加少量双氧水,再加入KSCN溶液,变红
溶液X中一定含Fe2+
C
用洁净铂丝蘸取溶液Y在火焰上灼烧,火焰呈黄色
溶液Y中含Na+不含K+
D
室温测定浓度均为0.1?mol/L的CH3COONa溶液和NaNO2溶液的pH,CH3COONa?溶液的pH大
HNO2电离出H+的能力比CH3COOH强
10.下列图示或根据图示所得出的结论正确的是
A.图甲表示相同pH的盐酸和醋酸加水稀释过程中pH的变化,则曲线a代表醋酸
B.图乙表示温度不变,向0.1?mol/LNH4Cl溶液中滴加0.1?mol/L盐酸时,溶液中随盐酸体积的变化关系
C.图丙表示密闭容器中CH4(g)+H2O(g)CO(g)+3H2(g)到达平衡时,CH4?的平衡转化率与压强、温度的变化关系曲线,说明p1<p2
D.图丁表示0.100?mol/L?NaOH溶液滴定20.00?mL?01000 mol/L醋酸溶液滴定曲线
11.25℃时,?将氨水与氯化铵溶液混合得到c(NH3·H2O)+?c(NH4+)=0.1?mol/L的溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如下图所示。下列有关离子浓度关系叙述一定正确的是
A.W点表示溶液中:c(NH3·H2O)+c(H+)=c(Cl-?)+c(OH-)
B.pH=7.0?溶液中:c(NH3·H2O)>c(NH4+)>c(H+)= c(OH-)
C.pH=10.5?溶液中:c(Cl-?)+c(OH-)+c(NH3·H2O)<0.1?mol/L
D.向W点所表示的1 L溶液中加入0.05?mol?NaOH固体(忽略溶液体积变化)?:c(Na+)>c(Cl-)>c(OH-)>c(NH4+)
12.在3个初始温度均为T?℃的密闭容器中发生反应:2SO2(g)?+?O2(g) 2SO3(g)?(正反应放热)。下列说法正确的是
容器编号
容器类型
初始体积
起始物质的量/mol
平衡时SO3的物质的量/mol
SO2
O2
SO3
I
恒温恒容
1.0 L
2
1
0
1.6
II
绝热恒容
1.0 L
2
1
0
a
III
恒温恒压
0.5 L
0
0
1
b
A.a>1.6
B.b<0.8
C.平衡时v正(SO2):v(I)
非选择题 (68分)
13.?(8分)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1。在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,原理为:2XCl+2CO+2H2O=X2Cl2·2CO·2H2O
(1)X原子基态核外电子排布式为__________。
(2)C、H、O三种元素的电负性由大到小的顺序为__________。
(3)H2O中氧原子的轨道杂化类型为______________。
(4)X2Cl2·2CO·2H2O是一种配合物,结构如题13图-1所示,每个X原子能与其它原子形成3个配位键,在图中用“→”标出相应的配位键__________。CO与N2分子的结构相似,则1?mol?X2Cl2·2CO·2H2O含有σ键的数目为__________。
(5)化合物XCl晶体的晶胞如题13图-2所示,距离每个X离子最近的Cl-的个数为___________。
14.(10?分)汽车尾气中含有CO、NOx等污染物,减少汽车尾气污染是重要研究课题。
(1)己知:?N2(g)+O2(g)=2NO(g) △H=?+?180.5?kJ/mol
2C(s)?+?O2(g)==?2CO(g) △H=?-?221.0?kJ/mol
C(s)?+?O2(g)=CO2(g) △H=?-?393.5?kJ/mol
2CO(g)+?2NO(g)=N2(g)+2CO2(g)?△H=?_______?kJ/mol。
(2)某温度下,为探究2CO(g)+2NO(g)N2(g)+2CO2(g)的反应速率,用气体传感器测得不同时间的CO和NO浓度如下表:
时间/s
0
1
2
3
4
5
c(CO)/10-4?mol/L
36.0
30.5
28.5
27.5
27.0
27.0
c(NO)/10-4?mol/L
10.0
4.50
2.50
1.50
1.00
1.00
①前2 s内,上述反应的平均反应速率v(NO)=_____。
②该温度下,上述反应的平衡常数K=________。
③对于上述反应,下列叙述正确的是______(填字母)?。
A.反应在低温下能自发进行
B.当2v正(CO)=v逆(N2)时,反应达到平衡状态
C.研究反应的高效催化剂意义重大
D.反应达到平衡时,CO、NO的转化率相等
(3)CO浓度分析仪以燃料电池为工作原理,其装置如题14图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。写出多孔电极a的电极反应式:___________。
15.(11分)蓝色钾盐水合物KaCub(C2O4)c·H2O?(铜元素为+2价)的组成可通过下列实验确定:
步骤①:称取一定质量的样品置于锥形瓶中,加入适量2?mol/L稀硫酸,微热使样品溶解。再加入30?mL水加热,用0.0200?mol/L?KMnO4溶液滴定至终点,消耗KMnO4溶液12.00?mL?(MnO4-的还原产物为Mn2+)。
步骤②:充分加热滴定后的溶液,冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI,发生反应2Cu2++4I-?=?2CuI↓+?I2。
步骤③:加入少量淀粉溶液作指示剂,用0.0200?mol/L?Na2S2O3标准溶液滴定至终点,消耗标准溶液15.00?mL。发生反应I2+?2S2O32-?=2I-?+?S4O62-
(1)若步骤②中未对滴定后的溶液进行加热,则测出的Cu2+的物质的量将______(填“偏大”、“偏小”?或“不变”)。
(2)步骤③中滴定终点的现象是________ 。
(3)通过计算确定a:b:c=______。?(?写出计算过程)
16.(14?分)Na2CO3和NaHCO3在生活和生产中应用广泛。
(1)室温时下列指定溶液中微粒物质的量浓度关系正确的是_______?(填字母)。
A.0.1?mol/L的Na2CO3溶液:?c(Na+)+c(H+)=?c(OH-)+c(HCO3-)+c(CO32-?)
B.0.1?mol/L的NaHCO3溶液:c(Na+)=c(CO32-?)+c(HCO3-)+c(H2CO3)
C.0.1mol/L的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-?)>c(H2CO3)
D.浓度均为0.1?mol/L的Na2CO3和NaHCO3混合溶液:2c(H+)+c(HCO3-)+3c(H2CO3)=2c(OH-)+c(CO32-?)
(2)水垢中的CaSO4可用Na2CO3溶液处理。当两种沉淀共存时,=_____。 [Ksp(CaCO3)?=5.0×10-9、Ksp(CaSO4)=7.0×10-9]]
(3)25℃时,碳酸及其盐溶液中含碳元素微粒的分布分数随溶液pH变化的关系如题16图所示。
①纯碱溶液去油污的原理是_______(?用离子方程式表示)。25℃时,?该反应的平衡常数表示为K,则pKh≈_______?(pKh=-lgKh)。
②25℃时,下列三种溶液
A.0.1?mol/L的NaHCO3溶液;
B.0.1??mol/L的Na2CO3溶液;
C.0.1??mol/L的NaCN溶液。
pH由大到小的顺序为________(填字母)?。[25℃时,?Ka(HCN)=10-9.3]
(4)NaHCO3可用于铝土矿(主要成分为Al2O3,含SiO2和Fe2O3)制铝。流程如下:
①滤渣中除含SiO2转化得到的铝硅酸钠外,还含__________ (填化学式)?。
②写出“沉淀”步骤发生反应的离子方程式__________和_________。
17.(12分)铜制印刷电路板蚀刻液的选择及再生回收是研究热点。
(1)用HCl-FeCl3溶液作蚀刻液
①该溶液蚀刻铜板时发生主要反应的离子方程式为_________。
②从废液中可回收铜并使蚀刻液再生,再生所用的试剂有Fe和_________。(填化学式)
(2)用HCl-CuCl2溶液作蚀刻液
蚀刻铜后的废液中含Cu+,题17图-1所示方法可使蚀刻液再生并回收金属铜。第一步BDD电极上生成强氧化性的氢氧自由基(HO-):H2O-e-=?HO※+H+;
第二步HO-氧化Cu+实现CuCl2蚀刻液再生:_________(填离子方程式)?。
(3)用碱性CuCl2溶液(用NH3·H2O-NH4Cl调节pH)作蚀刻液
原理为:CuCl2+?4NH3·H2O=Cu(NH3)4Cl2+?4H2O
Cu(NH3)4Cl2+?Cu=2Cu(NH3)2Cl
①过程中只须及时补充NH3·H2O和NH4Cl就可以使蚀刻液再生,保持蚀刻能力。蚀刻液再生过程中作氧化剂的是_________(填化学式)?。
②50°C,c(CuCl2)=2.5?mol/L,pH对蚀刻速率的影响如题17图-2所示。适宜pH约为8.3~9.0,pH过小或过大,蚀刻速率均会减小的原因是__________。
18.(13分)?CO2是廉价的碳资源,将其甲烷化具有重要意义。
热化学转化法:原理为CO2(g)+4H2(g)CH4(g)+2H2O(g)? △H
(1)每生成0.4?mol CH4 (g),放出66?kJ的热量。则△H =_____________。
(2)其他条件不变,压强对CO2的转化率及CH4的选择性的影响如题18图-1所示。
CO2甲烷化反应选择0.1MPa?(1个大气压)而不选择更高压强的原因是_______。
电化学转化法:在多晶Cu催化下,电解CO2制备CH4的原理如题18图-2所示。
(3)铂电极上产生的气体为_____________(填化学式)?。
(4)电解结束时阴、阳极室的KHCO3溶液的浓度基本保持不变。在电解过程中,HCO3-移向_________?(填“阴”或“阳”)极室。写出阴极的电极反应式______ 。
(5)电解过程中应持续通入CO2,同时温度应控制在10°C左右,使CO2优先于H+在电极上发生反应。该电解过程不在室温下进行的原因是_________。
同课章节目录
