鲁教版九年级下册化学8.1 海洋化学资源 课件(共26张PPT)
文档属性
| 名称 | 鲁教版九年级下册化学8.1 海洋化学资源 课件(共26张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-03 16:14:56 | ||
图片预览








文档简介
(共26张PPT)
第八单元第一节
海洋化学资源
化学资源
海底矿物资源
海洋生物资源
海洋动力资源
预习检测区答案
1.(1)B(2)C(3)A(4)D
2.化学资源
矿物资源
生物资源
动力资源
3.可燃冰
4.(略)参考p32最后一段
5.H2O
O
Na+
Cl-
NaCl
海洋化学资源
1.海水中含量最多的物质是水。
2.海水中含量最多的盐是氯化钠。
3.含量最多的金属离子是钠离子,其次是镁离子。
4.海水中含量最多的离子是氯离子。
你认为从海洋中可以获取哪些化学物质?
照明弹
火箭
飞机
导弹
如何将海水中的镁离子变成金属镁?
活动探究(一)
?
工业上利用海水制镁的生产过程,请同学们自主学习,再小组合作学习。
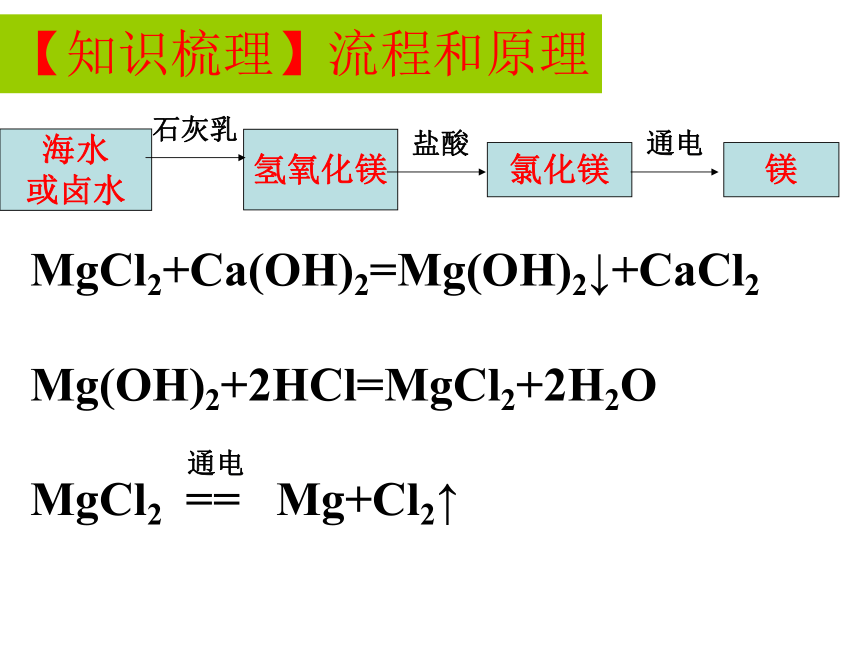
海水或卤水
氢氧化镁
氯化镁
镁
海水制镁的流程及原理
海水
或卤水
氢氧化镁
氯化镁
镁
【知识梳理】流程和原理
1
2
海水中已经含有氯化镁了,直接电解海水不就行了吗?
从海水中提取镁的关键步骤是电解熔融的纯净的氯化镁
1.将海水中的镁离子富集起来。
2.除去海水中的其它杂质,获得比较纯净的氯化镁。
?
?
电解
海水中含有MgCl2→Mg(OH)2沉淀→纯净的MgCl2→Mg
友情提示:NaOH的市场平均价格是2320元/吨,Ca(OH)2的市场平均价格是1500元/吨,海边的贝壳的主要成份是CaCO3。
1.将海水中的镁离子富集起来。
反思交流
海水提镁的原理:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl=MgCl2+2H2O
MgCl2
==
Mg+Cl2↑
通电
2.除去海水中的其它杂质,获得比较纯净的氯化镁。
跟综练习
1.下列所示的从海水中提取镁的过程所发生的化学变化,涉
及到的基本反应类型是(
)。
海水或卤水
氢氧化镁
氯化镁
镁
A.化合反应
B.分解反应
C.复分解反应
D.置换反应
B、C
2.镁是一种用途广泛的金属,世界上60℅的金属镁是从海水中提取出来的,利用海水制备金属镁的流程如下图
(1)贝壳主要成分的化学式是
;操作a的名称是
。
(2)写出第①、②步反应的化学方程式
(3)写出第③步反应的化学方程式
。
(4)要使MgCl2完全转化为沉淀,加入试剂①的量应___
(5)上述转化过程中未涉及的基本反应类型是(
)
A.分解反应
B.化合反应
C.置换反应
D.复分解反应
CaCO3
过量
过滤
C
信息:我市的淡水资源相对不足,生产、生活用水主要由引黄济青工程提供。而我市临海,海水资源相对丰富。
若要在实验室中淡化海水,你打算采用什么方法、选择哪些仪器进行呢?
活动探究(二)
如何将海水淡化?
小烧杯、试管、酒精灯、玻璃导管、胶头滴管、单孔橡皮塞、铁架台。
药品:氯化钠溶液、硝酸银溶液。
供选择的实验仪器和药品:
活动探究(二)
温馨提示:
1.请按照从下到上,从左到右的顺序组
装仪器。
2.取大约5毫升氯化钠溶液加热。
3.加热前试管外壁的水要擦干,别忘了
预热。
4.实验时,一观察到有冷凝水流到小试管就停止加热,并验证所得的冷凝水是淡水。
5.实验结束后,先将导管从小试管中取出,再熄灭酒精灯。
6.氯化钠溶液能与硝酸银溶液反应,产生白色沉淀。
深入探究
(1)为了水蒸气的冷凝效果更好,你认为应对实验做哪些改进?
(2)你怎么证明得到的是淡水?
①加长导管长度
②将导管改为冷凝管
③将接受器放入冰水混合物中
④
在导管上包上湿而冷的毛巾
Cl-的检验方法:
取少量样品,加入AgNO3溶液产生白色沉淀;再加入稀HNO3
,白色沉淀不消失
信息共享:AgNO3溶液滴入含有Cl-的溶液,产生不溶于水的AgCl白色沉淀。
NaCl+AgNO3=AgCl↓+NaNO3
(2)你怎么证明得到的是淡水?
黄岛电厂的海水淡化工程车间
黄岛电厂采用低温多效蒸馏法生产的淡化水
多级闪急蒸馏法
结晶法
膜法
3.下列操作不能用来淡化海水的是(
)
A.过滤
B.使海水结冰脱盐
C.加热蒸馏
D.多级闪急蒸馏
4.为了区别海水和淡水,可分别加入下列哪种试剂(
)
A.澄清石灰水
B.硝酸银溶液
C.酚酞试液
D.石蕊试液
跟踪练习
A
B
今天我们参与了一系列海洋资源探究活动,下面请大家畅所欲言,谈谈你的收获和感悟。
畅谈收获
海洋资源
生物资源
矿产资源
动力资源
化学
资源
方法提升
混合物的分离
物理方法
过滤
蒸馏
化学方法
沉淀法
C
2.B
3.C
4.
C
5.C
6.C
7.B
8.(1)蒸馏(2)将导管的一端放入水中,若用手握住试管,导管口产生气泡,松开手后冷却,导管内上升一段水柱,则证明气密性良好(3)1/3
(4)无白色沉淀生成
已得到淡水
(5)
加长导管长度或者将导管改为冷凝管或者将接受器放入冰水混合物中或者
在导管上包上湿而冷的毛巾……
9.D
堂堂清答案
第八单元第一节
海洋化学资源
化学资源
海底矿物资源
海洋生物资源
海洋动力资源
预习检测区答案
1.(1)B(2)C(3)A(4)D
2.化学资源
矿物资源
生物资源
动力资源
3.可燃冰
4.(略)参考p32最后一段
5.H2O
O
Na+
Cl-
NaCl
海洋化学资源
1.海水中含量最多的物质是水。
2.海水中含量最多的盐是氯化钠。
3.含量最多的金属离子是钠离子,其次是镁离子。
4.海水中含量最多的离子是氯离子。
你认为从海洋中可以获取哪些化学物质?
照明弹
火箭
飞机
导弹
如何将海水中的镁离子变成金属镁?
活动探究(一)
?
工业上利用海水制镁的生产过程,请同学们自主学习,再小组合作学习。
海水或卤水
氢氧化镁
氯化镁
镁
海水制镁的流程及原理
海水
或卤水
氢氧化镁
氯化镁
镁
【知识梳理】流程和原理
1
2
海水中已经含有氯化镁了,直接电解海水不就行了吗?
从海水中提取镁的关键步骤是电解熔融的纯净的氯化镁
1.将海水中的镁离子富集起来。
2.除去海水中的其它杂质,获得比较纯净的氯化镁。
?
?
电解
海水中含有MgCl2→Mg(OH)2沉淀→纯净的MgCl2→Mg
友情提示:NaOH的市场平均价格是2320元/吨,Ca(OH)2的市场平均价格是1500元/吨,海边的贝壳的主要成份是CaCO3。
1.将海水中的镁离子富集起来。
反思交流
海水提镁的原理:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl=MgCl2+2H2O
MgCl2
==
Mg+Cl2↑
通电
2.除去海水中的其它杂质,获得比较纯净的氯化镁。
跟综练习
1.下列所示的从海水中提取镁的过程所发生的化学变化,涉
及到的基本反应类型是(
)。
海水或卤水
氢氧化镁
氯化镁
镁
A.化合反应
B.分解反应
C.复分解反应
D.置换反应
B、C
2.镁是一种用途广泛的金属,世界上60℅的金属镁是从海水中提取出来的,利用海水制备金属镁的流程如下图
(1)贝壳主要成分的化学式是
;操作a的名称是
。
(2)写出第①、②步反应的化学方程式
(3)写出第③步反应的化学方程式
。
(4)要使MgCl2完全转化为沉淀,加入试剂①的量应___
(5)上述转化过程中未涉及的基本反应类型是(
)
A.分解反应
B.化合反应
C.置换反应
D.复分解反应
CaCO3
过量
过滤
C
信息:我市的淡水资源相对不足,生产、生活用水主要由引黄济青工程提供。而我市临海,海水资源相对丰富。
若要在实验室中淡化海水,你打算采用什么方法、选择哪些仪器进行呢?
活动探究(二)
如何将海水淡化?
小烧杯、试管、酒精灯、玻璃导管、胶头滴管、单孔橡皮塞、铁架台。
药品:氯化钠溶液、硝酸银溶液。
供选择的实验仪器和药品:
活动探究(二)
温馨提示:
1.请按照从下到上,从左到右的顺序组
装仪器。
2.取大约5毫升氯化钠溶液加热。
3.加热前试管外壁的水要擦干,别忘了
预热。
4.实验时,一观察到有冷凝水流到小试管就停止加热,并验证所得的冷凝水是淡水。
5.实验结束后,先将导管从小试管中取出,再熄灭酒精灯。
6.氯化钠溶液能与硝酸银溶液反应,产生白色沉淀。
深入探究
(1)为了水蒸气的冷凝效果更好,你认为应对实验做哪些改进?
(2)你怎么证明得到的是淡水?
①加长导管长度
②将导管改为冷凝管
③将接受器放入冰水混合物中
④
在导管上包上湿而冷的毛巾
Cl-的检验方法:
取少量样品,加入AgNO3溶液产生白色沉淀;再加入稀HNO3
,白色沉淀不消失
信息共享:AgNO3溶液滴入含有Cl-的溶液,产生不溶于水的AgCl白色沉淀。
NaCl+AgNO3=AgCl↓+NaNO3
(2)你怎么证明得到的是淡水?
黄岛电厂的海水淡化工程车间
黄岛电厂采用低温多效蒸馏法生产的淡化水
多级闪急蒸馏法
结晶法
膜法
3.下列操作不能用来淡化海水的是(
)
A.过滤
B.使海水结冰脱盐
C.加热蒸馏
D.多级闪急蒸馏
4.为了区别海水和淡水,可分别加入下列哪种试剂(
)
A.澄清石灰水
B.硝酸银溶液
C.酚酞试液
D.石蕊试液
跟踪练习
A
B
今天我们参与了一系列海洋资源探究活动,下面请大家畅所欲言,谈谈你的收获和感悟。
畅谈收获
海洋资源
生物资源
矿产资源
动力资源
化学
资源
方法提升
混合物的分离
物理方法
过滤
蒸馏
化学方法
沉淀法
C
2.B
3.C
4.
C
5.C
6.C
7.B
8.(1)蒸馏(2)将导管的一端放入水中,若用手握住试管,导管口产生气泡,松开手后冷却,导管内上升一段水柱,则证明气密性良好(3)1/3
(4)无白色沉淀生成
已得到淡水
(5)
加长导管长度或者将导管改为冷凝管或者将接受器放入冰水混合物中或者
在导管上包上湿而冷的毛巾……
9.D
堂堂清答案
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
