2020浙教版科学九年级上册冲刺重高讲义(六):几种重要的盐(1) 【含答案】
文档属性
| 名称 | 2020浙教版科学九年级上册冲刺重高讲义(六):几种重要的盐(1) 【含答案】 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-08-04 00:00:00 | ||
图片预览




文档简介
一、常见的盐
电离时生成
金属
阳离子(或
铵根
离子)和
酸根
阴离子的化合物,是酸与碱反应的产物。
1、(1)碳酸钠,化学式
Na2CO3
,
白色粉末
状固体,
易
溶于水,俗名
纯碱
、
苏打
。
(2)碳酸钠晶体化学式
Na2CO3?10H2O
,我们把这种晶体里含有一定数目水分子的物质称为结晶水合物
,所含的水称为
结晶水
。
(3)在常温下干燥的空气里,Na2CO3·10H2O会逐渐失去结晶水而成为碳酸钠粉末,这个过程叫做
分化
。化学方程式为:
Na2CO3·10H2O
=
Na2CO3
+
10H2O
,所以分化是
化学
变化。
(4)向盛有碳酸钠溶液的试管中滴加无色酚酞试液,观察到的现象为:
溶液变红
。
说明碳酸钠的水溶液呈
碱
性。利用碳酸钠的这种性质,它用来蒸馒头、煮粥、制洗涤剂、
造纸、纺织等等。
(5)碳酸钠能和酸、某些碱、某些盐反应,请写出下面反应方程式和现象:
①碳酸钠和稀硫酸反应:
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
②碳酸钠和稀盐酸反应:
Na2CO3+2HCl=
2NaCl+CO2↑+H2O
现象:有
气体
放出,燃着的火柴放在试管口会
熄灭
③碳酸钠和氢氧化钙反应:
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
现象:溶液中出现
白色沉淀
④碳酸钠和氯化钡反应:
BaCl2+Na2CO3=2NaCl+BaCO3↓
⑤碳酸钠和氯化钙反应:
CaCl2+Na2CO3=2NaCl+CaCO3↓
现象:溶液中出现
白色沉淀
(6)CO32-
的检验方法:向待测液中滴加稀盐酸,若产生气泡,且气体能使澄清石灰水变浑浊,则证明待测液中含有CO32-
。
2、(1)碳酸钙,化学式
CaCO3
,是一种
难
溶的固体,大理石、石灰石、汉白玉、贝壳、蛋壳等的主要成分都是
CaCO3
。
(2)碳酸钙会和稀盐酸反应:
CaCO3+2HCl
=
CaCl2+CO2↑+H2O(实验室制取
CO2
的原理)
(3)碳酸钙高温会分解:
CaCO3CaO
+
CO2↑
(工业制取
CO2
的原理)
(4)自然界中的碳酸钙及其用途:
①洁白纯净的碳酸钙岩石叫
汉白石
,也叫
汉白玉
;
②因含杂质而有花纹的碳酸钙岩石叫
大理石
;
③质地致密的碳酸钙岩石叫
石灰石
。
④碳酸钙是重要的
建筑
材料,主要用途是生产
水泥
。
3、(1)氯化钠(食盐),化学式
NaCl
,
白色
固体、
易
溶于水。
(2)氯化钠来源:①
井水
制盐、②
盐湖
捞盐、③
海水
晒盐
(3)氯化钠用途:
①配制医用
生理盐水
;原理:一定浓度的氯化钠溶液可以维持细胞正常形态和生理活动。
②农业
选种
;原理:饱满的种子密度大容易
沉
,不饱满的种子密度小容易
浮
。
③工业用氯化钠为原料可制
碳酸钠
、
氢氧化钠
、
氯气
、
盐酸
等;
④生活中的
调味品
,腌渍蔬菜等;原理:食盐可以使食物脱水,来抑制微生的滋生。
⑤用氯化钠消除公路上的
积雪
等。原理:氯化钠溶于水降低了水的凝固点,使雪容易熔化。
⑥清洗伤口;原理:浓的食盐溶液会使细胞内的水渗出,使蛋白质凝固,具有
杀菌
作用。
联合制碱法又称侯氏制碱法,用于在工业上制取纯碱(Na2CO3),由侯德榜于1943年发明,是世界上广泛采用的制纯碱法。具体过程为:在饱和氨盐水中(氨气,氯化钠都达到饱和的溶液)通入二氧化碳从而发生如下反应:反应中的碳酸氢钠由于溶解度低而析出,可以进一步煅烧分解为碳酸钠,水和二氧化碳,其中二氧化碳可以再次进入反应重复利用。反应方程式如下:
NH3+H2O+CO2=NH4HCO3
NH4HCO3+NaCl=NH4Cl+NaHCO3↓
2NaHCO3Na2CO3+H2O+CO2↑
例1、小金制作了一个如图甲所示的简易酸碱灭火器,并进行了如图乙所示的灭火操作,结束后对瓶中残留液进行了如下实验:①取少量残留液于试管中,滴加2滴紫色石蕊试液,变红色;②另取少量残留液于试管中滴加适量氯化钡溶液,有白色沉淀,则残留液中有大量的( )
A.硫酸钠
B.碳酸钠
C.盐酸
D.氯化钠
例2、食盐、食醋、纯碱均是家庭厨房中常用的物质,利用这些物质,我能够完成的实验是( )
①检验自来水中是否含有氯离子;
②除去热水瓶中的水垢;
③区分食盐和纯碱;
④检验鸡蛋壳中是否含有碳酸盐.
A.①②
B.①③
C.①④
D.②③④
例3、碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)是生活中常见的盐,有广泛的用途。根据所学知识回答:
(1)碳酸钠和碳酸氢钠中阴离子对应的酸都是
(填化学式);
(2)碳酸钠常用作食用碱,水溶液pH
7(填“>”“﹦”或“<”);
(3)碳酸氢钠在医疗上用作治疗胃酸过多,反应的化学方程式为
;
(4)碳酸钠固体中混有少量的碳酸氢钠,常用加热的方法除去碳酸氢钠,反应的化学方程式:2NaHCO3Na2CO3+↑+H2O则“”中的化学式为
;
(5)干粉灭火器利用碳酸氢钠来灭火,其灭火原理是
。
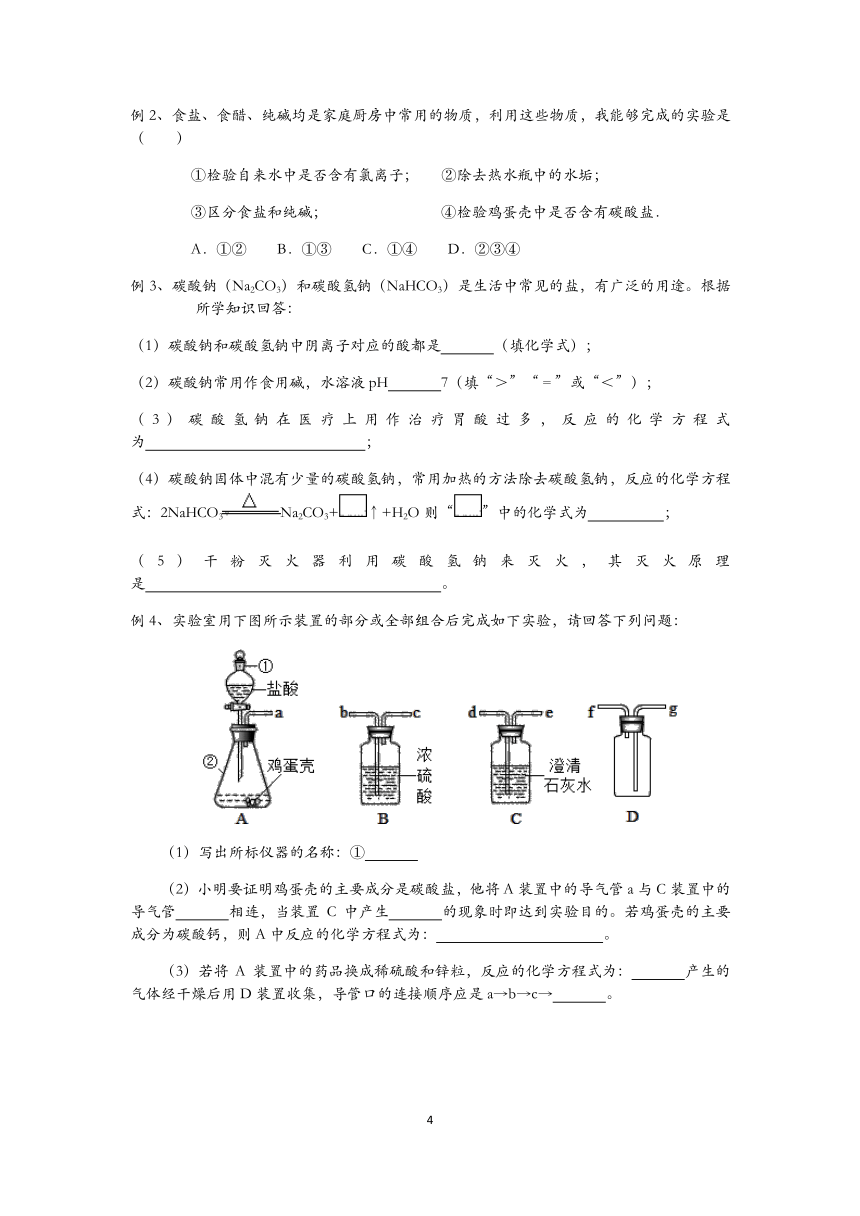
例4、实验室用下图所示装置的部分或全部组合后完成如下实验,请回答下列问题:
(1)写出所标仪器的名称:①
(2)小明要证明鸡蛋壳的主要成分是碳酸盐,他将A装置中的导气管a与C装置中的导气管
相连,当装置C中产生
的现象时即达到实验目的。若鸡蛋壳的主要成分为碳酸钙,则A中反应的化学方程式为:
。
(3)若将A装置中的药品换成稀硫酸和锌粒,反应的化学方程式为:
产生的气体经干燥后用D装置收集,导管口的连接顺序应是a→b→c→
。
1、下列说法正确的是( )
A.盐的组成中不一定含有金属离子
B.食盐就是盐,盐就是食盐
C.盐的组成中一定没有氢离子
D.盐的组成中一定没有氢氧根离子
2、碳酸钠可用于制造玻璃,其俗称是( )
A.小苏打
B.消石灰
C.烧碱
D.纯碱
3、生活中常见的盐与其对应的用途描述不相符的是( )
A.氯化钠是常用的调味品
B.碳酸钠用作建筑材料
C.碳酸氢钠用于焙制糕点
D.碳酸钙可用作补钙剂
4、下列说法正确的是( )
A.盐就是食盐
B.纯碱不属于盐类
C.NaHCO3属于盐类
D.盐都能溶于水
5、近来市场上出现了能补充人体盐分的饮品﹣﹣盐汽水,你认为盐汽水的成分和普通汽水最大的不同是
增加了( )
A.水
B.氯化钠
C.二氧化碳
D.碳酸钙
6、玲玲猜测一瓶久置于空气中的NaOH溶液中可能含有了Na2CO3,她设计的下列实验能对此猜测提供有力实证的是( )
A.滴加适量CuSO4溶液
B.滴加酚酞试液
C.滴加足量稀盐酸
D.滴加石蕊试液
7、石灰石是一种常见的矿石.某同学认为它可①炼铁
②生产石灰
③制水泥
④制玻璃
⑤建筑材料,你认为合理的是( )
A.①③④⑤
B.①②④⑤
C.①②③④
D.全部是
8、食盐是人类生存最重要的物质之一,也是烹饪中最常用的调味料.食盐的主要化学成份氯化钠(化学式NaCl)在食盐中含量为99%,下列描述属于氯化钠化学性质的是( )
A.氯化钠是白色固体
B.氯化钠易溶于水
C.氯化钠有咸味
D.氯化钠水溶液能与硝酸银溶液反应生成白色不溶于稀硝酸的沉淀
9、小军同学自制汽水所需配料如图所示。下列说法不正确的是( )
A.小苏打属于碱类物质
B.柠檬酸溶液的pH<7
C.小苏打与柠檬酸反应产生二氧化碳气体
D.汽水中的部分二氧化碳跟水发生反应
10、某种物质是焙制糕点所用的发酵粉的主要成分之一,也是医疗上治疗胃酸过多症的一种药剂,这种物质是( )
A.NaOH
B.NaHCO3
C.CaO
D.NaCl
11、如图表示向一定量CaCl2和盐酸的混合溶液中滴加Na2CO3溶液的变化过程,x表示Na2CO3溶液的质量,则y可能表示( )
A.气体的体积
B.沉淀的质量
C.NaCl的质量
D.混合溶液的pH
12、如图所示装置气密性良好,要使注射器中的活塞向右移动,使用的液体M和固体N可能是( )
①稀盐酸和石灰石;
②稀硫酸和锌;
③水和氢氧化钠;
④水和硝酸铵。
A.①②③④
B.①②③
C.①②④
D.②③④
13、下列试剂中,能把KOH溶液、稀硫酸、CaCl2溶液一次鉴别出来的是( )
A.KCl溶液
B.K2CO3溶液
C.NaNO3溶液
D.稀盐酸
14、碳酸钠是一种重要的盐类物质,某同学设计实验对碳酸钠的部分性质进行了探究,请你一起参与探究活动。
(1)【探究实验一】碳酸钠溶液的酸碱性
【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞试液,振荡。
现象:溶液变成浅红色.结论:
。
(2)【探究实验二】能与碱反应.
【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入澄清石灰水,振荡.
现象:
,反应的化学方程式为:
。
15、某化学兴趣小组设计了一个验证某氯化钠溶液中混有碳酸钠、硫酸钠和氢氧化钠的实验方案,实验流程如图所示:
(1)当测得B中溶液的pH=10时,即可判断原溶液中一定混有
。
(2)向B中加入过量稀盐酸,观察到
时,完成了对剩余物质的验证。
(3)完成验证实验后,将C中物质过滤,向滤液中加入适量的
后,再过滤,即可得到溶质只有氯化钠的溶液。
16、在一大烧杯里进行以下实验:烧杯中放置一支短蜡烛,周围放一些鸡蛋壳.点燃蜡烛,往烧杯中加入一些稀盐酸,回答:
看到的现象:
;
;
。
(2)鸡蛋壳的主要成分是碳酸钙,写出盐酸跟碳酸钙反应的化学方程式
;
(3)根据实验现象,猜想生成的气体可能是
,通过上述实验现象可知该气体具有的性质
;
(4)蜡烛的主要成分是石蜡(化学式为CaHb),完全燃烧后生成二氧化碳和水,写出石蜡燃烧的化学方程式
(a、b为正整数)。
17、同学们对实验“煅烧石灰石”展开深入探究。资料:石灰石中的杂质高温不分解且不与稀盐酸反应。
图1
图2
(1)为证明石灰石已分解,三位同学从其他角度设计方案如下:
①甲同学按图1所示进行实验(煤气灯亦能达到石灰石分解的温度),观察到烧杯内壁澄清石灰水变浑浊,写出石灰水发生反应的化学方程式:
。
②乙同学按图2所示进行试验,观察到B中液体变
色,A实验的作用是
。
③丙同学取一块石灰石煅烧,一段时间后发现固体质量减轻m
g,证明石灰石已分解。
④大家认为甲同学的方案不合理,请分析原因:
。
(2)为测定石灰石的纯度,丙同学将他刚才煅烧后的固体放入足量稀盐酸中,又产生mg气体,结合上述数据计算可知,丙所取的这块石灰石中含碳酸钙
g.
1、下列关于盐的说法中,正确的是( )
A.只能解离出金属离子和酸根离子的物质叫盐
B.能解离出金属离子和酸根离子的化合物叫盐
C.盐的水溶液一定呈中性
D.盐的化学式中一定含有金属离子和酸根离子
2、将下列各组下列物质属于盐的是(
)
A.纯碱
B.烧碱
C.盐酸
D.熟石灰
3、珍珠是一种名贵的中药材,其主要成分是一种含钙的化合物。把盐酸滴在珍珠粉上,产生大量气泡。若将生成的气体通入澄清的石灰水,澄清的石灰水变浑浊。据此推断,珍珠的主要成分可能是( )
A.K2CO3
B.Ca(OH)2
C.CaCO3
D.Ca(NO3)2
4、下列常见盐在生产、生活中的用途不合理的是( )
A.以氯化钠为原料制取烧碱
B.碳酸钙可用做补钙剂
C.用工业食盐腌制食品
D.焙制糕点所用的发酵粉含碳酸氢钠
5、用一种试剂将蒸馏水、氢氧化钠和稀盐酸一次鉴别开来,这种试剂是( )
A.氯化钡溶液
B.碳酸钠溶液
C.紫色石蕊试液
D.无色酚酞试液
6、实验室有一瓶保管不当的试剂,其残缺的标签如图.这瓶试剂中的溶质可能是( )
A.单质
B.氧化物
C.盐
D.碱
7、下列实验方案或措施不合理的是( )
A.用浓硫酸干燥氢气
B.用氯化钡溶液鉴别稀硫酸和稀盐酸
C.用酚酞试液检验氢氧化钠溶液是否变质
D.用稀盐酸除去盛过石灰水的试剂瓶内壁上的碳酸钙
8、现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量的某物质X,溶液的pH随滴入X的量的变化关系如图所示,则X可能是( )
A.氯化钠溶液
B.氢氧化钠溶液
C.纯碱溶液
D.稀硫酸
9、生活中产生的污垢,常可用稀盐酸来清洗.但下列有一种污垢是不宜用稀盐酸来清洗的,它是( )
A.不锈钢茶杯内的茶垢
B.陶瓷水槽内的黄色铁锈斑
C.保温瓶内的水垢(主要成分是CaCO3)
D.长期盛放石灰水试剂瓶内壁上的白色固体
10、在硫酸和盐酸的混合溶液中,能够大量存在的物质是( )
A.BaCl2
B.AgNO3
C.Na2SO4
D.Na2CO3
11、小乐完成了图示甲、乙实验后,依次将反应后的溶液缓慢倒入同一洁净的废液缸中,观察到废液缸中先有气泡产生,然后又出现白色沉淀,则下列说法中,正确的是( )
A.甲实验结束后,试管中的溶液含稀盐酸和CaCl2
B.乙实验结束后,试管中的溶液含稀盐酸和NaCl
C.最终,废液缸中一定含NaCl,CaCl2两种溶质
D.最终,废液缸中一定含NaCl,Na2CO3两种溶质
12、两份质量相同的碳酸钙,一份与适量的稀盐酸反应,另一份充分煅烧,所得的二氧化碳气体( )
A.一样多
B.跟稀盐酸反应生成的二氧化碳气体多
C.煅烧时生成的二氧化碳气体多
D.无法确定
13、将腌制松花皮蛋用到的主要物质生石灰和纯碱及少量食盐放入足量水中,充分反应后过滤,得到水溶
液样品.请回答如下问题:
(1)写出生石灰、纯碱在水中发生反应的化学方程式
;
(2)水溶液样品中含有哪些溶质呢?请用化学式表示出其中2种情况
;
(3)若要检验样品中是否有纯碱,可选用的一种试剂是
。
参考答案
例1、A
例2、D例3、(1)H2CO3(2)>(3)NaHCO3+HCl=NaCl+H2O+CO2↑;
(4)CO2;(5)碳酸氢钠受热分解得到二氧化碳气体,因而隔离了空气而灭火
例4、(1)分液漏斗;(2)d;澄清石灰水变浑浊;CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)Zn+H2SO4═ZnSO4+H2↑;f
A
2、D
3、B
4、C
5、B
6、C
7、D
8、D
9、A
10、B
11、A
12、B
13、B
14、(1)碳酸钠溶液呈碱性;(2)产生白色沉淀;Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
15、(1)NaOH;(2)产生气泡且仍有固体剩余;(3)Na2CO3
16、(1)鸡蛋壳溶解,有气泡产生,蜡烛熄灭.
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)二氧化碳;不能燃烧、不能支持燃烧、密度比空气的大;
(4)4CaHb+(4a+b)O24aCO2+2bH2O
17、(1)①Ca(OH)2+CO2=CaCO3↓+H2O;②红;对照; ④煤气灯的燃料的主要成分为一氧化碳,而一氧化碳燃烧生成了二氧化碳,所以澄清石灰水变浑浊不一定是来源于石灰石的分解;(2)50m
/
11
1、B
2、A
3、C
4、C
5、C
6、C
7、C
8、C
9、A
10、C
11、A
12、A
13、(1)CaO+H2O═Ca(OH)2,Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
(2)NaOH、NaCl、Ca(OH)2;NaOH、NaCl、Na2CO3(3)稀盐酸
2020浙教版科学九年级上册“冲刺重高”讲义(六)
几种重要的盐(1)
电离时生成
金属
阳离子(或
铵根
离子)和
酸根
阴离子的化合物,是酸与碱反应的产物。
1、(1)碳酸钠,化学式
Na2CO3
,
白色粉末
状固体,
易
溶于水,俗名
纯碱
、
苏打
。
(2)碳酸钠晶体化学式
Na2CO3?10H2O
,我们把这种晶体里含有一定数目水分子的物质称为结晶水合物
,所含的水称为
结晶水
。
(3)在常温下干燥的空气里,Na2CO3·10H2O会逐渐失去结晶水而成为碳酸钠粉末,这个过程叫做
分化
。化学方程式为:
Na2CO3·10H2O
=
Na2CO3
+
10H2O
,所以分化是
化学
变化。
(4)向盛有碳酸钠溶液的试管中滴加无色酚酞试液,观察到的现象为:
溶液变红
。
说明碳酸钠的水溶液呈
碱
性。利用碳酸钠的这种性质,它用来蒸馒头、煮粥、制洗涤剂、
造纸、纺织等等。
(5)碳酸钠能和酸、某些碱、某些盐反应,请写出下面反应方程式和现象:
①碳酸钠和稀硫酸反应:
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
②碳酸钠和稀盐酸反应:
Na2CO3+2HCl=
2NaCl+CO2↑+H2O
现象:有
气体
放出,燃着的火柴放在试管口会
熄灭
③碳酸钠和氢氧化钙反应:
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
现象:溶液中出现
白色沉淀
④碳酸钠和氯化钡反应:
BaCl2+Na2CO3=2NaCl+BaCO3↓
⑤碳酸钠和氯化钙反应:
CaCl2+Na2CO3=2NaCl+CaCO3↓
现象:溶液中出现
白色沉淀
(6)CO32-
的检验方法:向待测液中滴加稀盐酸,若产生气泡,且气体能使澄清石灰水变浑浊,则证明待测液中含有CO32-
。
2、(1)碳酸钙,化学式
CaCO3
,是一种
难
溶的固体,大理石、石灰石、汉白玉、贝壳、蛋壳等的主要成分都是
CaCO3
。
(2)碳酸钙会和稀盐酸反应:
CaCO3+2HCl
=
CaCl2+CO2↑+H2O(实验室制取
CO2
的原理)
(3)碳酸钙高温会分解:
CaCO3CaO
+
CO2↑
(工业制取
CO2
的原理)
(4)自然界中的碳酸钙及其用途:
①洁白纯净的碳酸钙岩石叫
汉白石
,也叫
汉白玉
;
②因含杂质而有花纹的碳酸钙岩石叫
大理石
;
③质地致密的碳酸钙岩石叫
石灰石
。
④碳酸钙是重要的
建筑
材料,主要用途是生产
水泥
。
3、(1)氯化钠(食盐),化学式
NaCl
,
白色
固体、
易
溶于水。
(2)氯化钠来源:①
井水
制盐、②
盐湖
捞盐、③
海水
晒盐
(3)氯化钠用途:
①配制医用
生理盐水
;原理:一定浓度的氯化钠溶液可以维持细胞正常形态和生理活动。
②农业
选种
;原理:饱满的种子密度大容易
沉
,不饱满的种子密度小容易
浮
。
③工业用氯化钠为原料可制
碳酸钠
、
氢氧化钠
、
氯气
、
盐酸
等;
④生活中的
调味品
,腌渍蔬菜等;原理:食盐可以使食物脱水,来抑制微生的滋生。
⑤用氯化钠消除公路上的
积雪
等。原理:氯化钠溶于水降低了水的凝固点,使雪容易熔化。
⑥清洗伤口;原理:浓的食盐溶液会使细胞内的水渗出,使蛋白质凝固,具有
杀菌
作用。
联合制碱法又称侯氏制碱法,用于在工业上制取纯碱(Na2CO3),由侯德榜于1943年发明,是世界上广泛采用的制纯碱法。具体过程为:在饱和氨盐水中(氨气,氯化钠都达到饱和的溶液)通入二氧化碳从而发生如下反应:反应中的碳酸氢钠由于溶解度低而析出,可以进一步煅烧分解为碳酸钠,水和二氧化碳,其中二氧化碳可以再次进入反应重复利用。反应方程式如下:
NH3+H2O+CO2=NH4HCO3
NH4HCO3+NaCl=NH4Cl+NaHCO3↓
2NaHCO3Na2CO3+H2O+CO2↑
例1、小金制作了一个如图甲所示的简易酸碱灭火器,并进行了如图乙所示的灭火操作,结束后对瓶中残留液进行了如下实验:①取少量残留液于试管中,滴加2滴紫色石蕊试液,变红色;②另取少量残留液于试管中滴加适量氯化钡溶液,有白色沉淀,则残留液中有大量的( )
A.硫酸钠
B.碳酸钠
C.盐酸
D.氯化钠
例2、食盐、食醋、纯碱均是家庭厨房中常用的物质,利用这些物质,我能够完成的实验是( )
①检验自来水中是否含有氯离子;
②除去热水瓶中的水垢;
③区分食盐和纯碱;
④检验鸡蛋壳中是否含有碳酸盐.
A.①②
B.①③
C.①④
D.②③④
例3、碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)是生活中常见的盐,有广泛的用途。根据所学知识回答:
(1)碳酸钠和碳酸氢钠中阴离子对应的酸都是
(填化学式);
(2)碳酸钠常用作食用碱,水溶液pH
7(填“>”“﹦”或“<”);
(3)碳酸氢钠在医疗上用作治疗胃酸过多,反应的化学方程式为
;
(4)碳酸钠固体中混有少量的碳酸氢钠,常用加热的方法除去碳酸氢钠,反应的化学方程式:2NaHCO3Na2CO3+↑+H2O则“”中的化学式为
;
(5)干粉灭火器利用碳酸氢钠来灭火,其灭火原理是
。
例4、实验室用下图所示装置的部分或全部组合后完成如下实验,请回答下列问题:
(1)写出所标仪器的名称:①
(2)小明要证明鸡蛋壳的主要成分是碳酸盐,他将A装置中的导气管a与C装置中的导气管
相连,当装置C中产生
的现象时即达到实验目的。若鸡蛋壳的主要成分为碳酸钙,则A中反应的化学方程式为:
。
(3)若将A装置中的药品换成稀硫酸和锌粒,反应的化学方程式为:
产生的气体经干燥后用D装置收集,导管口的连接顺序应是a→b→c→
。
1、下列说法正确的是( )
A.盐的组成中不一定含有金属离子
B.食盐就是盐,盐就是食盐
C.盐的组成中一定没有氢离子
D.盐的组成中一定没有氢氧根离子
2、碳酸钠可用于制造玻璃,其俗称是( )
A.小苏打
B.消石灰
C.烧碱
D.纯碱
3、生活中常见的盐与其对应的用途描述不相符的是( )
A.氯化钠是常用的调味品
B.碳酸钠用作建筑材料
C.碳酸氢钠用于焙制糕点
D.碳酸钙可用作补钙剂
4、下列说法正确的是( )
A.盐就是食盐
B.纯碱不属于盐类
C.NaHCO3属于盐类
D.盐都能溶于水
5、近来市场上出现了能补充人体盐分的饮品﹣﹣盐汽水,你认为盐汽水的成分和普通汽水最大的不同是
增加了( )
A.水
B.氯化钠
C.二氧化碳
D.碳酸钙
6、玲玲猜测一瓶久置于空气中的NaOH溶液中可能含有了Na2CO3,她设计的下列实验能对此猜测提供有力实证的是( )
A.滴加适量CuSO4溶液
B.滴加酚酞试液
C.滴加足量稀盐酸
D.滴加石蕊试液
7、石灰石是一种常见的矿石.某同学认为它可①炼铁
②生产石灰
③制水泥
④制玻璃
⑤建筑材料,你认为合理的是( )
A.①③④⑤
B.①②④⑤
C.①②③④
D.全部是
8、食盐是人类生存最重要的物质之一,也是烹饪中最常用的调味料.食盐的主要化学成份氯化钠(化学式NaCl)在食盐中含量为99%,下列描述属于氯化钠化学性质的是( )
A.氯化钠是白色固体
B.氯化钠易溶于水
C.氯化钠有咸味
D.氯化钠水溶液能与硝酸银溶液反应生成白色不溶于稀硝酸的沉淀
9、小军同学自制汽水所需配料如图所示。下列说法不正确的是( )
A.小苏打属于碱类物质
B.柠檬酸溶液的pH<7
C.小苏打与柠檬酸反应产生二氧化碳气体
D.汽水中的部分二氧化碳跟水发生反应
10、某种物质是焙制糕点所用的发酵粉的主要成分之一,也是医疗上治疗胃酸过多症的一种药剂,这种物质是( )
A.NaOH
B.NaHCO3
C.CaO
D.NaCl
11、如图表示向一定量CaCl2和盐酸的混合溶液中滴加Na2CO3溶液的变化过程,x表示Na2CO3溶液的质量,则y可能表示( )
A.气体的体积
B.沉淀的质量
C.NaCl的质量
D.混合溶液的pH
12、如图所示装置气密性良好,要使注射器中的活塞向右移动,使用的液体M和固体N可能是( )
①稀盐酸和石灰石;
②稀硫酸和锌;
③水和氢氧化钠;
④水和硝酸铵。
A.①②③④
B.①②③
C.①②④
D.②③④
13、下列试剂中,能把KOH溶液、稀硫酸、CaCl2溶液一次鉴别出来的是( )
A.KCl溶液
B.K2CO3溶液
C.NaNO3溶液
D.稀盐酸
14、碳酸钠是一种重要的盐类物质,某同学设计实验对碳酸钠的部分性质进行了探究,请你一起参与探究活动。
(1)【探究实验一】碳酸钠溶液的酸碱性
【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞试液,振荡。
现象:溶液变成浅红色.结论:
。
(2)【探究实验二】能与碱反应.
【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入澄清石灰水,振荡.
现象:
,反应的化学方程式为:
。
15、某化学兴趣小组设计了一个验证某氯化钠溶液中混有碳酸钠、硫酸钠和氢氧化钠的实验方案,实验流程如图所示:
(1)当测得B中溶液的pH=10时,即可判断原溶液中一定混有
。
(2)向B中加入过量稀盐酸,观察到
时,完成了对剩余物质的验证。
(3)完成验证实验后,将C中物质过滤,向滤液中加入适量的
后,再过滤,即可得到溶质只有氯化钠的溶液。
16、在一大烧杯里进行以下实验:烧杯中放置一支短蜡烛,周围放一些鸡蛋壳.点燃蜡烛,往烧杯中加入一些稀盐酸,回答:
看到的现象:
;
;
。
(2)鸡蛋壳的主要成分是碳酸钙,写出盐酸跟碳酸钙反应的化学方程式
;
(3)根据实验现象,猜想生成的气体可能是
,通过上述实验现象可知该气体具有的性质
;
(4)蜡烛的主要成分是石蜡(化学式为CaHb),完全燃烧后生成二氧化碳和水,写出石蜡燃烧的化学方程式
(a、b为正整数)。
17、同学们对实验“煅烧石灰石”展开深入探究。资料:石灰石中的杂质高温不分解且不与稀盐酸反应。
图1
图2
(1)为证明石灰石已分解,三位同学从其他角度设计方案如下:
①甲同学按图1所示进行实验(煤气灯亦能达到石灰石分解的温度),观察到烧杯内壁澄清石灰水变浑浊,写出石灰水发生反应的化学方程式:
。
②乙同学按图2所示进行试验,观察到B中液体变
色,A实验的作用是
。
③丙同学取一块石灰石煅烧,一段时间后发现固体质量减轻m
g,证明石灰石已分解。
④大家认为甲同学的方案不合理,请分析原因:
。
(2)为测定石灰石的纯度,丙同学将他刚才煅烧后的固体放入足量稀盐酸中,又产生mg气体,结合上述数据计算可知,丙所取的这块石灰石中含碳酸钙
g.
1、下列关于盐的说法中,正确的是( )
A.只能解离出金属离子和酸根离子的物质叫盐
B.能解离出金属离子和酸根离子的化合物叫盐
C.盐的水溶液一定呈中性
D.盐的化学式中一定含有金属离子和酸根离子
2、将下列各组下列物质属于盐的是(
)
A.纯碱
B.烧碱
C.盐酸
D.熟石灰
3、珍珠是一种名贵的中药材,其主要成分是一种含钙的化合物。把盐酸滴在珍珠粉上,产生大量气泡。若将生成的气体通入澄清的石灰水,澄清的石灰水变浑浊。据此推断,珍珠的主要成分可能是( )
A.K2CO3
B.Ca(OH)2
C.CaCO3
D.Ca(NO3)2
4、下列常见盐在生产、生活中的用途不合理的是( )
A.以氯化钠为原料制取烧碱
B.碳酸钙可用做补钙剂
C.用工业食盐腌制食品
D.焙制糕点所用的发酵粉含碳酸氢钠
5、用一种试剂将蒸馏水、氢氧化钠和稀盐酸一次鉴别开来,这种试剂是( )
A.氯化钡溶液
B.碳酸钠溶液
C.紫色石蕊试液
D.无色酚酞试液
6、实验室有一瓶保管不当的试剂,其残缺的标签如图.这瓶试剂中的溶质可能是( )
A.单质
B.氧化物
C.盐
D.碱
7、下列实验方案或措施不合理的是( )
A.用浓硫酸干燥氢气
B.用氯化钡溶液鉴别稀硫酸和稀盐酸
C.用酚酞试液检验氢氧化钠溶液是否变质
D.用稀盐酸除去盛过石灰水的试剂瓶内壁上的碳酸钙
8、现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量的某物质X,溶液的pH随滴入X的量的变化关系如图所示,则X可能是( )
A.氯化钠溶液
B.氢氧化钠溶液
C.纯碱溶液
D.稀硫酸
9、生活中产生的污垢,常可用稀盐酸来清洗.但下列有一种污垢是不宜用稀盐酸来清洗的,它是( )
A.不锈钢茶杯内的茶垢
B.陶瓷水槽内的黄色铁锈斑
C.保温瓶内的水垢(主要成分是CaCO3)
D.长期盛放石灰水试剂瓶内壁上的白色固体
10、在硫酸和盐酸的混合溶液中,能够大量存在的物质是( )
A.BaCl2
B.AgNO3
C.Na2SO4
D.Na2CO3
11、小乐完成了图示甲、乙实验后,依次将反应后的溶液缓慢倒入同一洁净的废液缸中,观察到废液缸中先有气泡产生,然后又出现白色沉淀,则下列说法中,正确的是( )
A.甲实验结束后,试管中的溶液含稀盐酸和CaCl2
B.乙实验结束后,试管中的溶液含稀盐酸和NaCl
C.最终,废液缸中一定含NaCl,CaCl2两种溶质
D.最终,废液缸中一定含NaCl,Na2CO3两种溶质
12、两份质量相同的碳酸钙,一份与适量的稀盐酸反应,另一份充分煅烧,所得的二氧化碳气体( )
A.一样多
B.跟稀盐酸反应生成的二氧化碳气体多
C.煅烧时生成的二氧化碳气体多
D.无法确定
13、将腌制松花皮蛋用到的主要物质生石灰和纯碱及少量食盐放入足量水中,充分反应后过滤,得到水溶
液样品.请回答如下问题:
(1)写出生石灰、纯碱在水中发生反应的化学方程式
;
(2)水溶液样品中含有哪些溶质呢?请用化学式表示出其中2种情况
;
(3)若要检验样品中是否有纯碱,可选用的一种试剂是
。
参考答案
例1、A
例2、D例3、(1)H2CO3(2)>(3)NaHCO3+HCl=NaCl+H2O+CO2↑;
(4)CO2;(5)碳酸氢钠受热分解得到二氧化碳气体,因而隔离了空气而灭火
例4、(1)分液漏斗;(2)d;澄清石灰水变浑浊;CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)Zn+H2SO4═ZnSO4+H2↑;f
A
2、D
3、B
4、C
5、B
6、C
7、D
8、D
9、A
10、B
11、A
12、B
13、B
14、(1)碳酸钠溶液呈碱性;(2)产生白色沉淀;Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
15、(1)NaOH;(2)产生气泡且仍有固体剩余;(3)Na2CO3
16、(1)鸡蛋壳溶解,有气泡产生,蜡烛熄灭.
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)二氧化碳;不能燃烧、不能支持燃烧、密度比空气的大;
(4)4CaHb+(4a+b)O24aCO2+2bH2O
17、(1)①Ca(OH)2+CO2=CaCO3↓+H2O;②红;对照; ④煤气灯的燃料的主要成分为一氧化碳,而一氧化碳燃烧生成了二氧化碳,所以澄清石灰水变浑浊不一定是来源于石灰石的分解;(2)50m
/
11
1、B
2、A
3、C
4、C
5、C
6、C
7、C
8、C
9、A
10、C
11、A
12、A
13、(1)CaO+H2O═Ca(OH)2,Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
(2)NaOH、NaCl、Ca(OH)2;NaOH、NaCl、Na2CO3(3)稀盐酸
2020浙教版科学九年级上册“冲刺重高”讲义(六)
几种重要的盐(1)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
