人教版高中化学选修四1-2:燃烧热-能源(共23张PPT)
文档属性
| 名称 | 人教版高中化学选修四1-2:燃烧热-能源(共23张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-07 08:01:41 | ||
图片预览








文档简介
(共23张PPT)
第一章
化学反应与能量
燃烧热
能源
[学习目标]:了解燃烧热的概念,能进行简单计算
[重点难点]:燃烧热的概念及计算。
【复习】什么叫中和热?如何计算?
在稀溶液中,酸跟碱发生中和反应而生成1mol
H2O的反应热叫中和热。
Q
=
mcΔt
×10-3
kJ
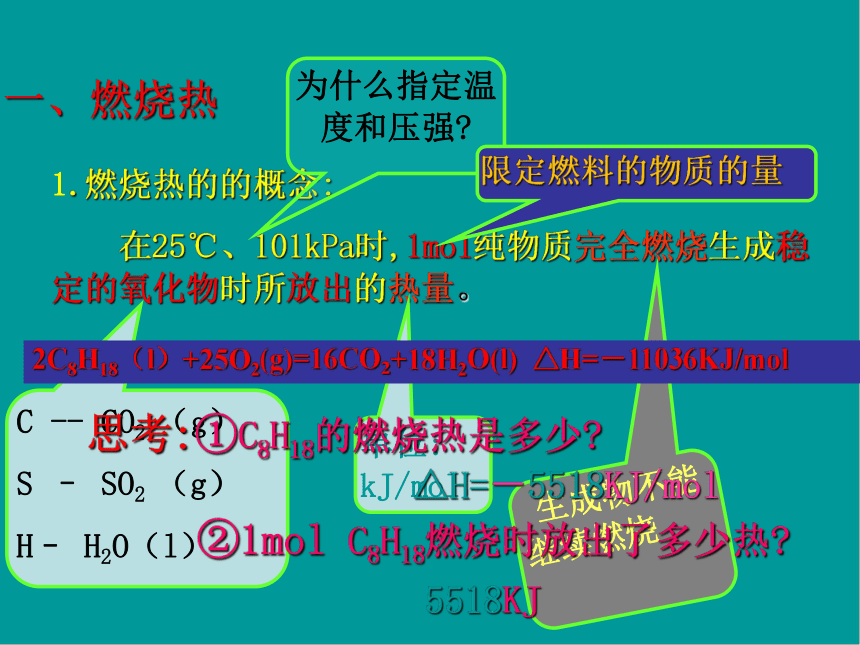
一、燃烧热
例2:实验测得101kPa时1molH2完全燃烧放出393.5
kJ的热量,这就是H2的燃烧热。
H2(g)+1/2O2(g)=H2O(l)
ΔH=-285.8
kJ/mol
例1:实验测得101kPa时1molC完全燃烧放出393.5
kJ的热量,这就是C的燃烧热。
C(s)+O2(g)=CO2(g)
ΔH=-393.5kJ/mol
一、燃烧热
1.燃烧热的的概念:
在25℃、101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。
为什么指定温度和压强?
生成物不能继续燃烧
C
--
CO2
(g)
S
–
SO2
(g)
H–
H2O(l)
单位:
kJ/mol
限定燃料的物质的量
2C8H18(l)+25O2(g)=16CO2+18H2O(l)
△H=-11036KJ/mol
思考:①C8H18的燃烧热是多少?
△H=-5518KJ/mol
②1mol
C8H18燃烧时放出了多少热?
5518KJ
一、燃烧热
1.燃烧热的的概念:
在25℃、101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。
注意:
Ⅰ、在101kPa时,完全燃烧生成稳定的氧化物
如:C→C02,H→H20(l),S→S02等
Ⅱ、燃烧热通常由实验测得
Ⅲ、可燃物以1mol为标准进行测量
Ⅳ、系数常用分数表示
2.表示的意义:
如:
CH4的燃烧热为890.3KJ/mol.
含义:
在25℃101KPa时,
1molCH4完全燃烧时,放出890.3KJ的热量.
3.表示燃烧热的热化学方程式的书写:
应以1mol物质的标准来配平其余物质的化学计量数(常出现分数)
4.一定量可燃物完全燃烧时放出的热量
Q放=n(可燃物)
×
△H
CH4(g)+2O2(g)=CO2(g)+2H2O(g)
△H=-890.31KJ/mol
7(学案).
下列关于燃烧热的说法中正确的是
(
)
A.
在101kPa时,1mol物质完全燃烧时所放出的
热量,叫做该物质的燃烧热
B.常温下,可燃物燃烧放出的热量
C.在25℃、1.01×105Pa时,1mol纯物质完全燃
烧生成稳定的氧化物时所放出的热量
D.燃烧热随化学方程式前的化学计量数的改变而
改变
C
练习:
例3(学案).下列热化学方程式中,△H能正确表示物质的燃烧热的是(
)
A.CO(g)
+1/2O2(g)
==CO2(g)
△H=-283.0
kJ/mol
B.
C(s)
+1/2O2(g)
==CO(g)
△H=-110.5
kJ/mol
C.
H2(g)
+1/2O2(g)==H2O(g)
△H=-241.8
kJ/mol
D.2C8H18(l)
+25O2(g)==16CO2(g)+18H2O(l)
△H=-
11036
kJ/mol
A
2(学案).以下几个热化学方程式,表示碳或氢气燃烧热的热化学方程式是
(
)
A.
C(s)+1/2O2(g)===CO(g)
ΔH=
110.5
kJ/mol
B.
C(s)+O2(g)===CO2(g)
ΔH=
-393.5
kJ/mol
C.
2H2(g)+O2(g)===2
H2O(l)
ΔH=
-571.6
kJ/mol
D.
H2
(g)+O2
(g)===
H2O(g)
ΔH=
-241.8
kJ/mol
B
【例1】?
在
101
kPa时,1mol
CH4
完全燃烧生成CO2和液态H2O,放出
890
kJ的热量,CH4
的燃烧热为多少?1000
L
CH4(标准状况)燃烧后所产生的热量为多少?
【解】根据题意,在
101
kPa时,1mol
CH4
完全燃烧的热化学方程式为:
CH4(g)+2O2(g)=
CO2(g)+
2H2O(l)
ΔH=-890
kJ/mol
即CH4的燃烧热为
890
kJ/mol。
1000
L
CH4
(标准状况)的物质的量为:
n(CH4)=V(CH4)/Vm=1000L/22.4L·mol-1
=
44.6mol
1mol
CH4
完全燃烧放出890kJ的热量,44.6
molCH4
完全燃烧放出的热量为:
Q放=n(可燃物)
×
△H
=44.6
mol×890
kJ/mol=3.97×104kJ
答:CH4的燃烧热为
890
kJ/mol,1000
L
CH4(标准状况)完全燃烧产生的热量为
3.97×104kJ。
【例2】?
葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为:
C6H12O6(s)+6O2(g)=
6CO2(g)+6H2O(l)
ΔH=-2
800
kJ/mol
葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。计算
100
g葡萄糖在人体中完全氧化时所产生的热量。(葡萄糖的分子量为180)
解:根据题意,葡萄糖的燃烧热为2800kJ/mol。
100
g葡萄糖的物质的量为:
n(C6H12O6)=
m(C6H12O6
)/M(C6H12O6
)
=100g/180g·mol-1=0.556mol
1mol
C6H12O6完全燃烧放出2800
kJ的热量,0.556
mol
C6H12O6完全燃烧放出的热量为:
Q放=n(可燃物)
×
△H
=0.556
mol×2800
kJ/mol=1560
kJ
答:100g葡萄糖在人体中完全氧化时产生1560
kJ的热量。
★燃烧热与中和热的区别与联系
1mol可燃物
可能是1mol也可以是0.5mol(不限)
不限量
1mol
H2O
1mol反应物完全燃烧时放出的热量;不同的物质燃烧热不同
酸碱中和生成1molH2O时放出的热量,强酸强碱间的中和反应中和热大致相同,均约为57.3kJ/mol
1、已知:
2H2(g)+O2g)=2H2O(l)
ΔH=-571.6
kJ/mol
H2(g)+1/2O2(g)=H2O(g)
ΔH=-241.8
kJ/mol
求氢气的燃烧热。
练习:
2、石墨与金刚石的燃烧热是否相同,为什么?(查课本P7表1-1)请分别写出石墨和金刚石燃烧的热化学方程式
答:ΔH=-285.8
kJ/mol
不相同,因为石墨与金刚石的晶体结构不同,共具有的能量也不相同
C(石墨s)+
O2(g)=
CO2(g)
ΔH=
-393.5
kl/mol
C(金刚石s)+
O2(g)=
CO2(g)
ΔH=
-395.0
kl/mol
说明金刚石具有的总能量高,不稳定
3、下列各组物质的燃烧热相等的是:(
)
A.碳和一氧化碳
B.1moL碳和2moL碳
C.1moL乙炔和2moL碳
D.淀粉和纤维素
B
285.8
kJ/mol
则氢气的燃烧热△H为:
-285.8
kJ/mol
1、能源就是能提供
自然资源,包括
等。
2、我国目前使用的主要能源是
,是不能
。
3、能源是国民经济和社会发展的重要物质基础,它的开发和利用情况,可以用来衡量一个国家或地区的经济发展和科学技术水平
3.解决能源的办法是
,即开发
和节约
,提高能源的
。
4.现在探索开发的新能源有
等,
新能源的主要优势是
。
能量
化石燃料(煤、石油、天然气)
、阳光、生物能、风能、地热能、海洋(潮汐)能
化石燃料
再生
开源节流
新的能源
现有能源
利用率
太阳能、氢能、地热能、海洋(潮汐)能、生物能
资源丰富,可以再生,污染少
三、能源
讨论下列问题:
1、能源、一级能源、二级能源
例:下列属于一级能源的是:
属于二级能源的是:
A
风能
B电能
C
氢能
D
阳光
E
天然气
A
D
E
B
C
能
源:能提供能量的资源
一级能源:来自自然界未经转化的能源。
二级能源:一级能源经过转化得到的能源形式。
☆阅读P9《科学视野》
找出并打记:太阳能、氢能、地热能、风能各自的优缺点
1、选择燃料的标准是什么?
燃烧热、燃料的储量、开采运输储存的条件、价格、对生态环境的影响,等各方面综合考虑。
2、煤作为燃料的利弊?提高煤燃烧效率的措施有哪些?
思考与交流
3、1998年出现的全球温度大幅度升高,产生了显著的“厄尔尼诺”现象.干旱和暴雨灾难,危害了许多地区。为了防止气候变暖的进一步恶化,联合国环境保护组织于1998年通过大会要求各国减少工业排放量的气体是(
)
A.
二氧化硫
B.
二氧化碳
C.
氮的氧化物
D.
碳氢化合物
4、我国三峡工程所提供的清洁.廉价强劲.可再生的水电,相当于每年燃烧3×106t原煤的火力发电厂产生的电能。因此,三峡工程有助于控制
(
)
A.
温室效应
B.
酸雨
C.
白色污染
D.
破坏大气臭氧层
B
A
5.下列说法不正确的是
(
)
A.
化石燃料在任何条件下都能充分燃烧
B.
化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
C.
直接燃烧煤不如将煤进行深加工后再燃烧的效果好
D.
固体煤变为气体燃料后,燃烧效率将提高
6.为了减少大气污染,许多城市正大力推广汽车清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分均为
(
)
A.碳氢化合物
B.碳水化合物
C.氢气
D.醇类
A
A
谢谢观看,再见!
第一章
化学反应与能量
燃烧热
能源
[学习目标]:了解燃烧热的概念,能进行简单计算
[重点难点]:燃烧热的概念及计算。
【复习】什么叫中和热?如何计算?
在稀溶液中,酸跟碱发生中和反应而生成1mol
H2O的反应热叫中和热。
Q
=
mcΔt
×10-3
kJ
一、燃烧热
例2:实验测得101kPa时1molH2完全燃烧放出393.5
kJ的热量,这就是H2的燃烧热。
H2(g)+1/2O2(g)=H2O(l)
ΔH=-285.8
kJ/mol
例1:实验测得101kPa时1molC完全燃烧放出393.5
kJ的热量,这就是C的燃烧热。
C(s)+O2(g)=CO2(g)
ΔH=-393.5kJ/mol
一、燃烧热
1.燃烧热的的概念:
在25℃、101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。
为什么指定温度和压强?
生成物不能继续燃烧
C
--
CO2
(g)
S
–
SO2
(g)
H–
H2O(l)
单位:
kJ/mol
限定燃料的物质的量
2C8H18(l)+25O2(g)=16CO2+18H2O(l)
△H=-11036KJ/mol
思考:①C8H18的燃烧热是多少?
△H=-5518KJ/mol
②1mol
C8H18燃烧时放出了多少热?
5518KJ
一、燃烧热
1.燃烧热的的概念:
在25℃、101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。
注意:
Ⅰ、在101kPa时,完全燃烧生成稳定的氧化物
如:C→C02,H→H20(l),S→S02等
Ⅱ、燃烧热通常由实验测得
Ⅲ、可燃物以1mol为标准进行测量
Ⅳ、系数常用分数表示
2.表示的意义:
如:
CH4的燃烧热为890.3KJ/mol.
含义:
在25℃101KPa时,
1molCH4完全燃烧时,放出890.3KJ的热量.
3.表示燃烧热的热化学方程式的书写:
应以1mol物质的标准来配平其余物质的化学计量数(常出现分数)
4.一定量可燃物完全燃烧时放出的热量
Q放=n(可燃物)
×
△H
CH4(g)+2O2(g)=CO2(g)+2H2O(g)
△H=-890.31KJ/mol
7(学案).
下列关于燃烧热的说法中正确的是
(
)
A.
在101kPa时,1mol物质完全燃烧时所放出的
热量,叫做该物质的燃烧热
B.常温下,可燃物燃烧放出的热量
C.在25℃、1.01×105Pa时,1mol纯物质完全燃
烧生成稳定的氧化物时所放出的热量
D.燃烧热随化学方程式前的化学计量数的改变而
改变
C
练习:
例3(学案).下列热化学方程式中,△H能正确表示物质的燃烧热的是(
)
A.CO(g)
+1/2O2(g)
==CO2(g)
△H=-283.0
kJ/mol
B.
C(s)
+1/2O2(g)
==CO(g)
△H=-110.5
kJ/mol
C.
H2(g)
+1/2O2(g)==H2O(g)
△H=-241.8
kJ/mol
D.2C8H18(l)
+25O2(g)==16CO2(g)+18H2O(l)
△H=-
11036
kJ/mol
A
2(学案).以下几个热化学方程式,表示碳或氢气燃烧热的热化学方程式是
(
)
A.
C(s)+1/2O2(g)===CO(g)
ΔH=
110.5
kJ/mol
B.
C(s)+O2(g)===CO2(g)
ΔH=
-393.5
kJ/mol
C.
2H2(g)+O2(g)===2
H2O(l)
ΔH=
-571.6
kJ/mol
D.
H2
(g)+O2
(g)===
H2O(g)
ΔH=
-241.8
kJ/mol
B
【例1】?
在
101
kPa时,1mol
CH4
完全燃烧生成CO2和液态H2O,放出
890
kJ的热量,CH4
的燃烧热为多少?1000
L
CH4(标准状况)燃烧后所产生的热量为多少?
【解】根据题意,在
101
kPa时,1mol
CH4
完全燃烧的热化学方程式为:
CH4(g)+2O2(g)=
CO2(g)+
2H2O(l)
ΔH=-890
kJ/mol
即CH4的燃烧热为
890
kJ/mol。
1000
L
CH4
(标准状况)的物质的量为:
n(CH4)=V(CH4)/Vm=1000L/22.4L·mol-1
=
44.6mol
1mol
CH4
完全燃烧放出890kJ的热量,44.6
molCH4
完全燃烧放出的热量为:
Q放=n(可燃物)
×
△H
=44.6
mol×890
kJ/mol=3.97×104kJ
答:CH4的燃烧热为
890
kJ/mol,1000
L
CH4(标准状况)完全燃烧产生的热量为
3.97×104kJ。
【例2】?
葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为:
C6H12O6(s)+6O2(g)=
6CO2(g)+6H2O(l)
ΔH=-2
800
kJ/mol
葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。计算
100
g葡萄糖在人体中完全氧化时所产生的热量。(葡萄糖的分子量为180)
解:根据题意,葡萄糖的燃烧热为2800kJ/mol。
100
g葡萄糖的物质的量为:
n(C6H12O6)=
m(C6H12O6
)/M(C6H12O6
)
=100g/180g·mol-1=0.556mol
1mol
C6H12O6完全燃烧放出2800
kJ的热量,0.556
mol
C6H12O6完全燃烧放出的热量为:
Q放=n(可燃物)
×
△H
=0.556
mol×2800
kJ/mol=1560
kJ
答:100g葡萄糖在人体中完全氧化时产生1560
kJ的热量。
★燃烧热与中和热的区别与联系
1mol可燃物
可能是1mol也可以是0.5mol(不限)
不限量
1mol
H2O
1mol反应物完全燃烧时放出的热量;不同的物质燃烧热不同
酸碱中和生成1molH2O时放出的热量,强酸强碱间的中和反应中和热大致相同,均约为57.3kJ/mol
1、已知:
2H2(g)+O2g)=2H2O(l)
ΔH=-571.6
kJ/mol
H2(g)+1/2O2(g)=H2O(g)
ΔH=-241.8
kJ/mol
求氢气的燃烧热。
练习:
2、石墨与金刚石的燃烧热是否相同,为什么?(查课本P7表1-1)请分别写出石墨和金刚石燃烧的热化学方程式
答:ΔH=-285.8
kJ/mol
不相同,因为石墨与金刚石的晶体结构不同,共具有的能量也不相同
C(石墨s)+
O2(g)=
CO2(g)
ΔH=
-393.5
kl/mol
C(金刚石s)+
O2(g)=
CO2(g)
ΔH=
-395.0
kl/mol
说明金刚石具有的总能量高,不稳定
3、下列各组物质的燃烧热相等的是:(
)
A.碳和一氧化碳
B.1moL碳和2moL碳
C.1moL乙炔和2moL碳
D.淀粉和纤维素
B
285.8
kJ/mol
则氢气的燃烧热△H为:
-285.8
kJ/mol
1、能源就是能提供
自然资源,包括
等。
2、我国目前使用的主要能源是
,是不能
。
3、能源是国民经济和社会发展的重要物质基础,它的开发和利用情况,可以用来衡量一个国家或地区的经济发展和科学技术水平
3.解决能源的办法是
,即开发
和节约
,提高能源的
。
4.现在探索开发的新能源有
等,
新能源的主要优势是
。
能量
化石燃料(煤、石油、天然气)
、阳光、生物能、风能、地热能、海洋(潮汐)能
化石燃料
再生
开源节流
新的能源
现有能源
利用率
太阳能、氢能、地热能、海洋(潮汐)能、生物能
资源丰富,可以再生,污染少
三、能源
讨论下列问题:
1、能源、一级能源、二级能源
例:下列属于一级能源的是:
属于二级能源的是:
A
风能
B电能
C
氢能
D
阳光
E
天然气
A
D
E
B
C
能
源:能提供能量的资源
一级能源:来自自然界未经转化的能源。
二级能源:一级能源经过转化得到的能源形式。
☆阅读P9《科学视野》
找出并打记:太阳能、氢能、地热能、风能各自的优缺点
1、选择燃料的标准是什么?
燃烧热、燃料的储量、开采运输储存的条件、价格、对生态环境的影响,等各方面综合考虑。
2、煤作为燃料的利弊?提高煤燃烧效率的措施有哪些?
思考与交流
3、1998年出现的全球温度大幅度升高,产生了显著的“厄尔尼诺”现象.干旱和暴雨灾难,危害了许多地区。为了防止气候变暖的进一步恶化,联合国环境保护组织于1998年通过大会要求各国减少工业排放量的气体是(
)
A.
二氧化硫
B.
二氧化碳
C.
氮的氧化物
D.
碳氢化合物
4、我国三峡工程所提供的清洁.廉价强劲.可再生的水电,相当于每年燃烧3×106t原煤的火力发电厂产生的电能。因此,三峡工程有助于控制
(
)
A.
温室效应
B.
酸雨
C.
白色污染
D.
破坏大气臭氧层
B
A
5.下列说法不正确的是
(
)
A.
化石燃料在任何条件下都能充分燃烧
B.
化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
C.
直接燃烧煤不如将煤进行深加工后再燃烧的效果好
D.
固体煤变为气体燃料后,燃烧效率将提高
6.为了减少大气污染,许多城市正大力推广汽车清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分均为
(
)
A.碳氢化合物
B.碳水化合物
C.氢气
D.醇类
A
A
谢谢观看,再见!
