新人教版选修四高中化学4.1《原电池》2课时(31张PPT)
文档属性
| 名称 | 新人教版选修四高中化学4.1《原电池》2课时(31张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-08 08:50:40 | ||
图片预览





文档简介
(共31张PPT)
第四章
电化学基础
第一节
原电池
第1课时
3、构成条件
1、定义:
两极、一液、闭合、自发
化学能转化为电能的装置
2、原理:
电极
电子流向
电流方向
确定
判断
(电子从失电子的一边沿导线流出)
(与电子流向相反)
(电流从正极流向负极)
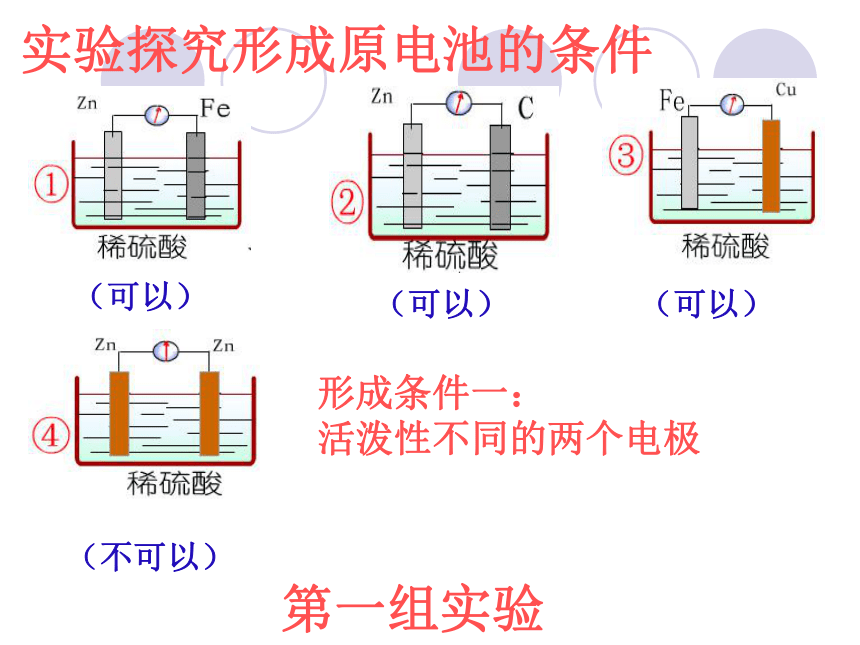
实验探究形成原电池的条件
(可以)
(可以)
(可以)
(不可以)
形成条件一:
活泼性不同的两个电极
第一组实验
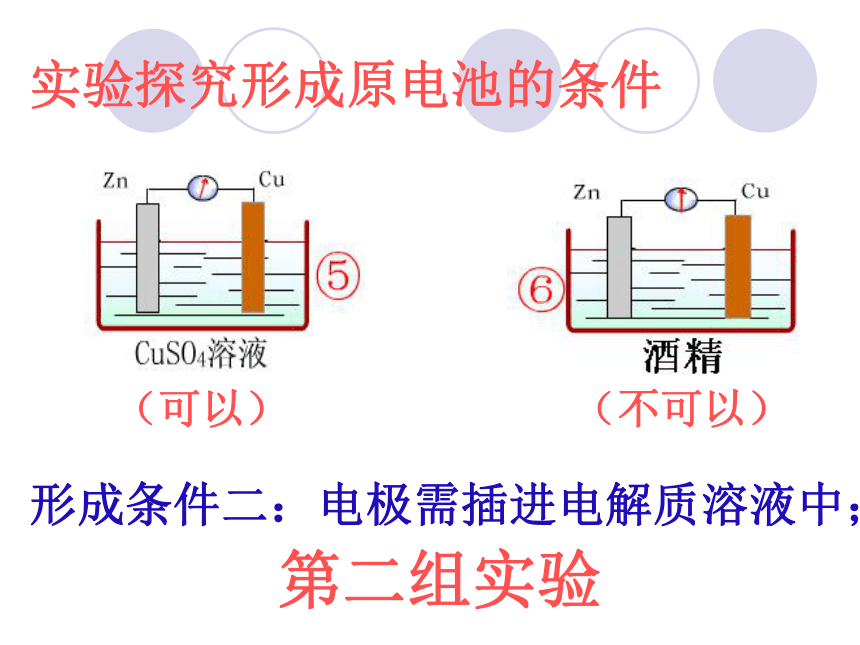
(可以)
(不可以)
形成条件二:电极需插进电解质溶液中;
第二组实验
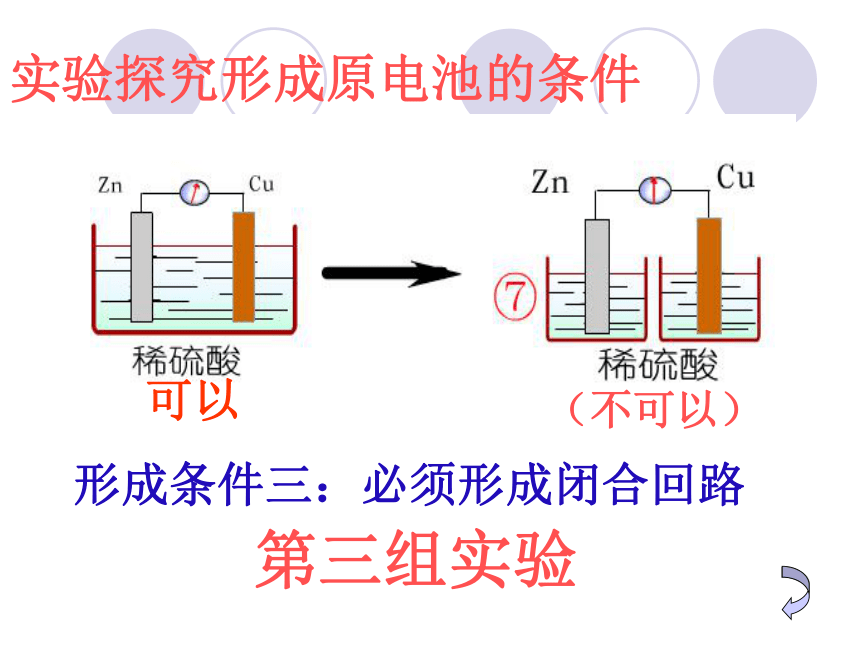
实验探究形成原电池的条件
第三组实验
实验探究形成原电池的条件
形成条件三:必须形成闭合回路
(不可以)
可以
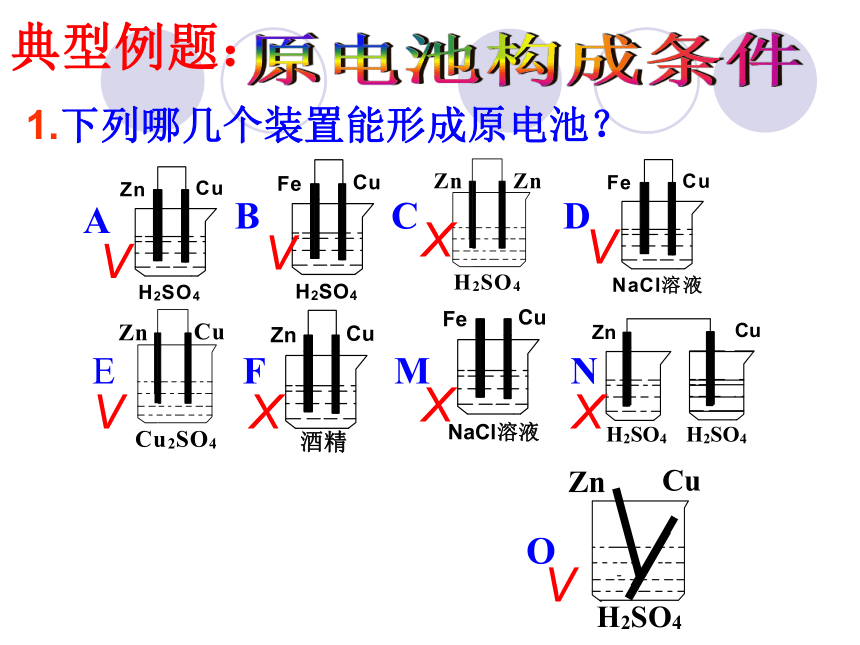
A
B
C
D
E
F
M
N
1.下列哪几个装置能形成原电池?
O
V
X
V
V
X
X
X
V
典型例题:
V
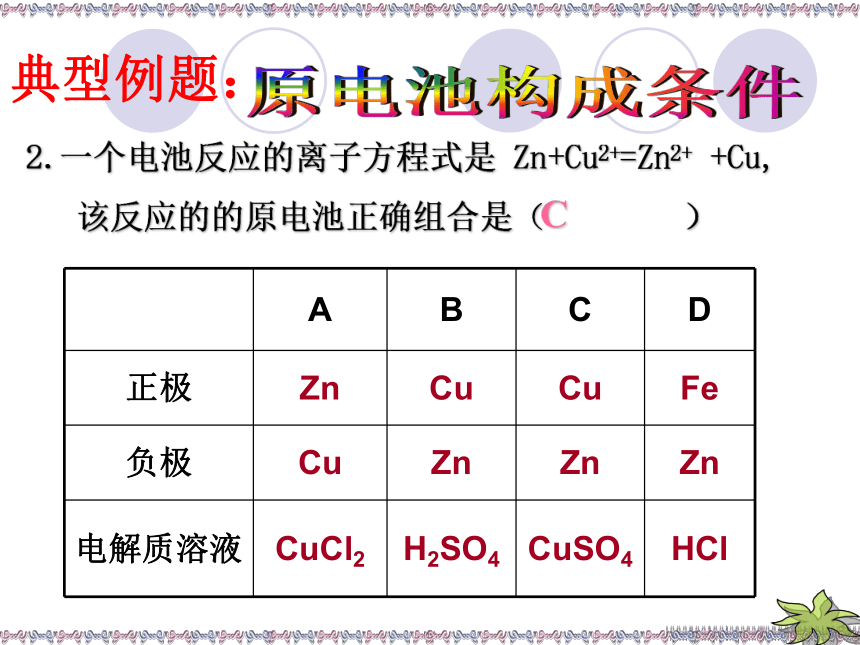
2.一个电池反应的离子方程式是
Zn+Cu2+=Zn2+
+Cu,
该反应的的原电池正确组合是(
)
C
典型例题:
A
B
C
D
正极
Zn
Cu
Cu
Fe
负极
Cu
Zn
Zn
Zn
电解质溶液
CuCl2
H2SO4
CuSO4
HCl
下列装置中属于原电池的是
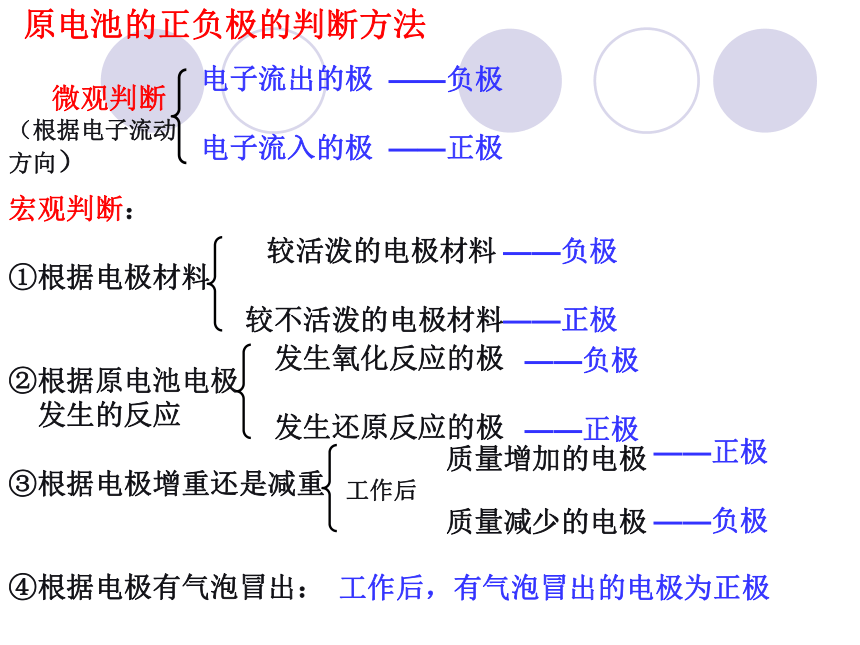
原电池的正负极的判断方法
电子流出的极
电子流入的极
——负极
——正极
较活泼的电极材料
较不活泼的电极材料
质量增加的电极
工作后
质量减少的电极
——负极
——正极
——正极
——负极
工作后,有气泡冒出的电极为正极
发生氧化反应的极
发生还原反应的极
——负极
——正极
新课标人教版选修四化学反应原理
第四章
电化学基础
第一节
原
电
池
(第2课时)
不但效率低,而且时间稍长电流就很快减弱
这是什么原因造成的呢?有没有什么改进措施?
主要原因:(一)由于在铜极上很快就聚集了许多氢气泡,把铜极跟稀硫酸逐渐隔开,这样就增加了电池的内阻,使电流不能畅通。这种作用称为极化作用。(二)铜离子会在锌棒表面发生反应析出铜单质,阻止反应继续发生。
对锌铜原电
池工作原理的进一步探究
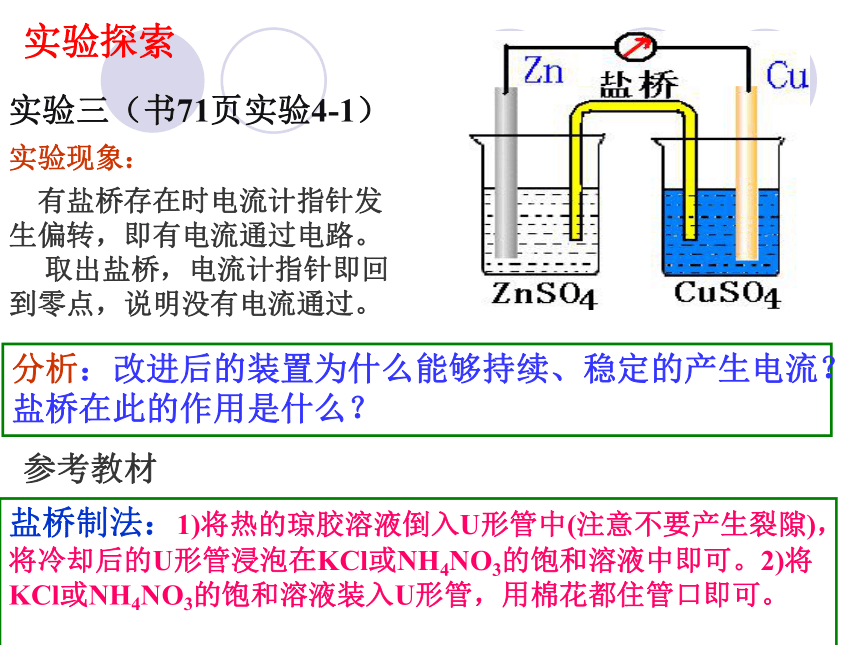
为了避免发生这种现象,设计如图(书P71图4-1)所示的原电池装置,你能解释它的工作原理吗?
?提出问题:原电池的优、缺点?
实验三(书71页实验4-1)
实验探索
实验现象:
分析:改进后的装置为什么能够持续、稳定的产生电流?盐桥在此的作用是什么?
参考教材
有盐桥存在时电流计指针发生偏转,即有电流通过电路。
取出盐桥,电流计指针即回到零点,说明没有电流通过。
盐桥制法:1)将热的琼胶溶液倒入U形管中(注意不要产生裂隙),将冷却后的U形管浸泡在KCl或NH4NO3的饱和溶液中即可。2)将KCl或NH4NO3的饱和溶液装入U形管,用棉花都住管口即可。
(2)盐桥的作用是什么?
4、双液原电池的工作原理(有关概念)
(1)盐桥----装有饱和的KCl溶液和琼脂制成的
胶冻
a.形成闭合回路。
b.平衡电荷。
导线的作用:传递电子,沟通外电路。
而盐桥的作用:沟通内电路。
(3)双液原电池的优点:
能产生持续、稳定的电流。
利用反应Zn+2FeCl3=2FeCl2+ZnCl2
,设计一个单液原电池,一个双液原电池(使用盐桥),画出原电池的示意图,并写出电极反应。
参考答案
(+)
(-)
负极(Zn):Zn-2e-=Zn2+(氧化反应)
正极(Pt或C):2Fe3++2e-=2Fe2+(还原反应)
(+)
(-)
5、原电池的设计:
请将氧化还原反应
Cu+2Ag+
=
Cu2++2Ag
设计成一个能产生持续、稳定电流的原电池装置
Cu
CuSO4
Ag
AgNO3
(2007年高考海南化学卷)
依据氧化还原反应:2Ag+(aq)+Cu(s)
=
Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是________;
电解质溶液Y是___________;
(2)银电极为电池的________极,
发生的电极反应为_________________
X电极上发生的电极反应为____________________________;
(3)外电路中的电子是从_______电极流向________电极。
铜(或Cu)
AgNO3溶液
正
Ag++e-
→
Ag
Cu
-2e-
→
Cu2+
负(Cu)
正(Ag)
(1)比较金属活动性强弱。
例1:
下列叙述中,可以说明金属甲比乙活泼性强的是
C.将甲乙作电极组成原电池时甲是负极;
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲
上有H2气放出;
B.在氧化–还原反应中,甲比乙失去的电子多;
D.同价态的阳离子,甲比乙的氧化性强;
(C)
6、原电池原理应用:
第3课时
(2)比较反应速率
例2
:
下列制氢气的反应速率最快的是
粗锌和
1mol/L
盐酸;
B.
A.
纯锌和1mol/L
硫酸;
纯锌和18
mol/L
硫酸;
C.
粗锌和1mol/L
硫酸的反应中加入几滴CuSO4溶液。
D.
(
D
)
原电池原理应用:
(3)比较金属腐蚀的快慢
例3:
下列各情况,在其中Fe片腐蚀由快到慢的顺序是
(2)
(1)
(3)
原电池原理应用:
例4:
下列装置中四块相同的Zn片,放置一段时间后腐蚀速
率由慢到快的顺序是
(4)
(2)
(1)
(3)
(4)原电池原理的综合应用
例6:市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等。
“热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。
“热敷袋”是利用
放出热量。
2)炭粉的主要作用是:
3)加入氯化钠的主要作用是
。
4)木屑的作用是
。
铁被氧化
与铁屑、氯化钠溶液构成原电池,加速铁屑的氧化
氯化钠溶于水、形成电解质溶液
使用“热敷袋”时受热均匀
原电池原理应用:
拓展练习
(1)若烧杯中溶液为稀硫酸,则观察到
的现象:
两极反应式为:正极
;
负极
。
该装置将
转化为
。
(2)若烧杯中溶液为氢氧化钠溶液,
则负极为
,
总反应方程为
。
镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;
Mg-2e—=Mg2+
化学能
电能
2H++2e-=H2
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Al-3e-+2OH-=H2O+AlO-
判断溶液pH值变化
例5:
在Cu-Zn原电池中,200mLH2SO4
溶液的浓度为0.125mol/L
,
若工作一段时间后,从装置中共收集到
0.168L升气体,则流过导线的电子为————
mol,溶液的pH值变_________?(溶液体积变化忽略不计)
0.2
解得:
y
=0.015
(mol)
x
=0.015
(mol)
=
=3.75×
10﹣
4(mol/L
)
∴pH
=-lg3.75
×10-4
=4
-lg3.75
答:……
-0.015
根据电极反应:
正极:
负极:
Zn-2e-=Zn2+
2H++2e-
=H2↑
得:
2
2
22.4
x
y
0.168
解:
0.2×0.125×2
c(H+)余
∴
2H+
——
2e——H2↑
大
0.015
原电池原理应用:
小
结:原电池
1、定义
2、工作原理
3、形成条件
4、双液原电池
盐桥
盐桥的作用
工作原理
5.
设计原电池
2.比较反应速率
1.比较金属活动性强弱;
3.比较金属腐蚀快慢
(即将金属作为原电池的正极而受到保护。如在铁器表面镀锌。)
6、原电池的应用:
4.解释某些化学现象
反应式
负极材料(失去电子的金属)
确定
电解质溶液
在一
瓣橘子上相隔0.5cm分别插一小铜片
和铝片,把铜片和铝片的另一端通过导线接
触耳机的两极,试试能否听到“嘎嘎”声。能
够从耳机中听到“嘎嘎”声,说明了什么?用
其他金属、水果、液体再试一试。
研
究
性
学
习
1、X、Y、Z都是金属,把X浸入Z的硫酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为负极。X、Y、Z三种金属的活动性顺序为
A、X>Y
>
Z
B、X
>
Z
>
Y
C、Y
>
X
>
Z
D、Y
>
Z
>
X
C
2、等质量的两份锌粉a、b,分别加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液,下列图表示产生H2的体积(V)与时间(t)的关系,其中正确的是:
D
3、把A、B、C、D四块金属片用导线两两相连,浸入稀硫酸中组成原电池。若A、B相连时,A为负极;C、D相连时,D上产生大量气泡;A、C相连时,电流由C经导线流向A;B、D相连时,电子由D经导线流向B,则此4种金属的活动性由强到弱的顺序为
A、A>B>C
>
D
B、A
>
C
>
D
>
B
C、C
>
A
>
B
>
D
D、
B
>
A
>
C
>
D
B
4、如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是
(
D
)
A.
铁圈和银圈左右摇摆不定;
B.
保持平衡状态;
C.
铁圈向下倾斜;
D.
银圈向下倾斜;
第四章
电化学基础
第一节
原电池
第1课时
3、构成条件
1、定义:
两极、一液、闭合、自发
化学能转化为电能的装置
2、原理:
电极
电子流向
电流方向
确定
判断
(电子从失电子的一边沿导线流出)
(与电子流向相反)
(电流从正极流向负极)
实验探究形成原电池的条件
(可以)
(可以)
(可以)
(不可以)
形成条件一:
活泼性不同的两个电极
第一组实验
(可以)
(不可以)
形成条件二:电极需插进电解质溶液中;
第二组实验
实验探究形成原电池的条件
第三组实验
实验探究形成原电池的条件
形成条件三:必须形成闭合回路
(不可以)
可以
A
B
C
D
E
F
M
N
1.下列哪几个装置能形成原电池?
O
V
X
V
V
X
X
X
V
典型例题:
V
2.一个电池反应的离子方程式是
Zn+Cu2+=Zn2+
+Cu,
该反应的的原电池正确组合是(
)
C
典型例题:
A
B
C
D
正极
Zn
Cu
Cu
Fe
负极
Cu
Zn
Zn
Zn
电解质溶液
CuCl2
H2SO4
CuSO4
HCl
下列装置中属于原电池的是
原电池的正负极的判断方法
电子流出的极
电子流入的极
——负极
——正极
较活泼的电极材料
较不活泼的电极材料
质量增加的电极
工作后
质量减少的电极
——负极
——正极
——正极
——负极
工作后,有气泡冒出的电极为正极
发生氧化反应的极
发生还原反应的极
——负极
——正极
新课标人教版选修四化学反应原理
第四章
电化学基础
第一节
原
电
池
(第2课时)
不但效率低,而且时间稍长电流就很快减弱
这是什么原因造成的呢?有没有什么改进措施?
主要原因:(一)由于在铜极上很快就聚集了许多氢气泡,把铜极跟稀硫酸逐渐隔开,这样就增加了电池的内阻,使电流不能畅通。这种作用称为极化作用。(二)铜离子会在锌棒表面发生反应析出铜单质,阻止反应继续发生。
对锌铜原电
池工作原理的进一步探究
为了避免发生这种现象,设计如图(书P71图4-1)所示的原电池装置,你能解释它的工作原理吗?
?提出问题:原电池的优、缺点?
实验三(书71页实验4-1)
实验探索
实验现象:
分析:改进后的装置为什么能够持续、稳定的产生电流?盐桥在此的作用是什么?
参考教材
有盐桥存在时电流计指针发生偏转,即有电流通过电路。
取出盐桥,电流计指针即回到零点,说明没有电流通过。
盐桥制法:1)将热的琼胶溶液倒入U形管中(注意不要产生裂隙),将冷却后的U形管浸泡在KCl或NH4NO3的饱和溶液中即可。2)将KCl或NH4NO3的饱和溶液装入U形管,用棉花都住管口即可。
(2)盐桥的作用是什么?
4、双液原电池的工作原理(有关概念)
(1)盐桥----装有饱和的KCl溶液和琼脂制成的
胶冻
a.形成闭合回路。
b.平衡电荷。
导线的作用:传递电子,沟通外电路。
而盐桥的作用:沟通内电路。
(3)双液原电池的优点:
能产生持续、稳定的电流。
利用反应Zn+2FeCl3=2FeCl2+ZnCl2
,设计一个单液原电池,一个双液原电池(使用盐桥),画出原电池的示意图,并写出电极反应。
参考答案
(+)
(-)
负极(Zn):Zn-2e-=Zn2+(氧化反应)
正极(Pt或C):2Fe3++2e-=2Fe2+(还原反应)
(+)
(-)
5、原电池的设计:
请将氧化还原反应
Cu+2Ag+
=
Cu2++2Ag
设计成一个能产生持续、稳定电流的原电池装置
Cu
CuSO4
Ag
AgNO3
(2007年高考海南化学卷)
依据氧化还原反应:2Ag+(aq)+Cu(s)
=
Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是________;
电解质溶液Y是___________;
(2)银电极为电池的________极,
发生的电极反应为_________________
X电极上发生的电极反应为____________________________;
(3)外电路中的电子是从_______电极流向________电极。
铜(或Cu)
AgNO3溶液
正
Ag++e-
→
Ag
Cu
-2e-
→
Cu2+
负(Cu)
正(Ag)
(1)比较金属活动性强弱。
例1:
下列叙述中,可以说明金属甲比乙活泼性强的是
C.将甲乙作电极组成原电池时甲是负极;
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲
上有H2气放出;
B.在氧化–还原反应中,甲比乙失去的电子多;
D.同价态的阳离子,甲比乙的氧化性强;
(C)
6、原电池原理应用:
第3课时
(2)比较反应速率
例2
:
下列制氢气的反应速率最快的是
粗锌和
1mol/L
盐酸;
B.
A.
纯锌和1mol/L
硫酸;
纯锌和18
mol/L
硫酸;
C.
粗锌和1mol/L
硫酸的反应中加入几滴CuSO4溶液。
D.
(
D
)
原电池原理应用:
(3)比较金属腐蚀的快慢
例3:
下列各情况,在其中Fe片腐蚀由快到慢的顺序是
(2)
(1)
(3)
原电池原理应用:
例4:
下列装置中四块相同的Zn片,放置一段时间后腐蚀速
率由慢到快的顺序是
(4)
(2)
(1)
(3)
(4)原电池原理的综合应用
例6:市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等。
“热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。
“热敷袋”是利用
放出热量。
2)炭粉的主要作用是:
3)加入氯化钠的主要作用是
。
4)木屑的作用是
。
铁被氧化
与铁屑、氯化钠溶液构成原电池,加速铁屑的氧化
氯化钠溶于水、形成电解质溶液
使用“热敷袋”时受热均匀
原电池原理应用:
拓展练习
(1)若烧杯中溶液为稀硫酸,则观察到
的现象:
两极反应式为:正极
;
负极
。
该装置将
转化为
。
(2)若烧杯中溶液为氢氧化钠溶液,
则负极为
,
总反应方程为
。
镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;
Mg-2e—=Mg2+
化学能
电能
2H++2e-=H2
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Al-3e-+2OH-=H2O+AlO-
判断溶液pH值变化
例5:
在Cu-Zn原电池中,200mLH2SO4
溶液的浓度为0.125mol/L
,
若工作一段时间后,从装置中共收集到
0.168L升气体,则流过导线的电子为————
mol,溶液的pH值变_________?(溶液体积变化忽略不计)
0.2
解得:
y
=0.015
(mol)
x
=0.015
(mol)
=
=3.75×
10﹣
4(mol/L
)
∴pH
=-lg3.75
×10-4
=4
-lg3.75
答:……
-0.015
根据电极反应:
正极:
负极:
Zn-2e-=Zn2+
2H++2e-
=H2↑
得:
2
2
22.4
x
y
0.168
解:
0.2×0.125×2
c(H+)余
∴
2H+
——
2e——H2↑
大
0.015
原电池原理应用:
小
结:原电池
1、定义
2、工作原理
3、形成条件
4、双液原电池
盐桥
盐桥的作用
工作原理
5.
设计原电池
2.比较反应速率
1.比较金属活动性强弱;
3.比较金属腐蚀快慢
(即将金属作为原电池的正极而受到保护。如在铁器表面镀锌。)
6、原电池的应用:
4.解释某些化学现象
反应式
负极材料(失去电子的金属)
确定
电解质溶液
在一
瓣橘子上相隔0.5cm分别插一小铜片
和铝片,把铜片和铝片的另一端通过导线接
触耳机的两极,试试能否听到“嘎嘎”声。能
够从耳机中听到“嘎嘎”声,说明了什么?用
其他金属、水果、液体再试一试。
研
究
性
学
习
1、X、Y、Z都是金属,把X浸入Z的硫酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为负极。X、Y、Z三种金属的活动性顺序为
A、X>Y
>
Z
B、X
>
Z
>
Y
C、Y
>
X
>
Z
D、Y
>
Z
>
X
C
2、等质量的两份锌粉a、b,分别加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液,下列图表示产生H2的体积(V)与时间(t)的关系,其中正确的是:
D
3、把A、B、C、D四块金属片用导线两两相连,浸入稀硫酸中组成原电池。若A、B相连时,A为负极;C、D相连时,D上产生大量气泡;A、C相连时,电流由C经导线流向A;B、D相连时,电子由D经导线流向B,则此4种金属的活动性由强到弱的顺序为
A、A>B>C
>
D
B、A
>
C
>
D
>
B
C、C
>
A
>
B
>
D
D、
B
>
A
>
C
>
D
B
4、如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是
(
D
)
A.
铁圈和银圈左右摇摆不定;
B.
保持平衡状态;
C.
铁圈向下倾斜;
D.
银圈向下倾斜;
