沪教版(上海)化学九年级上册 3.3 溶液的酸碱性 教案+反思
文档属性
| 名称 | 沪教版(上海)化学九年级上册 3.3 溶液的酸碱性 教案+反思 |

|
|
| 格式 | doc | ||
| 文件大小 | 49.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-07 00:00:00 | ||
图片预览



文档简介
溶液的酸碱性
【教学目标】
一、知识与技能
1.了解化合物的分类。
2.知道pH值的范围和溶液酸碱性的关系。
3.初步学会石蕊、酚酞、pH试纸的测试方法。
二、过程与方法
培养发现问题、解决问题的能力。
三、情感态度与价值观
感受到溶液酸碱性在生活中的意义。
【教学重难点】
1.溶液酸碱性的测试方法。
2.pH范围和溶液酸碱性关系。
【教学准备】
药品:盐酸、澄清石灰水、蒸馏水、石蕊、氯化铵溶液、碳酸钠溶液、氯化钠溶液、酚酞、氢氧化钠溶液、pH试纸、学生自带的一些液体
仪器:试管、玻璃片、玻璃棒
【教学流程】
教学内容 教师活动 学生活动 设计意图
引 入 引言
我们能用什么方法知道橙子是酸性物质?
提问
实验室的一些溶液,我们不能用嘴尝,那么应该用什么试剂来测试呢? 学生回答:用嘴尝。
学生回答:用石蕊、酚酞。 引导学生创设问题,激发学生学习的兴趣。
溶 液
的
酸
碱
性
和
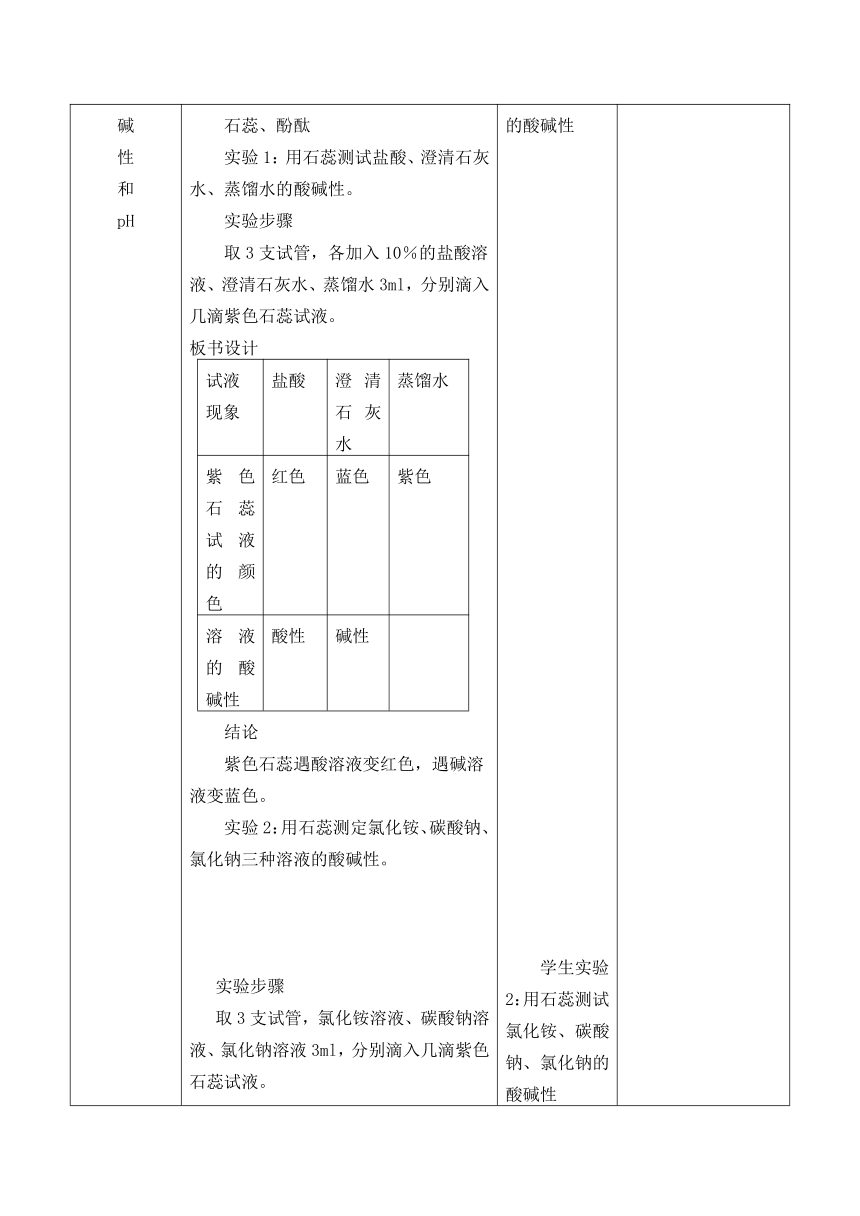
pH 板书设计
溶液的酸碱性
一、溶液的酸碱性和pH
酸碱指示剂:
石蕊、酚酞
实验1:用石蕊测试盐酸、澄清石灰水、蒸馏水的酸碱性。
实验步骤
取3支试管,各加入10%的盐酸溶液、澄清石灰水、蒸馏水3ml,分别滴入几滴紫色石蕊试液。
板书设计
试液
现象
盐酸
澄清石灰水
蒸馏水
紫色石蕊试液的颜色
红色
蓝色
紫色
溶液的酸碱性
酸性
碱性
结论
紫色石蕊遇酸溶液变红色,遇碱溶液变蓝色。
实验2:用石蕊测定氯化铵、碳酸钠、氯化钠三种溶液的酸碱性。
实验步骤
取3支试管,氯化铵溶液、碳酸钠溶液、氯化钠溶液3ml,分别滴入几滴紫色石蕊试液。
试液
现象
氯化铵
碳酸钠
氯化钠
紫色石蕊试液的颜色
红色
蓝色
紫色
溶液的酸碱性
酸性
碱性
结论
紫色石蕊遇酸溶液变红色,遇碱溶液变蓝色。
讲述
通过上面两组实验,我们发现酸溶液显酸性,碱溶液显碱性,氯化铵、碳酸钠、氯化钠这些不是酸也不是碱,也有不同的酸碱性。
因此,根据元素的组成在化合物中,除了氧化物外,还可以分酸、碱、盐。
板书设计
化合物分类
氧化物:由两种元素组成的化合物中,其中一种是氧元素。
酸:由氢元素和酸根组成的化合物。
碱:由金属元素和氢氧根组成的化合物。
盐:由金属元素(或铵根)和酸根组成的化合物。
板书设计
根据下列化合物的组成,判断它们各属于氧化物、酸、碱或盐?氯化钾、氧化铁、氢氧化钡、硝酸、碳酸钠。
提示
先将各物质名称变为化学式,然后在一一判断。
实验3:用酚酞试液测定溶液的酸碱性。
实验步骤
取5支试管,分别加入下述五种试液,再滴加1~2滴酚酞试液。
试液现象
盐酸
氯化铵
蒸馏水
氢氧化钠
碳酸钠
酚酞试液的颜色
无色
无色
无色
红色
红色
溶液的酸碱性
碱性
碱性
结论
酚酞试液遇碱性溶液变红色。
板书设计
小结:紫色石蕊试液遇酸性溶液变红色,遇碱性溶液变蓝色
碱性溶液使无色酚酞试液变红色
设问
通过实验我们发现盐酸和氯化铵溶液都呈酸性,氢氧化钠溶液和碳酸钠溶液都呈碱性,那么,哪种物质酸性更强,哪种物质碱性更强?
讲述
我们可以用pH试纸来测试。
并讲述pH试纸的使用方法。
注意:用pH试纸测试溶液酸碱性强弱时,可以将玻璃棒蘸取试液后沾到pH试纸上,再把试纸呈现的颜色与比色卡对照。
板书设计
pH试纸:
pH=7的溶液是中性溶液
pH>7的溶液是碱性溶液,pH越大,碱性越强。
pH<7的溶液是酸性溶液,pH越小,酸性越强。
盐酸
氯化铵
蒸馏水
氢氧化钠
碳酸钠
pH
1
4
7
13
12
结论:
pH>7的是碱性溶液,有氢氧化钠、碳酸钠
pH=7的是中性溶液,有蒸馏水
pH<7的是酸性溶液,有盐酸和氯化铵
在所给的试剂样品中,酸性最强的溶液是盐酸,碱性最强的溶液是氢氧化钠。 学生实验1:用石蕊测试盐酸、澄清石灰水、蒸馏水的酸碱性
学生实验2:用石蕊测试氯化铵、碳酸钠、氯化钠的酸碱性
得出结论:紫色石蕊遇酸性溶液变红色,遇碱性溶液变蓝色,遇中性溶液不变色。
巩固练习:根据下列化合物的组成,判断它们各属于氧化物、酸、碱或盐?
学生实验3:用酚酞测试盐酸、氯化铵、蒸馏水、氢氧化钠、碳酸钠的酸碱性
得出结论:酚酞试液遇碱性溶液变红色。遇中性、酸性溶液不变色。
学生小结:紫色石蕊试液遇酸性溶液变红色,遇碱性溶液变蓝色。碱性溶液使无色酚酞试液变红色
学生实验4:用pH试纸测定盐酸、氯化铵溶液、蒸馏水、氢氧化钠溶液、碳酸钠溶液的pH
得出结论,并在书上相应位置记录。 运用已学知识进行实验,注意实验的基本操作。
在实验过程中发现问题解决问题
创设新问题。
引入探究。
溶 液
的
酸
碱
性
与
生
活
的
关
系 板书设计
二、溶液的酸碱性与生活的关系
讲述
人体中各种体液的pH对人体的健康有着重要的影响,这是因为人体中各种生物化学反应都必须再适宜和稳定的pH范围中进行。
阅读
人体中一些体液的pH。
讲述
学习了溶液酸碱性的测试,下面我们就测试一下同学们带来的一些物质的酸碱性。
思考
如何利用溶液的酸碱性解释生活中遇到的一些问题。
讲述
在实验室里我们常用到的酸溶液,有硝酸、盐酸、硫酸和醋酸。常用到的碱溶液有石灰水、氢氧化钠、氨水。
说明
酸溶液显酸性,碱溶液显碱性,一些既不是酸也不是碱,它们的溶液也具有一定的酸碱性。
举例
纯碱不是碱,而它的水溶液呈碱性。 学生实验5:测试我们生活中的一些物质。
学生讨论:溶液酸碱性与生活的关系,解决生活中碰到的一些问题。 巩固pH的测试方法。解决生活中碰到的问题。
体会生活中处处都有化学原理
课 的
小
结 小结:
1.常见的酸碱指示计以及测试方法。
2.溶液的酸碱性与生活的关系 师生共同完成。
【板书设计】
溶液的酸碱性 一、溶液的酸碱性和pH
1.酸碱指示剂:
石蕊、酚酞
实验1:用石蕊测试盐酸、澄清石灰水、蒸馏水的酸碱性。
试液
现象
盐酸
澄清石灰水
蒸馏水
紫色石蕊试液的颜色
红色
蓝色
紫色
溶液的酸碱性
酸性
碱性
实验2:用石蕊测定氯化铵、碳酸钠、氯化钠三种溶液的酸碱性。
试液现象
氯化铵
碳酸钠
氯化钠
紫色石蕊试液的颜色
红色
蓝色
紫色
溶液的酸碱性
酸性
碱性
化合物分类
氧化物:由两种元素组成的化合物中,其中一种是氧元素。
酸:由氢元素和酸根组成的化合物。
碱:由金属元素和氢氧根组成的化合物。
盐:由金属元素(或铵根)和酸根组成的化合物。
练习:根据下列化合物的组成,判断它们各属于氧化物、酸、碱或盐?氯化 钾、氧化铁、氢氧化钡、硝酸、碳酸钠。
实验3:用酚酞试液测定溶液的酸碱性。
试液
现象
盐酸
氯化铵
蒸馏水
氢氧化钠
碳酸钠
酚酞试液的颜色
无色
无色
无色
红色
红色
溶液的酸碱性
碱性
碱性
小结:紫色石蕊试液遇酸性溶液变红色,遇碱性溶液变蓝色
碱性溶液使无色酚酞试液变红色
pH试纸:
pH=7的溶液是中性溶液
pH>7的溶液是碱性溶液,pH越大,碱性越强。
pH<7的溶液是酸性溶液,pH越小,酸性越强。
盐酸
氯化铵
蒸馏水
氢氧化钠
碳酸钠
pH
1
4
7
13
12
pH>7的是碱性溶液,有氢氧化钠、碳酸钠
pH=7的是中性溶液,有蒸馏水
pH<7的是酸性溶液,有盐酸和氯化铵
其中酸性最强的溶液是盐酸,碱性最强的溶液是氢氧化钠
二、溶液的酸碱性与生活的关系
常用到的酸溶液:有硝酸、盐酸、硫酸和醋酸
常用到的碱溶液有石灰水、氢氧化钠、氨水。
【教学反思】
本节教学,我们可以“边探究边实验”,课前要求学生准备一些各种果汁、洗涤剂等样品,教师也可准备一些生活中的物品,进行当堂测定。在测定中,一是最好使用精密pH试纸;二是每组学生只测定1~2种样品,然后将测定结果汇总交流,谈谈溶液的酸碱性与生活的联系。例如,有学生测得茶水是显碱性的,而橙汁是显酸性的,因此我们可以在有茶垢的杯子里倒点橙汁把它洗干净。
【教学目标】
一、知识与技能
1.了解化合物的分类。
2.知道pH值的范围和溶液酸碱性的关系。
3.初步学会石蕊、酚酞、pH试纸的测试方法。
二、过程与方法
培养发现问题、解决问题的能力。
三、情感态度与价值观
感受到溶液酸碱性在生活中的意义。
【教学重难点】
1.溶液酸碱性的测试方法。
2.pH范围和溶液酸碱性关系。
【教学准备】
药品:盐酸、澄清石灰水、蒸馏水、石蕊、氯化铵溶液、碳酸钠溶液、氯化钠溶液、酚酞、氢氧化钠溶液、pH试纸、学生自带的一些液体
仪器:试管、玻璃片、玻璃棒
【教学流程】
教学内容 教师活动 学生活动 设计意图
引 入 引言
我们能用什么方法知道橙子是酸性物质?
提问
实验室的一些溶液,我们不能用嘴尝,那么应该用什么试剂来测试呢? 学生回答:用嘴尝。
学生回答:用石蕊、酚酞。 引导学生创设问题,激发学生学习的兴趣。
溶 液
的
酸
碱
性
和
pH 板书设计
溶液的酸碱性
一、溶液的酸碱性和pH
酸碱指示剂:
石蕊、酚酞
实验1:用石蕊测试盐酸、澄清石灰水、蒸馏水的酸碱性。
实验步骤
取3支试管,各加入10%的盐酸溶液、澄清石灰水、蒸馏水3ml,分别滴入几滴紫色石蕊试液。
板书设计
试液
现象
盐酸
澄清石灰水
蒸馏水
紫色石蕊试液的颜色
红色
蓝色
紫色
溶液的酸碱性
酸性
碱性
结论
紫色石蕊遇酸溶液变红色,遇碱溶液变蓝色。
实验2:用石蕊测定氯化铵、碳酸钠、氯化钠三种溶液的酸碱性。
实验步骤
取3支试管,氯化铵溶液、碳酸钠溶液、氯化钠溶液3ml,分别滴入几滴紫色石蕊试液。
试液
现象
氯化铵
碳酸钠
氯化钠
紫色石蕊试液的颜色
红色
蓝色
紫色
溶液的酸碱性
酸性
碱性
结论
紫色石蕊遇酸溶液变红色,遇碱溶液变蓝色。
讲述
通过上面两组实验,我们发现酸溶液显酸性,碱溶液显碱性,氯化铵、碳酸钠、氯化钠这些不是酸也不是碱,也有不同的酸碱性。
因此,根据元素的组成在化合物中,除了氧化物外,还可以分酸、碱、盐。
板书设计
化合物分类
氧化物:由两种元素组成的化合物中,其中一种是氧元素。
酸:由氢元素和酸根组成的化合物。
碱:由金属元素和氢氧根组成的化合物。
盐:由金属元素(或铵根)和酸根组成的化合物。
板书设计
根据下列化合物的组成,判断它们各属于氧化物、酸、碱或盐?氯化钾、氧化铁、氢氧化钡、硝酸、碳酸钠。
提示
先将各物质名称变为化学式,然后在一一判断。
实验3:用酚酞试液测定溶液的酸碱性。
实验步骤
取5支试管,分别加入下述五种试液,再滴加1~2滴酚酞试液。
试液现象
盐酸
氯化铵
蒸馏水
氢氧化钠
碳酸钠
酚酞试液的颜色
无色
无色
无色
红色
红色
溶液的酸碱性
碱性
碱性
结论
酚酞试液遇碱性溶液变红色。
板书设计
小结:紫色石蕊试液遇酸性溶液变红色,遇碱性溶液变蓝色
碱性溶液使无色酚酞试液变红色
设问
通过实验我们发现盐酸和氯化铵溶液都呈酸性,氢氧化钠溶液和碳酸钠溶液都呈碱性,那么,哪种物质酸性更强,哪种物质碱性更强?
讲述
我们可以用pH试纸来测试。
并讲述pH试纸的使用方法。
注意:用pH试纸测试溶液酸碱性强弱时,可以将玻璃棒蘸取试液后沾到pH试纸上,再把试纸呈现的颜色与比色卡对照。
板书设计
pH试纸:
pH=7的溶液是中性溶液
pH>7的溶液是碱性溶液,pH越大,碱性越强。
pH<7的溶液是酸性溶液,pH越小,酸性越强。
盐酸
氯化铵
蒸馏水
氢氧化钠
碳酸钠
pH
1
4
7
13
12
结论:
pH>7的是碱性溶液,有氢氧化钠、碳酸钠
pH=7的是中性溶液,有蒸馏水
pH<7的是酸性溶液,有盐酸和氯化铵
在所给的试剂样品中,酸性最强的溶液是盐酸,碱性最强的溶液是氢氧化钠。 学生实验1:用石蕊测试盐酸、澄清石灰水、蒸馏水的酸碱性
学生实验2:用石蕊测试氯化铵、碳酸钠、氯化钠的酸碱性
得出结论:紫色石蕊遇酸性溶液变红色,遇碱性溶液变蓝色,遇中性溶液不变色。
巩固练习:根据下列化合物的组成,判断它们各属于氧化物、酸、碱或盐?
学生实验3:用酚酞测试盐酸、氯化铵、蒸馏水、氢氧化钠、碳酸钠的酸碱性
得出结论:酚酞试液遇碱性溶液变红色。遇中性、酸性溶液不变色。
学生小结:紫色石蕊试液遇酸性溶液变红色,遇碱性溶液变蓝色。碱性溶液使无色酚酞试液变红色
学生实验4:用pH试纸测定盐酸、氯化铵溶液、蒸馏水、氢氧化钠溶液、碳酸钠溶液的pH
得出结论,并在书上相应位置记录。 运用已学知识进行实验,注意实验的基本操作。
在实验过程中发现问题解决问题
创设新问题。
引入探究。
溶 液
的
酸
碱
性
与
生
活
的
关
系 板书设计
二、溶液的酸碱性与生活的关系
讲述
人体中各种体液的pH对人体的健康有着重要的影响,这是因为人体中各种生物化学反应都必须再适宜和稳定的pH范围中进行。
阅读
人体中一些体液的pH。
讲述
学习了溶液酸碱性的测试,下面我们就测试一下同学们带来的一些物质的酸碱性。
思考
如何利用溶液的酸碱性解释生活中遇到的一些问题。
讲述
在实验室里我们常用到的酸溶液,有硝酸、盐酸、硫酸和醋酸。常用到的碱溶液有石灰水、氢氧化钠、氨水。
说明
酸溶液显酸性,碱溶液显碱性,一些既不是酸也不是碱,它们的溶液也具有一定的酸碱性。
举例
纯碱不是碱,而它的水溶液呈碱性。 学生实验5:测试我们生活中的一些物质。
学生讨论:溶液酸碱性与生活的关系,解决生活中碰到的一些问题。 巩固pH的测试方法。解决生活中碰到的问题。
体会生活中处处都有化学原理
课 的
小
结 小结:
1.常见的酸碱指示计以及测试方法。
2.溶液的酸碱性与生活的关系 师生共同完成。
【板书设计】
溶液的酸碱性 一、溶液的酸碱性和pH
1.酸碱指示剂:
石蕊、酚酞
实验1:用石蕊测试盐酸、澄清石灰水、蒸馏水的酸碱性。
试液
现象
盐酸
澄清石灰水
蒸馏水
紫色石蕊试液的颜色
红色
蓝色
紫色
溶液的酸碱性
酸性
碱性
实验2:用石蕊测定氯化铵、碳酸钠、氯化钠三种溶液的酸碱性。
试液现象
氯化铵
碳酸钠
氯化钠
紫色石蕊试液的颜色
红色
蓝色
紫色
溶液的酸碱性
酸性
碱性
化合物分类
氧化物:由两种元素组成的化合物中,其中一种是氧元素。
酸:由氢元素和酸根组成的化合物。
碱:由金属元素和氢氧根组成的化合物。
盐:由金属元素(或铵根)和酸根组成的化合物。
练习:根据下列化合物的组成,判断它们各属于氧化物、酸、碱或盐?氯化 钾、氧化铁、氢氧化钡、硝酸、碳酸钠。
实验3:用酚酞试液测定溶液的酸碱性。
试液
现象
盐酸
氯化铵
蒸馏水
氢氧化钠
碳酸钠
酚酞试液的颜色
无色
无色
无色
红色
红色
溶液的酸碱性
碱性
碱性
小结:紫色石蕊试液遇酸性溶液变红色,遇碱性溶液变蓝色
碱性溶液使无色酚酞试液变红色
pH试纸:
pH=7的溶液是中性溶液
pH>7的溶液是碱性溶液,pH越大,碱性越强。
pH<7的溶液是酸性溶液,pH越小,酸性越强。
盐酸
氯化铵
蒸馏水
氢氧化钠
碳酸钠
pH
1
4
7
13
12
pH>7的是碱性溶液,有氢氧化钠、碳酸钠
pH=7的是中性溶液,有蒸馏水
pH<7的是酸性溶液,有盐酸和氯化铵
其中酸性最强的溶液是盐酸,碱性最强的溶液是氢氧化钠
二、溶液的酸碱性与生活的关系
常用到的酸溶液:有硝酸、盐酸、硫酸和醋酸
常用到的碱溶液有石灰水、氢氧化钠、氨水。
【教学反思】
本节教学,我们可以“边探究边实验”,课前要求学生准备一些各种果汁、洗涤剂等样品,教师也可准备一些生活中的物品,进行当堂测定。在测定中,一是最好使用精密pH试纸;二是每组学生只测定1~2种样品,然后将测定结果汇总交流,谈谈溶液的酸碱性与生活的联系。例如,有学生测得茶水是显碱性的,而橙汁是显酸性的,因此我们可以在有茶垢的杯子里倒点橙汁把它洗干净。
