人教版高一化学必修1第二章第1节物质的分类(共30张PPT)
文档属性
| 名称 | 人教版高一化学必修1第二章第1节物质的分类(共30张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-10 00:00:00 | ||
图片预览









文档简介
(共30张PPT)
第二章
化学物质及其变化
第一节
物质的分类
超市里成千上万种商品,如何能够迅速找到某种商品?
思考
图书馆里有许多书籍,如何很快就找到几米《我的心中每天开出一朵花》?
思考
1.请从其他方面收集一些应用分类法的例子,讨论对它们进行分类的目的和意义。
意义:能够提高人们工作、学习的效率,使人们更快、更便捷地达到目的等。
思考与交流
一、简单分类法及其应用
每组物质中都有一种与其他物质在分类上不同,将这种物质找出来。
1、NaCl、KCl、NaClO、BaCl2
(
)
2、HClO3、KClO3、Cl2、NaClO3
(
)
3、H3PO4、H2SiO3、HCl、H2SO4
(
)
4、空气、氮气、氯化氢、碳酸钠
(
)
NaClO
Cl2
HCl
空气
试一试
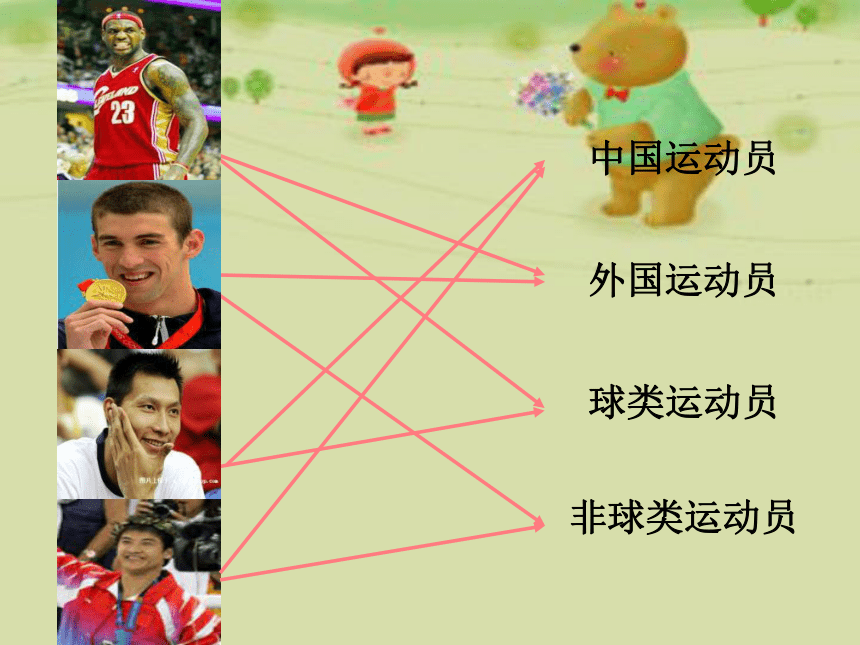
中国运动员
外国运动员
球类运动员
非球类运动员
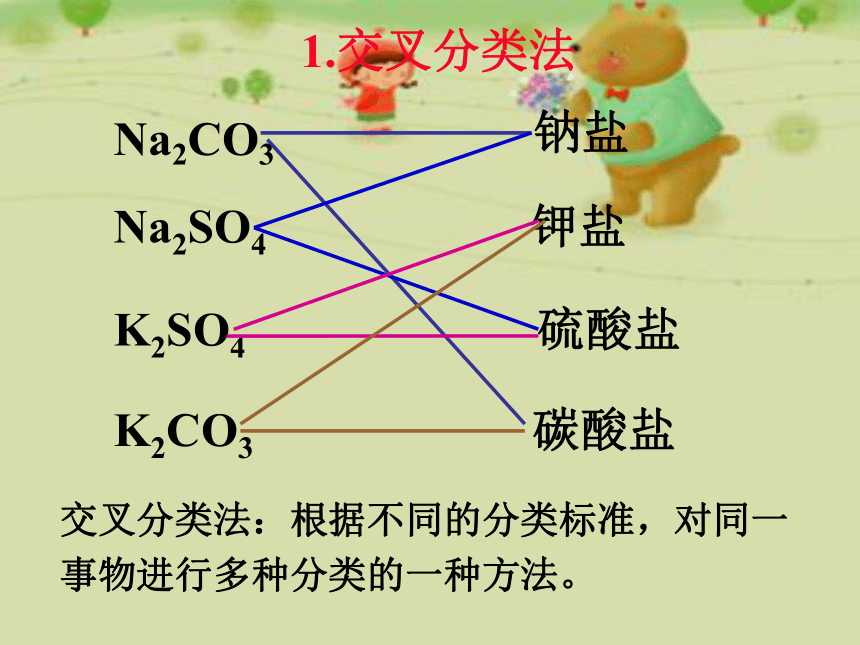
1.交叉分类法
?
Na2SO4
钾盐
?
K2SO4
硫酸盐
?
K2CO3
交叉分类法:根据不同的分类标准,对同一事物进行多种分类的一种方法。
Na2CO3
钠盐
碳酸盐
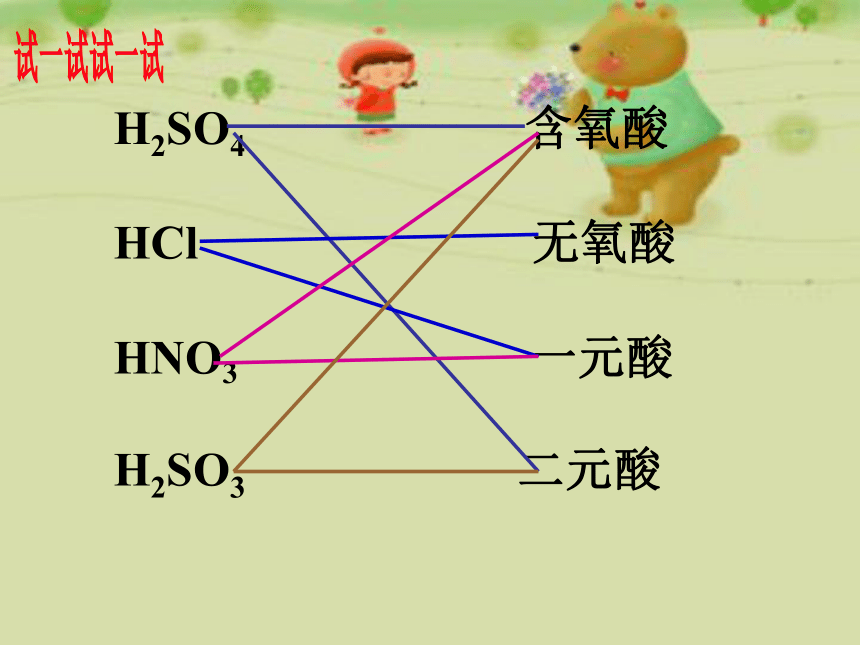
H2SO4
含氧酸
?
HCl
无氧酸
?
HNO3
一元酸
?
H2SO3
二元酸
?
试一试
将HCl
、SO2、
CaO、
KOH、
Na2SO4
、H2SO4进行分类,并指出依据。
思考与交流
酸:
碱:
盐:
氧化物:
HCl
、H2SO4
KOH
NaSO4
SO2
、CaO
物质
纯净物
混合物
均匀混合物
非均匀混合物
单质
化合物
金属单质
非金属单质
酸
碱
盐
氧化物
2.树状分类法
分类原则:同一层次的物质类别间一般是相互独立,没有交叉的。
化合反应
A+B+
…
=C
分解反应
A=B+C+…
置换反应
A+BC=AC+B
复分解反
AB+CD=AD+CB
按反应物、生成物的形式变化划分
是否得失氧
氧化还原反应
非氧化还原反应
是否有离子参加
离子反应
非离子反应
化学反应
2.树状分类法
1.分类是学习和研究化学物质及其变化的一种常用的基本方法。
2.分类要有一定的标准,根据不同的标准可以进行不同的分类。交叉分类法、树状分类法
是常见的物质分类法。
树状分类法优点:可以清楚地表示物质间的从属关系。
小结
二、分散系及其分类
1.概念
一种或几种物质的粒子分散到另一种物质里所形成的混合物叫分散系。前者属于被分散的物质叫分散质,后者起容纳分散质的作用叫分散剂。
微小尘埃(固)
空气(气)
微小水滴(液)
空气(气)
碘(固)
酒精(液)
CuSO4(固)
水(液)
金属氧化物(固)
玻璃(固)
分散系
分散质
分散剂
烟
雾
碘酒
CuSO4溶液
有色玻璃
分散系
以分散质和分散剂的状态为分类标准,共分为____种分散系:
9
分散质粒子
大小为标准
①溶液:分散质粒子小于1nm。
②胶体:分散质粒子介于1nm
~100nm之间。
③浊液:分散质粒子大于100nm。
1nm
100nm
溶液
胶体
浊液
三种分散系的对比
分散系
浊液
溶液
胶体
分散质粒子大小
主要特征
举例
>100nm
<1nm
1~100nm
不稳定,不均一
稳定,均一
介稳定,均一
泥浆水
NaCl溶液
豆浆
定义:分散质粒子直径在1nm~100nm之间的分散系。
本质特征
科学探究
1.制备Fe(OH)3胶体
将烧杯中的
______
加热至
____
,向沸水中逐滴加入5-6滴
_____________
,继续煮至溶液呈
______
,停止加热,即制得红褐色的Fe(OH)3胶体。
蒸馏水
沸腾
FeCl3饱和溶液
红褐色
(课本26页)
由于胶体粒子对光线的散射而形成光亮的通路的现象称为丁达尔效应。
—区分胶体与溶液的一种物理方法
2.丁达尔效应
可见光
照射胶体
胶粒
使可见光散射
形成光亮的“通路”
原因:
放电影时的丁达尔效应
树林中的丁达尔效应
3.将Fe(OH)3胶体和泥水分别进行过滤,可观察到的实验现象:
没得到滤渣,滤液还是红褐色。
在滤纸上得到泥沙,滤液澄清、透明。
过滤后的现象
Fe(OH)3胶体
泥水
胶体微粒直径在1nm~100nm之间,可以通过滤纸,不能通过半透膜。
(半透膜:只能容许某些分子或离子通过的薄膜)
一定时间后,烧杯中能够检测出的是:氯化钠。检测不出的是:淀粉
3.胶体与浊液、溶液的区别
胶体微粒能透过滤纸
在外加电场作用下,
胶体粒子在分散剂里向电极
(阴极或阳极)
作定向移动的现象,
叫做电泳。
实验:
说明Fe(OH)3胶粒
是带正电荷的。
注意:胶体本身是不带电的,带电的是胶粒!
应用:静电除尘
因为胶粒具有较大的表面积,能吸附离子而带电.
1.电泳
科学视野
(课本28页)
普遍存在的现象,不是胶体的特有性质!
在超显微镜下观察胶体溶液可以看到胶体颗粒不断地作无规则的运动。
2.布朗运动
使胶体微粒凝聚成更大的颗粒,形成沉淀,从分散剂里析出的过程叫胶体的凝聚。
Q1:胶体为什么能够稳定存在?
胶粒带电、布朗运动
不能!
Q2:如何设法中和胶体微粒所带电荷,胶体还能处于稳定状态吗?
胶体的介稳性
3.聚沉
1.加电解质溶液;
⑴浑浊的井水中加入少量石灰能使水变澄清;
⑵豆浆里加盐卤(MgCl2·6H2O)或石膏(CaSO4·2H2O)溶液使之凝聚成豆腐;
⑶水泥里加石膏能调节水泥浆的硬化速率;
⑷在江河与海的交汇处形成的沙洲。
消除胶粒所带电荷,并使其凝集沉降的方法:
3.聚沉
2.加带相反电荷的胶粒;
⑴用明矾、氯化铁等净水
⑵不同种类的墨水混合使用时有沉淀产生,使墨水失效。
3.加热。
分散系
溶液
胶体
浊液
分散质粒子直径
<1nm
1nm~100nm
>100nm
性
质
外观
均一,透明
均一,
有的透明
不均一,不透明
稳定性
稳定
较稳定
(介稳)
不稳定
能否透过滤纸
能
能
不能
能否透过半透膜
能
不能
不能
实例
蔗糖溶液
淀粉溶液
泥水混和物
练习
1. 根据中央电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列分散系中的(
)
A.溶液 B.悬浊液
C.乳浊液 D.胶体
2.下列物质能发生丁达尔效应的是
(
)
A.蔗糖水 B.肥皂水
C.碘酒 D.碘化银胶体
3.
溶液、胶体和浊液这三种分散系的根本区别是(
)
A.是否为大量分子或离子的集合体
B.分散质微粒直径的大小
C.能否透过滤纸
D.是否均一、稳定、透明
BD
B
D
第二章
化学物质及其变化
第一节
物质的分类
超市里成千上万种商品,如何能够迅速找到某种商品?
思考
图书馆里有许多书籍,如何很快就找到几米《我的心中每天开出一朵花》?
思考
1.请从其他方面收集一些应用分类法的例子,讨论对它们进行分类的目的和意义。
意义:能够提高人们工作、学习的效率,使人们更快、更便捷地达到目的等。
思考与交流
一、简单分类法及其应用
每组物质中都有一种与其他物质在分类上不同,将这种物质找出来。
1、NaCl、KCl、NaClO、BaCl2
(
)
2、HClO3、KClO3、Cl2、NaClO3
(
)
3、H3PO4、H2SiO3、HCl、H2SO4
(
)
4、空气、氮气、氯化氢、碳酸钠
(
)
NaClO
Cl2
HCl
空气
试一试
中国运动员
外国运动员
球类运动员
非球类运动员
1.交叉分类法
?
Na2SO4
钾盐
?
K2SO4
硫酸盐
?
K2CO3
交叉分类法:根据不同的分类标准,对同一事物进行多种分类的一种方法。
Na2CO3
钠盐
碳酸盐
H2SO4
含氧酸
?
HCl
无氧酸
?
HNO3
一元酸
?
H2SO3
二元酸
?
试一试
将HCl
、SO2、
CaO、
KOH、
Na2SO4
、H2SO4进行分类,并指出依据。
思考与交流
酸:
碱:
盐:
氧化物:
HCl
、H2SO4
KOH
NaSO4
SO2
、CaO
物质
纯净物
混合物
均匀混合物
非均匀混合物
单质
化合物
金属单质
非金属单质
酸
碱
盐
氧化物
2.树状分类法
分类原则:同一层次的物质类别间一般是相互独立,没有交叉的。
化合反应
A+B+
…
=C
分解反应
A=B+C+…
置换反应
A+BC=AC+B
复分解反
AB+CD=AD+CB
按反应物、生成物的形式变化划分
是否得失氧
氧化还原反应
非氧化还原反应
是否有离子参加
离子反应
非离子反应
化学反应
2.树状分类法
1.分类是学习和研究化学物质及其变化的一种常用的基本方法。
2.分类要有一定的标准,根据不同的标准可以进行不同的分类。交叉分类法、树状分类法
是常见的物质分类法。
树状分类法优点:可以清楚地表示物质间的从属关系。
小结
二、分散系及其分类
1.概念
一种或几种物质的粒子分散到另一种物质里所形成的混合物叫分散系。前者属于被分散的物质叫分散质,后者起容纳分散质的作用叫分散剂。
微小尘埃(固)
空气(气)
微小水滴(液)
空气(气)
碘(固)
酒精(液)
CuSO4(固)
水(液)
金属氧化物(固)
玻璃(固)
分散系
分散质
分散剂
烟
雾
碘酒
CuSO4溶液
有色玻璃
分散系
以分散质和分散剂的状态为分类标准,共分为____种分散系:
9
分散质粒子
大小为标准
①溶液:分散质粒子小于1nm。
②胶体:分散质粒子介于1nm
~100nm之间。
③浊液:分散质粒子大于100nm。
1nm
100nm
溶液
胶体
浊液
三种分散系的对比
分散系
浊液
溶液
胶体
分散质粒子大小
主要特征
举例
>100nm
<1nm
1~100nm
不稳定,不均一
稳定,均一
介稳定,均一
泥浆水
NaCl溶液
豆浆
定义:分散质粒子直径在1nm~100nm之间的分散系。
本质特征
科学探究
1.制备Fe(OH)3胶体
将烧杯中的
______
加热至
____
,向沸水中逐滴加入5-6滴
_____________
,继续煮至溶液呈
______
,停止加热,即制得红褐色的Fe(OH)3胶体。
蒸馏水
沸腾
FeCl3饱和溶液
红褐色
(课本26页)
由于胶体粒子对光线的散射而形成光亮的通路的现象称为丁达尔效应。
—区分胶体与溶液的一种物理方法
2.丁达尔效应
可见光
照射胶体
胶粒
使可见光散射
形成光亮的“通路”
原因:
放电影时的丁达尔效应
树林中的丁达尔效应
3.将Fe(OH)3胶体和泥水分别进行过滤,可观察到的实验现象:
没得到滤渣,滤液还是红褐色。
在滤纸上得到泥沙,滤液澄清、透明。
过滤后的现象
Fe(OH)3胶体
泥水
胶体微粒直径在1nm~100nm之间,可以通过滤纸,不能通过半透膜。
(半透膜:只能容许某些分子或离子通过的薄膜)
一定时间后,烧杯中能够检测出的是:氯化钠。检测不出的是:淀粉
3.胶体与浊液、溶液的区别
胶体微粒能透过滤纸
在外加电场作用下,
胶体粒子在分散剂里向电极
(阴极或阳极)
作定向移动的现象,
叫做电泳。
实验:
说明Fe(OH)3胶粒
是带正电荷的。
注意:胶体本身是不带电的,带电的是胶粒!
应用:静电除尘
因为胶粒具有较大的表面积,能吸附离子而带电.
1.电泳
科学视野
(课本28页)
普遍存在的现象,不是胶体的特有性质!
在超显微镜下观察胶体溶液可以看到胶体颗粒不断地作无规则的运动。
2.布朗运动
使胶体微粒凝聚成更大的颗粒,形成沉淀,从分散剂里析出的过程叫胶体的凝聚。
Q1:胶体为什么能够稳定存在?
胶粒带电、布朗运动
不能!
Q2:如何设法中和胶体微粒所带电荷,胶体还能处于稳定状态吗?
胶体的介稳性
3.聚沉
1.加电解质溶液;
⑴浑浊的井水中加入少量石灰能使水变澄清;
⑵豆浆里加盐卤(MgCl2·6H2O)或石膏(CaSO4·2H2O)溶液使之凝聚成豆腐;
⑶水泥里加石膏能调节水泥浆的硬化速率;
⑷在江河与海的交汇处形成的沙洲。
消除胶粒所带电荷,并使其凝集沉降的方法:
3.聚沉
2.加带相反电荷的胶粒;
⑴用明矾、氯化铁等净水
⑵不同种类的墨水混合使用时有沉淀产生,使墨水失效。
3.加热。
分散系
溶液
胶体
浊液
分散质粒子直径
<1nm
1nm~100nm
>100nm
性
质
外观
均一,透明
均一,
有的透明
不均一,不透明
稳定性
稳定
较稳定
(介稳)
不稳定
能否透过滤纸
能
能
不能
能否透过半透膜
能
不能
不能
实例
蔗糖溶液
淀粉溶液
泥水混和物
练习
1. 根据中央电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列分散系中的(
)
A.溶液 B.悬浊液
C.乳浊液 D.胶体
2.下列物质能发生丁达尔效应的是
(
)
A.蔗糖水 B.肥皂水
C.碘酒 D.碘化银胶体
3.
溶液、胶体和浊液这三种分散系的根本区别是(
)
A.是否为大量分子或离子的集合体
B.分散质微粒直径的大小
C.能否透过滤纸
D.是否均一、稳定、透明
BD
B
D
