新人教版高中化学必修一4.2-富集在海水中的元素—氯(71张PPT)
文档属性
| 名称 | 新人教版高中化学必修一4.2-富集在海水中的元素—氯(71张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-10 07:39:34 | ||
图片预览










文档简介
(共71张PPT)
工业上用碳还原SiO2制取单质硅会发生如下副反应:SiO2+3C==SiC+2CO。
该反应中
氧化剂与还原剂的质量比为?
海水中有几十种元素,蕴藏着丰富的化学资源。大部分以盐的形式存在,含盐约3%,氯是最重要的成盐元素。若将海洋中的盐全提取出来,铺在地球的陆地上,可使陆地平均升高150m.
浩瀚美丽的大海
资源丰富的大海
海洋是巨大的资源宝库
海洋中含有大量的盐类,主要为NaCl,此外还有MgCl2、MgSO4等,致使海水既咸又苦,不能直接饮用。
我国海盐产量最大的盐场——长芦盐场
富集在海水中的元素
——氯
第一次世界大战时的1915年4月22日,德军与英法联军在比利时的伊普尔对峙。黎明时分,英法联军前线的士兵突然听到一阵剧烈地爆炸声,紧接着看到一股阴森森的
黄绿色气体逐渐从空中降落下来。很快,战壕里的士兵们感觉双眼受到了强烈地刺激,咳嗽响成一片,数百名英法战士窒息死亡,数千名士兵双目失明。
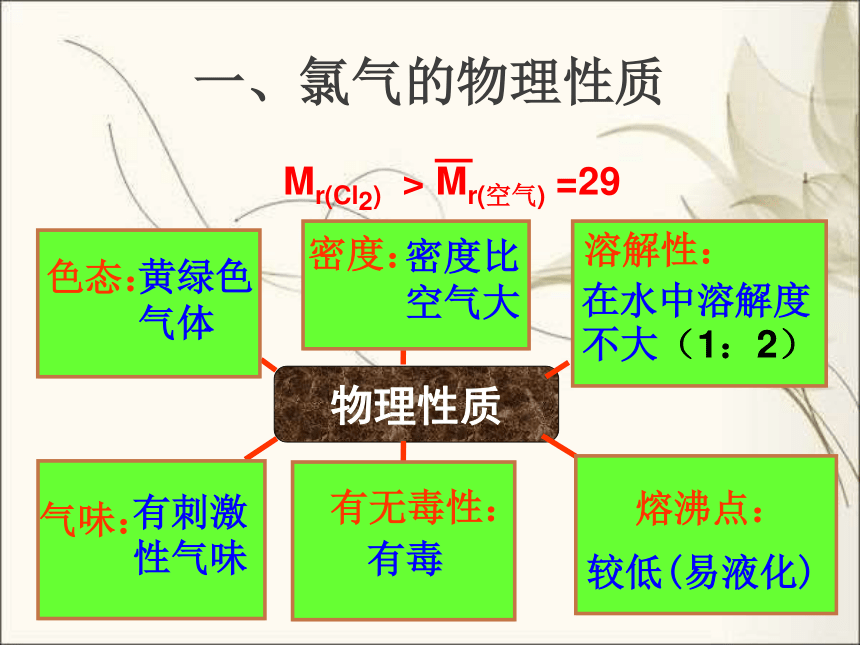
一、氯气的物理性质
物理性质
黄绿色
气体
密度比
空气大
在水中溶解度不大(1:2)
有刺激
性气味
有毒
较低(易液化)
闻气体时的正确操作
2004年4月15日,重庆天原化工总厂贮氯灌意外发生泄漏,为了厂区和周围地区群众的安全,应如何指导周围群众进行自救?
沿逆风方向,向高处转移
用湿毛巾护住口鼻
二、氯气的化学性质
(氧化剂,
强氧化性)
1
.
氯气与金属的反应
2
.
氯气与非金属的反应
3
.
氯气与水的反应
4
.
氯气与碱的反应
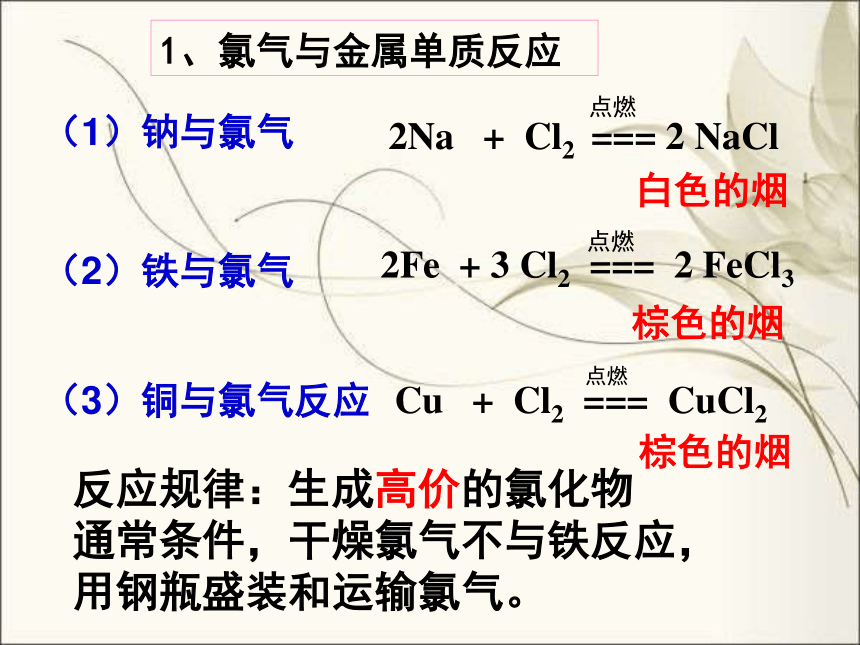
1、氯气与金属单质反应
(1)钠与氯气
白色的烟
(2)铁与氯气
(3)铜与氯气反应
棕色的烟
棕色的烟
反应规律:生成高价的氯化物
通常条件,干燥氯气不与铁反应,
用钢瓶盛装和运输氯气。
①安静地燃烧
②苍白色火焰
③瓶口出现白雾
一定条件(点燃或光照)下氯气能与氢气反应
可燃性气体点燃前都要验纯
2、氯气与非金属单质反应
燃烧:
①燃烧不一定要有氧气参加。
②燃烧的本质是氧化还原反应。
③任何发光发热的剧烈的化学反应
叫做燃烧。
你是否在曾经
打开自来水时,
闻到一股刺激性
的气味?
这是什么原因?
思考与讨论
(1)氯气溶于水为何有杀菌、消毒作用?
(2)新制氯水中含有哪些分子和离子?
(3)HClO具有哪些性质?
自主阅读
3、氯气与水的反应
次氯酸
Cl2
+
H2O
==
HCl
+
HClO
化合价降低,得e—,被还原
化合价升高,失e—,被氧化
次氯酸是一种具有强氧化性的弱酸,次氯酸的强氧化性能杀死水里的病菌,所以,自来水常用氯气(在1L水中通入0.002
g
Cl2
)来杀菌消毒。
次氯酸的性质:电子式、结构式
3、强氧化性:
1、弱酸性:
2、不稳定性:
可用于自来水
的杀菌、消毒。
酸性:HClO
<
H2CO3
4、漂白作用:
能漂白一些有色物质,
可用做漂白剂。
光照
HClO与HClO4、ClO-
与S2-、I-、Fe2+、SO32-
现象:
干燥红纸没有褪色,润湿红纸褪色。
加入石灰石有气泡
加入红色鲜花瓣褪色
加入硝酸银溶液白色沉淀
加入硫酸亚铁溶液变为棕黄色
加入石蕊试液先变红后腿色
纯净物
混合物
分子:
离子:
Cl2
,HClO,H2O
H+,Cl-,ClO-,OH-
分子:H2O
离子:
H+,Cl-,
OH-
新制
氧化性
有酸性,强氧化性,漂白性
久置
只有Cl2
只有酸性
★
久置氯水相当于稀盐酸
实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中
液氯
氯水
分类
成分
性质
本节小结
一、氯气的物理性质
二、氯气的化学性质
黄绿色、强烈刺激性气味、有毒气体,密度比空气大,能溶于水(1:2)。
1、能与金属单质化合——生成高价态金属氯化物
2、与氢气化合——实验现象
3、与水反应:
次氯酸的性质(弱酸性、不稳定性、强氧化性、)
重点内容
+金属单质
+H2O
Cl2
+
非金属单质如H2
HCl
金属的
氯化物
HClO
高价态
金属氯化物
HClO的性质
氯水中真正起消毒杀菌作用的物质是次氯酸,而次氯酸又不稳定,在工业上常常把氯气制成次氯酸盐以便存放和运输。
如何得到次氯酸盐?
根据氯气与水的反应原理,
推测氯气与NaOH、
石灰水能否发生反应?
Cl2
+
2OH
?=Cl
?
+
ClO
?
+
H2O
Cl2
+
H2O
=
HCl
+
HClO
HCl
+
NaOH
=
NaCl
+
H2O
HClO+
NaOH
=
NaClO
+
H2O
——在制氯气时吸收尾气
将氯气通入冷的消石灰中可制得漂白粉,请写出此反应的化学方程式。
漂白液
(84消毒液):
漂白粉:
漂粉精:
有效成分
主要成分
NaClO
Ca(ClO)2
Ca(ClO)2
CaCl2、Ca(ClO)2
Ca(ClO)2
NaCl、NaClO
漂白液、漂白粉、漂粉精成分的区别
Ca(ClO)2
+
CO2
+
H2O
=
CaCO3↓+2HClO
(反应原理:
强酸制取弱酸)
日常:
工业:
Ca(ClO)2
+
2HCl=
CaCl2+
2HClO
怎样保存漂白粉?
密封,保存于避光干燥处。
2、漂白液、漂白粉和漂粉精的应用:
(1)漂白棉、麻、纸张。
(2)消毒游泳池等。
1、工业制盐酸
3、氯气在化学工业中的应用
(3)处理工业废水,将具有还原性的有毒物质
硫化氢、氰化物等氧化成无毒物。
(1)SiCl4、GeCl4、TiCl4分别是制取高纯硅、
锗(半导体)和金属钛的重要中间物质;
(2)合成塑料、橡胶、人造纤维、农药、染料
和药品的重要原料;
Cl—
H+
HClO
Cl2
H+、HClO
Cl2、H+
白色沉淀
气泡
褪色
先红后褪色
溶液变棕黄
氯水褪色并有气泡
参与反应的微粒
所加试剂
实验现象
离子方程式或解释
AgNO3
Na2CO3
有色布条
FeCl2
石蕊溶液
镁粉
以氯气、
石灰石、
水
为原料制取漂白粉:
试剂:
HNO3、AgNO3
原理:
Ag++Cl-=AgCl↓
操作:
先加HNO3、再加AgNO3
先加AgNO3、再加HNO3
现象:
有不溶于稀HNO3的白色沉淀生成
MnO2
+
HCl
(浓)
==
1.实验原理
阅读课本P82科学史话
MnCl2
+
H2O
+
Cl2
↑
提示:MnO2
→
Mn2+
氧化剂
还原剂
酸性
4
2
MnO2
+
4H+
+2Cl—
==Mn2+
+
Cl2
↑
+
2H2O
可根据反应物状态和反应条件选择气体发生装置
发生装置
下面有四种常见的气体收集装置,请根据下列提示的Cl2的性质选择合适的装置(
)
1、Cl2
有毒,且密度比空气大
2、Cl2能溶于水,难溶于饱和食盐水
A
B
B
D
收集装置
饱和食盐水
D
气体从长导管进入
实验室制得的多余氯气可以直接排到空气中去吗?
D1
D2
尾气处理装置
应如何处理?请选择合适的装置(
)
发生装置
收集装置
尾气吸收装置
这样收集到的氯气纯净吗?
若想制得纯净、干燥的氯气,请根据提示信息选择合适的装置。
净化装置
2.实验装置
发生装置
净化装置
收集
装置
尾气处理
装置
操作过程:
连接装置
1、为什么用分液漏斗装盐酸?又让盐酸缓慢地注入,而不是一次将浓盐酸注入烧瓶里?
用分液漏斗可以控制液体的用量,避免生成的氯气过多。
问题讨论
2、使用浓盐酸与足量的MnO2共热制Cl2,实际产生的Cl2总比理论值低,其主要原因是什么?
稀盐酸与MnO2不反应,随着反应的进行,浓盐酸的物质的量浓度逐渐变小。
3
、为什么用浓盐酸和二氧化锰制取氯气时,要缓缓加热,不能强热
?
浓盐酸有很强的挥发性,强热时能挥发出大量的氯化氢气体和水蒸气,而使制得的氯气中含有大量的杂质;另一方面,又降低了HCl的利用率。
KMnO4和浓HCl
KClO3和浓HCl
Ca(ClO)2和浓HCl
实验步骤:
1.分别向U型管的两端溶液中滴加1-2滴酚酞。打开电源。
2.用湿润的淀粉KI试纸检验b导管导出的气体。
3.用小试管收集a管产生的气体,用拇指堵住试管口移近酒精灯,松开拇指。
实验现象
结论
a
b
_
+
1.
溴、碘单质的提取
溴元素在海水中以溴离子(Br-)的形式存在,碘元素在海带中以碘离子(I-)的形式存在,生产中从海水中提取溴和从海带中提取碘的化学反应原理如何呢?
在两支试管中分别入2~3mLNaBr和KI
溶液,滴加少量新制氯水,
再滴加少量CCl4,振荡,静置。
原理:Cl2+2NaBr=Br2+2NaCl
现象:分层,下层溶液颜色为橙红色
原理:Cl2+2KI=I2+2KCl
现象:分层,下层溶液颜色为紫红色
在一支试管加入2-3mlKI溶液,滴加少量
溴水,再滴加少量CCl4,振荡、静置。
原理:
2KI
+
Br2
=2KBr
+
I2
现象:分层,下层溶液颜色为紫红色
2Br—
+
Cl2﹦2Cl
—
+
Br2
2I
—
+
Cl2
﹦2Cl
—
+
I2
2I
—
+
Br2
﹦
2Br
—
+
I2
氧化性:
Cl2
>
Br2
>
I2
还原性:
I
—
>
Br
—
>
Cl
—
氧化性:F2>(O2)>Cl2
>
Br2
>Fe3+
>I2>S
还原性:
F-<Cl-<Br-<Fe2+<I-<S2-(HS-、H2S)
①深红棕色液体
(唯一的液态非金属)
②易挥发
(刺激性气味,有毒)
③具有强的腐蚀性
④ρBr2
>ρH2O
棕色试剂瓶中水封保存
2.
溴、碘单质的物理性质
(1)液溴(Br2)
①紫黑色晶体
②易升华
③淀粉溶液遇碘变蓝色
棕色试剂瓶中密封保
(2)碘单质(I2)
检验
碘单质的存在
C12、Br2、I2:
在水中的溶解度越来越小,
在有机溶剂中的溶解度越来越大。
橙黄
橙红
棕黄
紫红
水
CCl4
Br2
I2
Br—
+
Ag+
=
AgBr↓
I—
+
Ag+
=
AgI↓
3.
Br—
、I—的检验
AgNO3溶液和稀硝酸
②现象:
产生浅黄色沉淀(含Br-)
产生黄色沉淀(含I-)
③方程式:
①试剂:
4.
溴、碘化合物的应用
是一种重要感光材料,
是胶卷中必不可少的成分
(1)AgBr(溴化银)
可用于人工降雨,
使空气里的水蒸气凝聚成雨
(2)AgI(碘化银)
Cl2
复习一:氯及其重要化合物的相互转化
NaCl
FeCl3
CuCl2
HCl
HClO
NaClO;
Ca(ClO)2。
Br2;I2。
O2
AgCl
硅及化合物的“反常”
碳主要化合价是“+2、+4”价,而硅常见的化合价是“+4”。
在常温下,硅的化学性质不活泼,但是自然界却没有单质硅存在。
非金属单质与强碱反应一般也不生成氢气,但硅却不然。
Si+2NaOH+
H2O=2H2↑+
Na2SiO3
硅及化合物的“反常”
SiO2不溶于水,但其是硅酸的酸酐,
H2SiO3不能直接与水反应制得,而只能用可溶性硅酸盐与酸作用生成.
无机酸一般易溶于水,硅酸却难溶于水。
酸性氧化物一般不与酸反应,但是SiO2却能够与HF反应.
水玻璃,与玻璃成分完全不一样,且水玻璃溶液呈碱性,但并不是碱溶液,而是盐的溶液。
内容小结:
氯气
1.结构
2.性质
3.用途
a.氯气分子是由2个氯原子构成的双原子分子
b.氯原子的最外电子层上有7个电子
物理性质
化学性质
黄绿色﹑有刺激性气味的有毒气体.
能溶于水﹑易液化
杀菌消毒﹑制盐酸﹑漂白粉﹑农药和有机溶剂等
决定
决定
反映
反映
复习二:氯气与水反应
HClO
电子式、结构式
一元弱酸
(H2CO3>HClO),
强氧化性(杀菌、消毒),
漂白性,
不稳定易分解。
HClO与HClO4、ClO-
与S2-、I-、Fe2+、SO32-
液氯、新制氯水、久置氯水比较
黄绿色
Cl2分子
H2O
Cl2
HClO
H+
、Cl-、ClO-
(OH-)
H2O、H+
Cl-、
(OH-)
纯净物
无明显变化
先变红后褪色
变红
无色
混合物
混合物
淡黄绿色
不导电
不导电
导电
导电
导电
久置氯水
液氯
新制氯水
颜色
存在的
微粒
物质的类别
遇干燥的蓝色石蕊试纸
是否导电
氯气参与的反应:
氯离子:
H+、Cl2:
复习三:氯水的一系列反应
与还原性离子Br-、I-、Fe2+反应,例:遇淀粉碘化钾溶液作用使其变蓝。与SO2等还原性物质反应。
与硝酸银溶液
镁粉
H+
:
H+、HClO:
Cl2、HCl、
HClO:
复习三:氯水的一系列反应
CaCO3等
滴加到紫色石蕊溶液,先变红后褪色。
氢氧化钠溶液
Cl2
+
2NaOH
=
NaCl
+
NaClO
+
H2O
MnO2+4HCl(浓)==Cl2↑+MnCl2+2H2O
Ag+
+
Cl-
=
AgCl↓
复习四:三个关键反应
2e-
(1)
浓盐酸在反应中显示出来的性质是
①只有还原性
②还原性和酸性
③只有氧化性
④氧化性和酸性
(2)产生0.6mol
Cl2,则转移的电子的物质的量为
mol。
e-
用20mL10mol/L浓盐酸
与足量的MnO2混合并加热,若不考虑HCl的挥发,则产生
Cl2
物质的量
?
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度比为1﹕3,则Cl2与NaOH溶液反应是被还原的氯元素与被氧化的氯元素的物质的量之比为?
3﹕1
Cl2
的性质、制备实验
萃取实验
Cl2、Cl-的检验
探究实验
复习五:四个典型实验
卤素单质(F2、Cl2
、Br2、I2)与金属的反应
卤素与水反应
卤素单质间的置换反应
结论:氧化性:Cl2
Br2
I2。
ClO3-、Cl-在酸性环境中的反应
2KMnO4+16HCl=2MnCl2+2KCl+
5Cl2↑+8H2O
复习六:知识拓展
工业上用碳还原SiO2制取单质硅会发生如下副反应:SiO2+3C==SiC+2CO。
该反应中
氧化剂与还原剂的质量比为?
海水中有几十种元素,蕴藏着丰富的化学资源。大部分以盐的形式存在,含盐约3%,氯是最重要的成盐元素。若将海洋中的盐全提取出来,铺在地球的陆地上,可使陆地平均升高150m.
浩瀚美丽的大海
资源丰富的大海
海洋是巨大的资源宝库
海洋中含有大量的盐类,主要为NaCl,此外还有MgCl2、MgSO4等,致使海水既咸又苦,不能直接饮用。
我国海盐产量最大的盐场——长芦盐场
富集在海水中的元素
——氯
第一次世界大战时的1915年4月22日,德军与英法联军在比利时的伊普尔对峙。黎明时分,英法联军前线的士兵突然听到一阵剧烈地爆炸声,紧接着看到一股阴森森的
黄绿色气体逐渐从空中降落下来。很快,战壕里的士兵们感觉双眼受到了强烈地刺激,咳嗽响成一片,数百名英法战士窒息死亡,数千名士兵双目失明。
一、氯气的物理性质
物理性质
黄绿色
气体
密度比
空气大
在水中溶解度不大(1:2)
有刺激
性气味
有毒
较低(易液化)
闻气体时的正确操作
2004年4月15日,重庆天原化工总厂贮氯灌意外发生泄漏,为了厂区和周围地区群众的安全,应如何指导周围群众进行自救?
沿逆风方向,向高处转移
用湿毛巾护住口鼻
二、氯气的化学性质
(氧化剂,
强氧化性)
1
.
氯气与金属的反应
2
.
氯气与非金属的反应
3
.
氯气与水的反应
4
.
氯气与碱的反应
1、氯气与金属单质反应
(1)钠与氯气
白色的烟
(2)铁与氯气
(3)铜与氯气反应
棕色的烟
棕色的烟
反应规律:生成高价的氯化物
通常条件,干燥氯气不与铁反应,
用钢瓶盛装和运输氯气。
①安静地燃烧
②苍白色火焰
③瓶口出现白雾
一定条件(点燃或光照)下氯气能与氢气反应
可燃性气体点燃前都要验纯
2、氯气与非金属单质反应
燃烧:
①燃烧不一定要有氧气参加。
②燃烧的本质是氧化还原反应。
③任何发光发热的剧烈的化学反应
叫做燃烧。
你是否在曾经
打开自来水时,
闻到一股刺激性
的气味?
这是什么原因?
思考与讨论
(1)氯气溶于水为何有杀菌、消毒作用?
(2)新制氯水中含有哪些分子和离子?
(3)HClO具有哪些性质?
自主阅读
3、氯气与水的反应
次氯酸
Cl2
+
H2O
==
HCl
+
HClO
化合价降低,得e—,被还原
化合价升高,失e—,被氧化
次氯酸是一种具有强氧化性的弱酸,次氯酸的强氧化性能杀死水里的病菌,所以,自来水常用氯气(在1L水中通入0.002
g
Cl2
)来杀菌消毒。
次氯酸的性质:电子式、结构式
3、强氧化性:
1、弱酸性:
2、不稳定性:
可用于自来水
的杀菌、消毒。
酸性:HClO
<
H2CO3
4、漂白作用:
能漂白一些有色物质,
可用做漂白剂。
光照
HClO与HClO4、ClO-
与S2-、I-、Fe2+、SO32-
现象:
干燥红纸没有褪色,润湿红纸褪色。
加入石灰石有气泡
加入红色鲜花瓣褪色
加入硝酸银溶液白色沉淀
加入硫酸亚铁溶液变为棕黄色
加入石蕊试液先变红后腿色
纯净物
混合物
分子:
离子:
Cl2
,HClO,H2O
H+,Cl-,ClO-,OH-
分子:H2O
离子:
H+,Cl-,
OH-
新制
氧化性
有酸性,强氧化性,漂白性
久置
只有Cl2
只有酸性
★
久置氯水相当于稀盐酸
实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中
液氯
氯水
分类
成分
性质
本节小结
一、氯气的物理性质
二、氯气的化学性质
黄绿色、强烈刺激性气味、有毒气体,密度比空气大,能溶于水(1:2)。
1、能与金属单质化合——生成高价态金属氯化物
2、与氢气化合——实验现象
3、与水反应:
次氯酸的性质(弱酸性、不稳定性、强氧化性、)
重点内容
+金属单质
+H2O
Cl2
+
非金属单质如H2
HCl
金属的
氯化物
HClO
高价态
金属氯化物
HClO的性质
氯水中真正起消毒杀菌作用的物质是次氯酸,而次氯酸又不稳定,在工业上常常把氯气制成次氯酸盐以便存放和运输。
如何得到次氯酸盐?
根据氯气与水的反应原理,
推测氯气与NaOH、
石灰水能否发生反应?
Cl2
+
2OH
?=Cl
?
+
ClO
?
+
H2O
Cl2
+
H2O
=
HCl
+
HClO
HCl
+
NaOH
=
NaCl
+
H2O
HClO+
NaOH
=
NaClO
+
H2O
——在制氯气时吸收尾气
将氯气通入冷的消石灰中可制得漂白粉,请写出此反应的化学方程式。
漂白液
(84消毒液):
漂白粉:
漂粉精:
有效成分
主要成分
NaClO
Ca(ClO)2
Ca(ClO)2
CaCl2、Ca(ClO)2
Ca(ClO)2
NaCl、NaClO
漂白液、漂白粉、漂粉精成分的区别
Ca(ClO)2
+
CO2
+
H2O
=
CaCO3↓+2HClO
(反应原理:
强酸制取弱酸)
日常:
工业:
Ca(ClO)2
+
2HCl=
CaCl2+
2HClO
怎样保存漂白粉?
密封,保存于避光干燥处。
2、漂白液、漂白粉和漂粉精的应用:
(1)漂白棉、麻、纸张。
(2)消毒游泳池等。
1、工业制盐酸
3、氯气在化学工业中的应用
(3)处理工业废水,将具有还原性的有毒物质
硫化氢、氰化物等氧化成无毒物。
(1)SiCl4、GeCl4、TiCl4分别是制取高纯硅、
锗(半导体)和金属钛的重要中间物质;
(2)合成塑料、橡胶、人造纤维、农药、染料
和药品的重要原料;
Cl—
H+
HClO
Cl2
H+、HClO
Cl2、H+
白色沉淀
气泡
褪色
先红后褪色
溶液变棕黄
氯水褪色并有气泡
参与反应的微粒
所加试剂
实验现象
离子方程式或解释
AgNO3
Na2CO3
有色布条
FeCl2
石蕊溶液
镁粉
以氯气、
石灰石、
水
为原料制取漂白粉:
试剂:
HNO3、AgNO3
原理:
Ag++Cl-=AgCl↓
操作:
先加HNO3、再加AgNO3
先加AgNO3、再加HNO3
现象:
有不溶于稀HNO3的白色沉淀生成
MnO2
+
HCl
(浓)
==
1.实验原理
阅读课本P82科学史话
MnCl2
+
H2O
+
Cl2
↑
提示:MnO2
→
Mn2+
氧化剂
还原剂
酸性
4
2
MnO2
+
4H+
+2Cl—
==Mn2+
+
Cl2
↑
+
2H2O
可根据反应物状态和反应条件选择气体发生装置
发生装置
下面有四种常见的气体收集装置,请根据下列提示的Cl2的性质选择合适的装置(
)
1、Cl2
有毒,且密度比空气大
2、Cl2能溶于水,难溶于饱和食盐水
A
B
B
D
收集装置
饱和食盐水
D
气体从长导管进入
实验室制得的多余氯气可以直接排到空气中去吗?
D1
D2
尾气处理装置
应如何处理?请选择合适的装置(
)
发生装置
收集装置
尾气吸收装置
这样收集到的氯气纯净吗?
若想制得纯净、干燥的氯气,请根据提示信息选择合适的装置。
净化装置
2.实验装置
发生装置
净化装置
收集
装置
尾气处理
装置
操作过程:
连接装置
1、为什么用分液漏斗装盐酸?又让盐酸缓慢地注入,而不是一次将浓盐酸注入烧瓶里?
用分液漏斗可以控制液体的用量,避免生成的氯气过多。
问题讨论
2、使用浓盐酸与足量的MnO2共热制Cl2,实际产生的Cl2总比理论值低,其主要原因是什么?
稀盐酸与MnO2不反应,随着反应的进行,浓盐酸的物质的量浓度逐渐变小。
3
、为什么用浓盐酸和二氧化锰制取氯气时,要缓缓加热,不能强热
?
浓盐酸有很强的挥发性,强热时能挥发出大量的氯化氢气体和水蒸气,而使制得的氯气中含有大量的杂质;另一方面,又降低了HCl的利用率。
KMnO4和浓HCl
KClO3和浓HCl
Ca(ClO)2和浓HCl
实验步骤:
1.分别向U型管的两端溶液中滴加1-2滴酚酞。打开电源。
2.用湿润的淀粉KI试纸检验b导管导出的气体。
3.用小试管收集a管产生的气体,用拇指堵住试管口移近酒精灯,松开拇指。
实验现象
结论
a
b
_
+
1.
溴、碘单质的提取
溴元素在海水中以溴离子(Br-)的形式存在,碘元素在海带中以碘离子(I-)的形式存在,生产中从海水中提取溴和从海带中提取碘的化学反应原理如何呢?
在两支试管中分别入2~3mLNaBr和KI
溶液,滴加少量新制氯水,
再滴加少量CCl4,振荡,静置。
原理:Cl2+2NaBr=Br2+2NaCl
现象:分层,下层溶液颜色为橙红色
原理:Cl2+2KI=I2+2KCl
现象:分层,下层溶液颜色为紫红色
在一支试管加入2-3mlKI溶液,滴加少量
溴水,再滴加少量CCl4,振荡、静置。
原理:
2KI
+
Br2
=2KBr
+
I2
现象:分层,下层溶液颜色为紫红色
2Br—
+
Cl2﹦2Cl
—
+
Br2
2I
—
+
Cl2
﹦2Cl
—
+
I2
2I
—
+
Br2
﹦
2Br
—
+
I2
氧化性:
Cl2
>
Br2
>
I2
还原性:
I
—
>
Br
—
>
Cl
—
氧化性:F2>(O2)>Cl2
>
Br2
>Fe3+
>I2>S
还原性:
F-<Cl-<Br-<Fe2+<I-<S2-(HS-、H2S)
①深红棕色液体
(唯一的液态非金属)
②易挥发
(刺激性气味,有毒)
③具有强的腐蚀性
④ρBr2
>ρH2O
棕色试剂瓶中水封保存
2.
溴、碘单质的物理性质
(1)液溴(Br2)
①紫黑色晶体
②易升华
③淀粉溶液遇碘变蓝色
棕色试剂瓶中密封保
(2)碘单质(I2)
检验
碘单质的存在
C12、Br2、I2:
在水中的溶解度越来越小,
在有机溶剂中的溶解度越来越大。
橙黄
橙红
棕黄
紫红
水
CCl4
Br2
I2
Br—
+
Ag+
=
AgBr↓
I—
+
Ag+
=
AgI↓
3.
Br—
、I—的检验
AgNO3溶液和稀硝酸
②现象:
产生浅黄色沉淀(含Br-)
产生黄色沉淀(含I-)
③方程式:
①试剂:
4.
溴、碘化合物的应用
是一种重要感光材料,
是胶卷中必不可少的成分
(1)AgBr(溴化银)
可用于人工降雨,
使空气里的水蒸气凝聚成雨
(2)AgI(碘化银)
Cl2
复习一:氯及其重要化合物的相互转化
NaCl
FeCl3
CuCl2
HCl
HClO
NaClO;
Ca(ClO)2。
Br2;I2。
O2
AgCl
硅及化合物的“反常”
碳主要化合价是“+2、+4”价,而硅常见的化合价是“+4”。
在常温下,硅的化学性质不活泼,但是自然界却没有单质硅存在。
非金属单质与强碱反应一般也不生成氢气,但硅却不然。
Si+2NaOH+
H2O=2H2↑+
Na2SiO3
硅及化合物的“反常”
SiO2不溶于水,但其是硅酸的酸酐,
H2SiO3不能直接与水反应制得,而只能用可溶性硅酸盐与酸作用生成.
无机酸一般易溶于水,硅酸却难溶于水。
酸性氧化物一般不与酸反应,但是SiO2却能够与HF反应.
水玻璃,与玻璃成分完全不一样,且水玻璃溶液呈碱性,但并不是碱溶液,而是盐的溶液。
内容小结:
氯气
1.结构
2.性质
3.用途
a.氯气分子是由2个氯原子构成的双原子分子
b.氯原子的最外电子层上有7个电子
物理性质
化学性质
黄绿色﹑有刺激性气味的有毒气体.
能溶于水﹑易液化
杀菌消毒﹑制盐酸﹑漂白粉﹑农药和有机溶剂等
决定
决定
反映
反映
复习二:氯气与水反应
HClO
电子式、结构式
一元弱酸
(H2CO3>HClO),
强氧化性(杀菌、消毒),
漂白性,
不稳定易分解。
HClO与HClO4、ClO-
与S2-、I-、Fe2+、SO32-
液氯、新制氯水、久置氯水比较
黄绿色
Cl2分子
H2O
Cl2
HClO
H+
、Cl-、ClO-
(OH-)
H2O、H+
Cl-、
(OH-)
纯净物
无明显变化
先变红后褪色
变红
无色
混合物
混合物
淡黄绿色
不导电
不导电
导电
导电
导电
久置氯水
液氯
新制氯水
颜色
存在的
微粒
物质的类别
遇干燥的蓝色石蕊试纸
是否导电
氯气参与的反应:
氯离子:
H+、Cl2:
复习三:氯水的一系列反应
与还原性离子Br-、I-、Fe2+反应,例:遇淀粉碘化钾溶液作用使其变蓝。与SO2等还原性物质反应。
与硝酸银溶液
镁粉
H+
:
H+、HClO:
Cl2、HCl、
HClO:
复习三:氯水的一系列反应
CaCO3等
滴加到紫色石蕊溶液,先变红后褪色。
氢氧化钠溶液
Cl2
+
2NaOH
=
NaCl
+
NaClO
+
H2O
MnO2+4HCl(浓)==Cl2↑+MnCl2+2H2O
Ag+
+
Cl-
=
AgCl↓
复习四:三个关键反应
2e-
(1)
浓盐酸在反应中显示出来的性质是
①只有还原性
②还原性和酸性
③只有氧化性
④氧化性和酸性
(2)产生0.6mol
Cl2,则转移的电子的物质的量为
mol。
e-
用20mL10mol/L浓盐酸
与足量的MnO2混合并加热,若不考虑HCl的挥发,则产生
Cl2
物质的量
?
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度比为1﹕3,则Cl2与NaOH溶液反应是被还原的氯元素与被氧化的氯元素的物质的量之比为?
3﹕1
Cl2
的性质、制备实验
萃取实验
Cl2、Cl-的检验
探究实验
复习五:四个典型实验
卤素单质(F2、Cl2
、Br2、I2)与金属的反应
卤素与水反应
卤素单质间的置换反应
结论:氧化性:Cl2
Br2
I2。
ClO3-、Cl-在酸性环境中的反应
2KMnO4+16HCl=2MnCl2+2KCl+
5Cl2↑+8H2O
复习六:知识拓展
