人教版高一化学必修一2.3氧化还原反应 课件 (共34张PPT)
文档属性
| 名称 | 人教版高一化学必修一2.3氧化还原反应 课件 (共34张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-10 07:42:05 | ||
图片预览






文档简介
(共34张PPT)
氧化还原反应
第
一
课
时
思考与交流
初中学过了氧化反应和还原反应,氧化反应和还原反应是分别独立发生的吗?
?
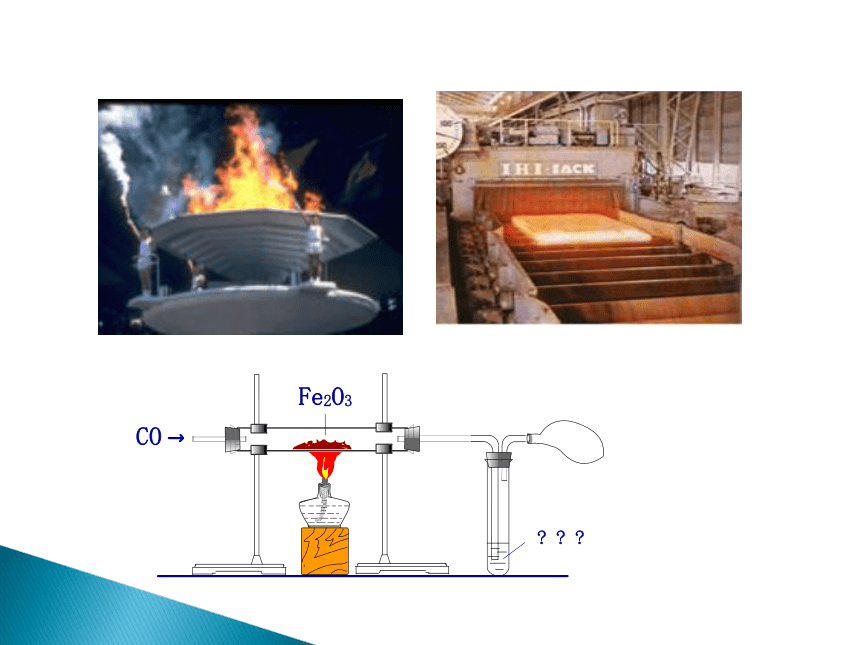
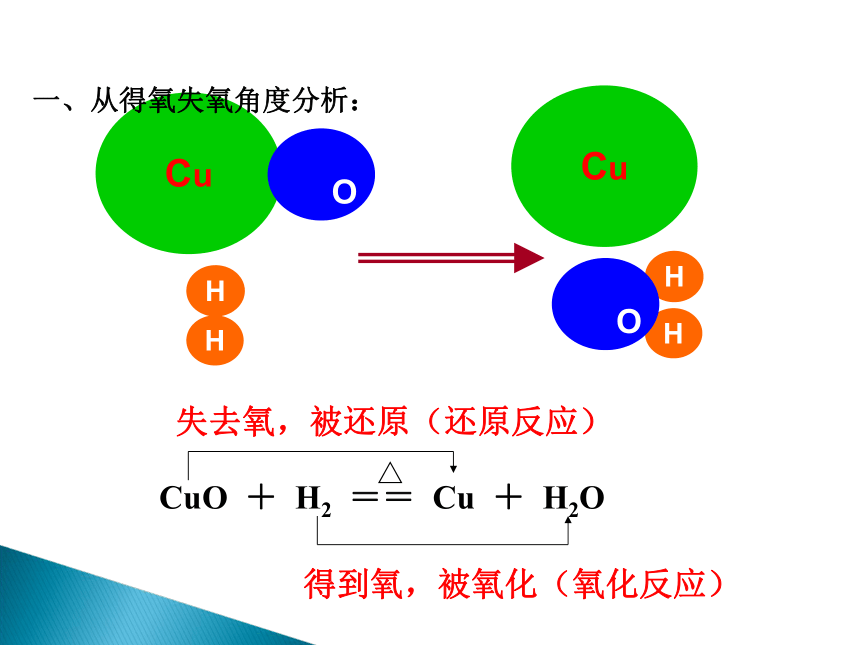
探究一
得到氧,被氧化(氧化反应)
△
CuO
+
H2
==
Cu
+
H2O
失去氧,被还原(还原反应)
Cu
O
H
H
Cu
H
H
O
一、从得氧失氧角度分析:
氧化反应和还原反应是同时
发生的,这样的反应称为氧化
还原反应。
释疑1
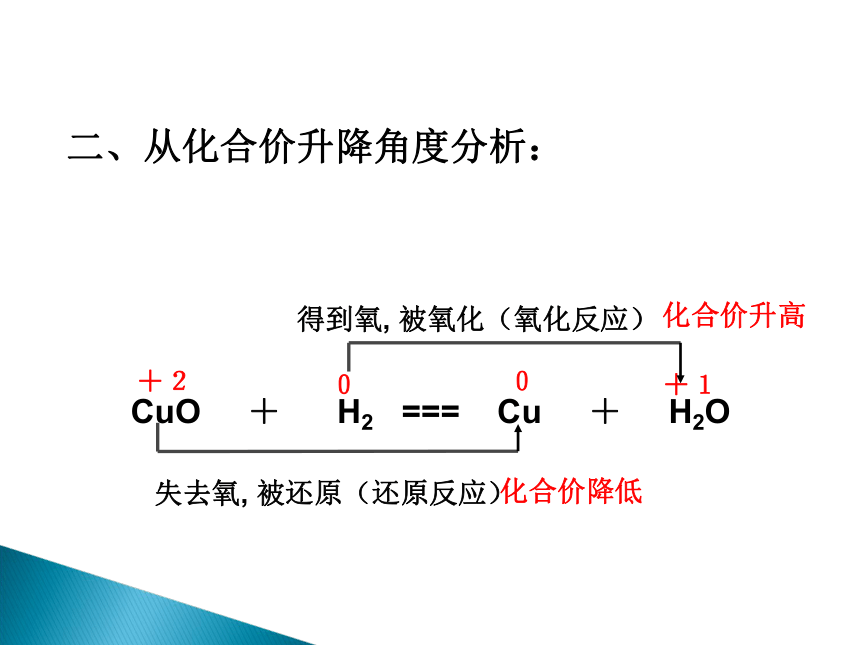
[探究二]以上反应除了包含有得氧失氧的变化之外,还包含有什么变化?
还包含有化合价的变化。
+2
0
0
+1
失去氧,
被还原(还原反应)
得到氧,
被氧化(氧化反应)
CuO
+
H2
===
Cu
+
H2O
二、从化合价升降角度分析:
化合价升高
化合价降低
物质所含元素化合价升高的反应是
氧化反应;
物质所含元素化合价降低的反应是
还原反应。
特征(判断依据)
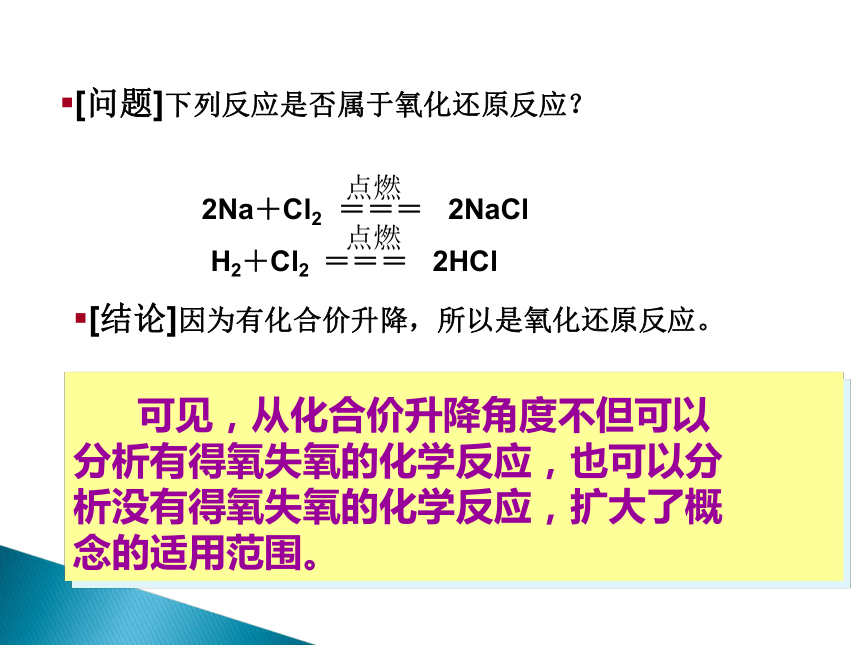
并非只有得氧、失氧的
反应才是氧化还原反应,凡是
有元素化合价升降的化学反应
都是氧化还原反应。
释疑2
可见,从化合价升降角度不但可以
分析有得氧失氧的化学反应,也可以分
析没有得氧失氧的化学反应,扩大了概
念的适用范围。
[结论]因为有化合价升降,所以是氧化还原反应。
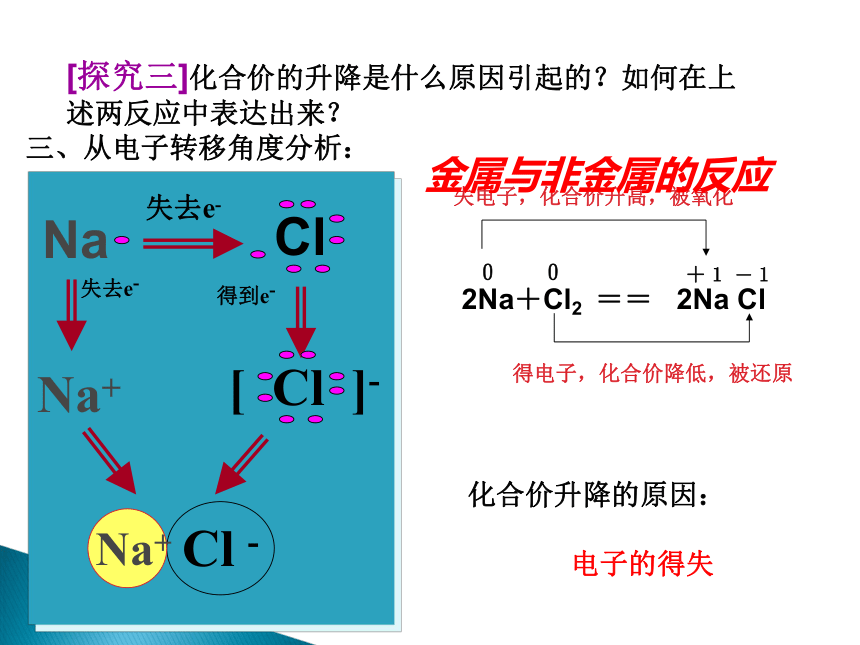
[探究三]化合价的升降是什么原因引起的?如何在上述两反应中表达出来?
金属与非金属的反应
化合价升降的原因:
电子的得失
失去e-
失去e-
得到e-
Na+
三、从电子转移角度分析:
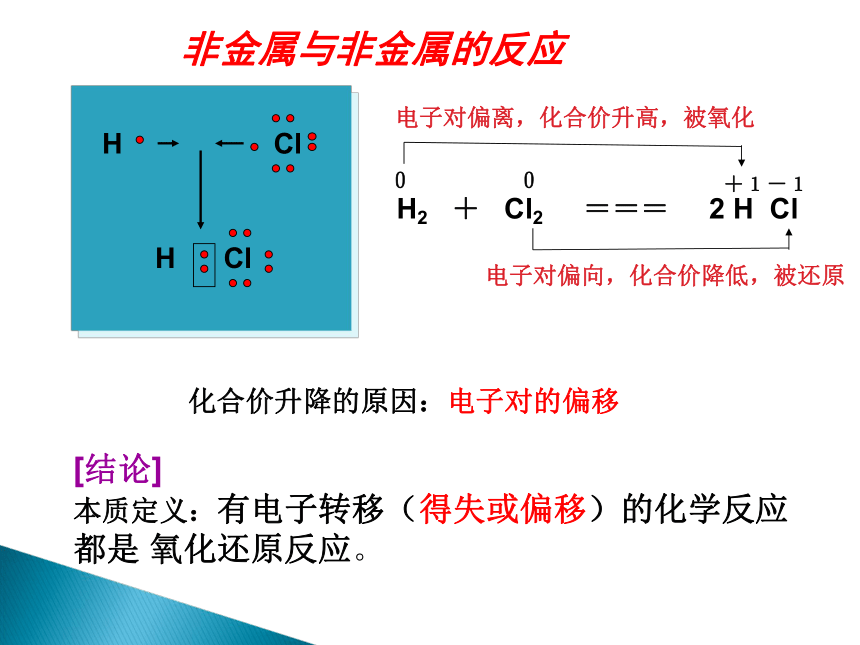
[结论]
本质定义:有电子转移(得失或偏移)的化学反应都是
氧化还原反应。
非金属与非金属的反应
化合价升降的原因:电子对的偏移
H
Cl
小结:氧化还原反应
◆从得氧失氧角度分析
一种物质得到氧被氧化,同时另一种物质失去氧被还原
的化学反应是氧化还原反应。
特点:局限于得氧失氧的反应,是氧化还原反应的表观现象。
◆从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
特点:可作为氧化还原反应的判断依据。
◆从电子转移角度分析
有电子转移(得失或偏移)的化学反应是氧化还原反应。
特点:揭示氧化还原反应的本质。
Ⅰ.分析表格,找出四种基本反应类型与氧化还原反应的关系。
[结论]
置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
√
×
√
×
√
√
×
×
B
分解反应
化合反应
复分解反应
氧化还原反应
置换反应
氧化还原反应与四种基本反应类型的关系:
非氧化还原反应
1.下列反应不属于氧化还原反应的是:
(
)
A.
3C
+
Fe2O3
2Fe
+
3CO↑
B.
2Na
+
Cl2
2NaCl
C.
CaO
+
H2O
Ca(OH)2
D.
Zn
+
H2SO4
ZnSO4
+
H2↑
“火眼金睛”
△
点燃
C
2.下列反应中属于氧化还原反应的是(
)
A
CaCO3
+
2HCl
==
CaCl2
+
CO2↑
+
H2O
B.
Na2O
+
H2O
==
2NaOH
C.
2KMnO4
==
K2MnO4
+
MnO2
+
O2↑
D.
MnO2
+
4HCl
==
MnCl2
+
2H2O
+
Cl2↑
E.
3Fe
+
2O2
==
Fe3O4
CuSO4·5H2O
==
CuSO4
+
5H2O
CDE
第三节 氧化还原反应
(第二课时)
第二章 化学物质及其变化
上节我们学习过,根据反应中物质是否得到氧或失去氧的分类方法,把化学反应分为氧化反应和还原反应。但这种分类方法是比较片面的,有很大的局限性。因为氧化反应和还原反应是同时进行的,它们既是对立的,又是统一的。
既是一个氧化反应,又是一个还原反应。
【思考】是否氧化还原反应都必须有氧的参与呢?
这是一个燃烧反应,也属于一个氧化还原反应。由此看来,氧化还原反应应该有一个更全面、更有说服力的分类标准。这个标准是怎样的呢?
我们分析这些化学反应,从化合价升降的角度。
可以发现:有的化学反应中元素的化合价出现了升降;而有的化学反应中元素的化合价没有发生变化。
一、从化合价升降的角度分析氧化还原反应
氧化还原反应:化学方程式中有化合价升降的元素(如置换反应,有单质参加的化合反应,有单质生成的分解反应等)。
非氧化还原反应:化学方程式中无化合价升降的元素(如复分解反应,无单质参加的化合反应,无单质生成的分解反应等)。
【思考】是什么原因导致了Cu元素的化合价降低,H元素的化合价升高呢?
失电子(电子带负电),化合价升高。
得电子(电子带负电),化合价降低。
【结论】由此可见,引起化合价升降的本质原因是电子的得失。
二、从电子得失(或偏移)的角度分析氧化还原反应
失e-,化合价升高
得e-,化合价降低
Na-e-→Na+ 失电子,化合价升高,被氧化
Cl+e-→Cl- 得电子,化合价降低,被还原
【定义】凡是反应中原子或离子有电子得失(或偏移)的反应就是氧化还原反应。
?
离子化合物:NaCl
离子键
得失电子
失电子
得电子
共价化合物:HCl
共价键
共用电子对
电子对偏移
吸引力强
吸引力弱
【小结】
氧化还原反应标志(判断的标准):化合价的升降
氧化还原反应本质:电子的转移(得失或偏移)
氧化剂:氧化还原反应里得到电子或有电子对偏向的物质。氧化剂从还原剂处得到电子自身被还原变成还原产物。
还原剂:在氧化还原反应里,失去电子或有电子对偏离的物质。还原剂失去电子自身被氧化变成氧化产物。
讨论:试用几种交叉分类法氧化还原反应与基本反应类型的关系
1.下列各类反应中,全部是氧化还原反应的是
( )
A.分解反应
B.化合反应
C.置换反应
D.复分解反应
【课堂练习】
C
CD
2.下列反应是氧化还原反应的是
(?
)
???
B.Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
??????????????????
D
A.氧化剂
B.既不是氧化剂又不是还原剂????
C.还原剂??
D.既是氧化剂又是还原剂
( )
B
4.下列变化须加入还原剂才能实现的反应
(?
)
A.P→P2O5????
B.FeSO4→Fe??
C.Na2SO4→BaSO4??
D.Mg→MgSO4
再见
氧化还原反应
第
一
课
时
思考与交流
初中学过了氧化反应和还原反应,氧化反应和还原反应是分别独立发生的吗?
?
探究一
得到氧,被氧化(氧化反应)
△
CuO
+
H2
==
Cu
+
H2O
失去氧,被还原(还原反应)
Cu
O
H
H
Cu
H
H
O
一、从得氧失氧角度分析:
氧化反应和还原反应是同时
发生的,这样的反应称为氧化
还原反应。
释疑1
[探究二]以上反应除了包含有得氧失氧的变化之外,还包含有什么变化?
还包含有化合价的变化。
+2
0
0
+1
失去氧,
被还原(还原反应)
得到氧,
被氧化(氧化反应)
CuO
+
H2
===
Cu
+
H2O
二、从化合价升降角度分析:
化合价升高
化合价降低
物质所含元素化合价升高的反应是
氧化反应;
物质所含元素化合价降低的反应是
还原反应。
特征(判断依据)
并非只有得氧、失氧的
反应才是氧化还原反应,凡是
有元素化合价升降的化学反应
都是氧化还原反应。
释疑2
可见,从化合价升降角度不但可以
分析有得氧失氧的化学反应,也可以分
析没有得氧失氧的化学反应,扩大了概
念的适用范围。
[结论]因为有化合价升降,所以是氧化还原反应。
[探究三]化合价的升降是什么原因引起的?如何在上述两反应中表达出来?
金属与非金属的反应
化合价升降的原因:
电子的得失
失去e-
失去e-
得到e-
Na+
三、从电子转移角度分析:
[结论]
本质定义:有电子转移(得失或偏移)的化学反应都是
氧化还原反应。
非金属与非金属的反应
化合价升降的原因:电子对的偏移
H
Cl
小结:氧化还原反应
◆从得氧失氧角度分析
一种物质得到氧被氧化,同时另一种物质失去氧被还原
的化学反应是氧化还原反应。
特点:局限于得氧失氧的反应,是氧化还原反应的表观现象。
◆从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
特点:可作为氧化还原反应的判断依据。
◆从电子转移角度分析
有电子转移(得失或偏移)的化学反应是氧化还原反应。
特点:揭示氧化还原反应的本质。
Ⅰ.分析表格,找出四种基本反应类型与氧化还原反应的关系。
[结论]
置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
√
×
√
×
√
√
×
×
B
分解反应
化合反应
复分解反应
氧化还原反应
置换反应
氧化还原反应与四种基本反应类型的关系:
非氧化还原反应
1.下列反应不属于氧化还原反应的是:
(
)
A.
3C
+
Fe2O3
2Fe
+
3CO↑
B.
2Na
+
Cl2
2NaCl
C.
CaO
+
H2O
Ca(OH)2
D.
Zn
+
H2SO4
ZnSO4
+
H2↑
“火眼金睛”
△
点燃
C
2.下列反应中属于氧化还原反应的是(
)
A
CaCO3
+
2HCl
==
CaCl2
+
CO2↑
+
H2O
B.
Na2O
+
H2O
==
2NaOH
C.
2KMnO4
==
K2MnO4
+
MnO2
+
O2↑
D.
MnO2
+
4HCl
==
MnCl2
+
2H2O
+
Cl2↑
E.
3Fe
+
2O2
==
Fe3O4
CuSO4·5H2O
==
CuSO4
+
5H2O
CDE
第三节 氧化还原反应
(第二课时)
第二章 化学物质及其变化
上节我们学习过,根据反应中物质是否得到氧或失去氧的分类方法,把化学反应分为氧化反应和还原反应。但这种分类方法是比较片面的,有很大的局限性。因为氧化反应和还原反应是同时进行的,它们既是对立的,又是统一的。
既是一个氧化反应,又是一个还原反应。
【思考】是否氧化还原反应都必须有氧的参与呢?
这是一个燃烧反应,也属于一个氧化还原反应。由此看来,氧化还原反应应该有一个更全面、更有说服力的分类标准。这个标准是怎样的呢?
我们分析这些化学反应,从化合价升降的角度。
可以发现:有的化学反应中元素的化合价出现了升降;而有的化学反应中元素的化合价没有发生变化。
一、从化合价升降的角度分析氧化还原反应
氧化还原反应:化学方程式中有化合价升降的元素(如置换反应,有单质参加的化合反应,有单质生成的分解反应等)。
非氧化还原反应:化学方程式中无化合价升降的元素(如复分解反应,无单质参加的化合反应,无单质生成的分解反应等)。
【思考】是什么原因导致了Cu元素的化合价降低,H元素的化合价升高呢?
失电子(电子带负电),化合价升高。
得电子(电子带负电),化合价降低。
【结论】由此可见,引起化合价升降的本质原因是电子的得失。
二、从电子得失(或偏移)的角度分析氧化还原反应
失e-,化合价升高
得e-,化合价降低
Na-e-→Na+ 失电子,化合价升高,被氧化
Cl+e-→Cl- 得电子,化合价降低,被还原
【定义】凡是反应中原子或离子有电子得失(或偏移)的反应就是氧化还原反应。
?
离子化合物:NaCl
离子键
得失电子
失电子
得电子
共价化合物:HCl
共价键
共用电子对
电子对偏移
吸引力强
吸引力弱
【小结】
氧化还原反应标志(判断的标准):化合价的升降
氧化还原反应本质:电子的转移(得失或偏移)
氧化剂:氧化还原反应里得到电子或有电子对偏向的物质。氧化剂从还原剂处得到电子自身被还原变成还原产物。
还原剂:在氧化还原反应里,失去电子或有电子对偏离的物质。还原剂失去电子自身被氧化变成氧化产物。
讨论:试用几种交叉分类法氧化还原反应与基本反应类型的关系
1.下列各类反应中,全部是氧化还原反应的是
( )
A.分解反应
B.化合反应
C.置换反应
D.复分解反应
【课堂练习】
C
CD
2.下列反应是氧化还原反应的是
(?
)
???
B.Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
??????????????????
D
A.氧化剂
B.既不是氧化剂又不是还原剂????
C.还原剂??
D.既是氧化剂又是还原剂
( )
B
4.下列变化须加入还原剂才能实现的反应
(?
)
A.P→P2O5????
B.FeSO4→Fe??
C.Na2SO4→BaSO4??
D.Mg→MgSO4
再见
