人教版高一化学必修1第二章第3节氧化还原反应(共28张PPT)
文档属性
| 名称 | 人教版高一化学必修1第二章第3节氧化还原反应(共28张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-10 07:46:25 | ||
图片预览








文档简介
(共28张PPT)
第三节
氧化还原反应
一、氧化还原反应
苹果为什么会变色?
钢铁为什么会生锈?
问题探究一:从得失氧的角度分析下列反应,并思考氧化反应和还原反应为什么一定同时发生?
氧化反应和还原反应同时存在,同时发生,是一个反应的两个方面,所以称为氧化还原反应。
1、从得失氧的角度定义氧化还原反应:
_________________叫氧化反应.
_________________叫还原反应.
________________叫氧化还原反应.
物质得到氧的反应
物质失去氧的反应
有氧得失的反应
一、氧化还原反应
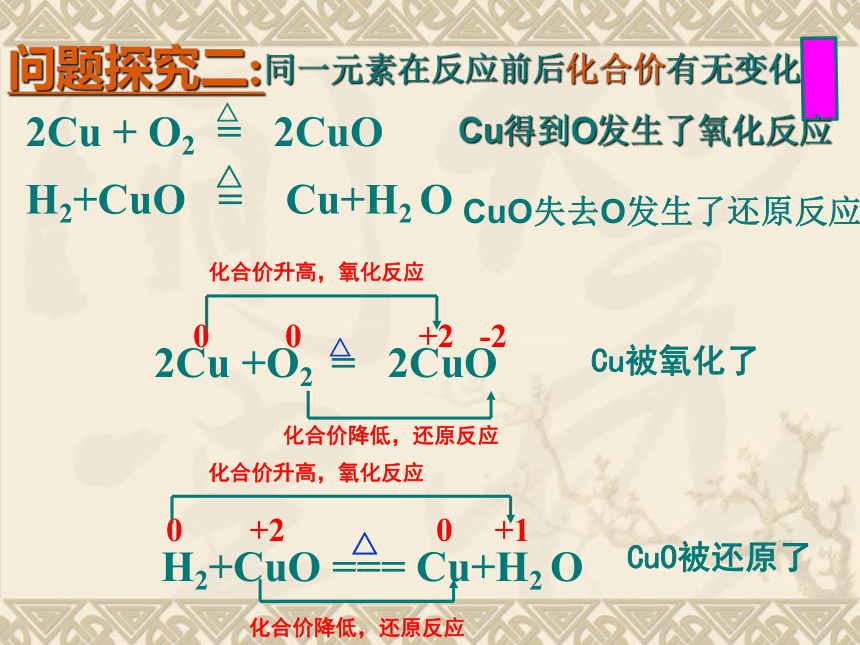
问题探究二:
同一元素在反应前后化合价有无变化
Cu得到O发生了氧化反应
CuO失去O发生了还原反应
0
0
+2
-2
Cu被氧化了
CuO被还原了
2、从化合价升降的角度定义氧化还原反应:
—————————————————
是氧化反应
———————————是还原反应
——————————是氧化还原反应
有元素化合价升高的反应
有元素化合价降低的反应
有元素化合价升降的反应
☆氧化还原反应的特征:元素化合价有升降。
(特征)
一价钾钠氯银氢(
K
Na
Cl
Ag
H
)
二价氧镁钙钡锌
(
O
Mg
Ca
Ba
Zn
)
三铝四硅五氮磷
(
Al
Si
N
P
)
二三铁
二四碳(
Fe
C)
铜汞二价最常见
(
Cu
Hg
)
氢氧负一铵正一(
OH-
NH4+
)
酸根为负要记住
一硝二硫碳三磷
(
NO3-
SO42-
CO32-
PO43-
)
①在单质中,元素的化合价为零。
②在化合物中,正负化合价的代数和为零。
③通常H:+1,O:-2,金属元素显正价,非金属元素显负价。
化合价歌诀
CaO
+
H2O
===
Ca(OH)
2
Fe+CuSO4
==
Cu+FeSO4
NaOH+HCl==NaCl+H2O
分解
置换
复分解
+1+5
-2
+1
-1
0
0
+2
+6-2
0
+2
+6-2
+2
-2
+1
-2
+2
-2
+1
+2
+4
-2
+2
-2
+4
-
2
+1
-2
+1
+1
-1
+1
-1
+1
-
2
1.
2.
3.
4.
5.
6.
7.
8.
0
0
+1
-1
Cl2
+
H2O
=
HCl
+
HClO
0
+1
-2
+1
-1
+1
+1
-2
+3
-2
+2
-2
0
+4
-2
判断下列反应属于哪种基本反应类型?标出各元素的化合价,判断是否属于氧化还原反应?思考一下:四种基本类型反应与氧化还原反应有什么关系?
化学反应
氧化还原反应
非氧化还原反应
0
0
+1
-1
讨论:离子所带电荷与电子转移有何关系?
钠在氯气中燃烧
失去电子,化合价升高
0
0
+1
-1
钠在氯气中燃烧
得到电子,化合价降低
失电子
Na元素化合价升高
得电子
Cl元素化合价降低
氧化反应
还原反应
H
Cl
+1
-1
HCl
化合价的升降的原因:
H2
+Cl2
=
2HCl
0
共用电子对的偏移
化合价变化本质原因的分析:以HCl为例
化合价升高
化合价降低
0
电子对偏向
发生还原反应
电子对偏离
发生氧化反应
3、从电子转移的角度定义氧化还原反应
—————————————————
是氧化反应
———————————是还原反应
——————————
是氧化还原反应
失去电子(或电子对偏离)的反应
得到电子(或电子对偏向)的反应
(☆)有电子转移(得失或偏移)的反应
(本质)
失电子
化合价升高
被氧化
得电子
化合价降低
被还原
(本质判据)
(
特征判据)
氧化反应
还原反应
升
失
氧;降
得
还
氧化还原反应
即:氧化还原反应的本质是电子的转移
据反应物和生成物的
类别及多少
反应中是否有化合价的变化(或电子转移)
氧化还原反应
非氧化还原反应
小结:化学反应分类
特征:化合价发生改变。
本质:电子转移。
升
失
氧
;降
得
还
据有无离子参加或生成
离子反应
非离子反应
氧化剂和还原剂
得到电子或者电子队偏向、所含元素的化合价降低的反应物
失去电子或者电子队偏离、所含元素的化合价升高的反应物
Cu
+
Cl2
==
CuCl2
Zn
+
H2SO4
==
ZnSO4
+
H2↑
CaCO3+
2HCl
==
CaCl2+H2O+CO2↑
Cl2
+
H2O==
HCl
+
HClO
练习1:下列反应中,什么是氧化剂?什么是还原剂?
氧化剂
还原剂
氧化剂
还原剂
既是氧化剂又是还原剂
非氧化还原反应
探究一下:从电子转移的观点说明氧化剂、还原剂的实质是什么?
失电子的反应物
→
所含元素化合价升高→
发生氧化反应
→是还原剂→具有还原性
得e-的反应物
→
所含元素化合价降低→
发生还原反应
→是氧化剂→具有氧化性
使氧化剂发生还原反应的性质
使还原剂发生氧化反应的性质
步骤:1、找变价,
2、连双线,
3、标得失,
(原子数乘每个原子得失电子数)
4、下定义。
1、双线桥法:
2Na+Cl2
==
2Na
Cl
得2e-,化合价降低,被还原
失2e-,化合价升高,被氧化
怎样表示氧化还原反应中电子的转移?
氧化剂
还原剂
练习2:用双线桥法分析下列反应并标明氧化剂和还原剂。
规律:1.电子得失的总数相等
2.电子得失总数与化合价升
降总数相等
2、单线桥法:
方法:
1.找变价,
2.连单线,
3.标总数。
MnO2
+
4HCl
MnCl2
+
Cl2↑+2H2O
+4
-1
+2
0
2e-
注意:得电子数=失电子数=转移的电子数
(原子数乘每个原子得失电子数)
练习3:用单线桥法分析下列反应,标明氧化剂和还原剂,并且指出什么物质发生氧化反应,什么物质发生还原反应。
试判断下列元素所处价态的氧化性、还原性:
探究一下:元素价态与氧化性还原性的关系
元素处于最低价:只有还原性,无氧化性
元素处于最高价:只有氧化性,无还原性
元素处于中间价态:既有氧化性,又有还原性
高价氧化、低价还、中间价态两边转
活泼的非金属单质:O2,Cl2等
高价态的含氧酸:HNO3,浓H2SO4等
含高价态元素的盐:KMnO4
,FeCl3等
常见的氧化剂和还原剂:
氧化剂
活泼的金属单质:Fe,Na,Zn
非金属单质:H2,C
低价态的氧化物和盐:CO,
亚硫酸钠(Na2SO3),
SO2
硫酸亚铁(FeSO4)
还原剂
广泛存在的氧化还原反应
生铁冶炼
呼吸作用
各种电池
光合作用
本课小结:
1、双线桥法和单线桥法分析氧化还原反应。
(1)双线桥法:找变价、连双线、标得失、下定义。
(2)单线桥法:找变价,连单线,标总数。
2、氧化剂和还原剂的判断。
化合价降低的元素所在的反应物就是氧化剂;
化合价升高的元素所在的反应物就是还原剂。
第三节
氧化还原反应
一、氧化还原反应
苹果为什么会变色?
钢铁为什么会生锈?
问题探究一:从得失氧的角度分析下列反应,并思考氧化反应和还原反应为什么一定同时发生?
氧化反应和还原反应同时存在,同时发生,是一个反应的两个方面,所以称为氧化还原反应。
1、从得失氧的角度定义氧化还原反应:
_________________叫氧化反应.
_________________叫还原反应.
________________叫氧化还原反应.
物质得到氧的反应
物质失去氧的反应
有氧得失的反应
一、氧化还原反应
问题探究二:
同一元素在反应前后化合价有无变化
Cu得到O发生了氧化反应
CuO失去O发生了还原反应
0
0
+2
-2
Cu被氧化了
CuO被还原了
2、从化合价升降的角度定义氧化还原反应:
—————————————————
是氧化反应
———————————是还原反应
——————————是氧化还原反应
有元素化合价升高的反应
有元素化合价降低的反应
有元素化合价升降的反应
☆氧化还原反应的特征:元素化合价有升降。
(特征)
一价钾钠氯银氢(
K
Na
Cl
Ag
H
)
二价氧镁钙钡锌
(
O
Mg
Ca
Ba
Zn
)
三铝四硅五氮磷
(
Al
Si
N
P
)
二三铁
二四碳(
Fe
C)
铜汞二价最常见
(
Cu
Hg
)
氢氧负一铵正一(
OH-
NH4+
)
酸根为负要记住
一硝二硫碳三磷
(
NO3-
SO42-
CO32-
PO43-
)
①在单质中,元素的化合价为零。
②在化合物中,正负化合价的代数和为零。
③通常H:+1,O:-2,金属元素显正价,非金属元素显负价。
化合价歌诀
CaO
+
H2O
===
Ca(OH)
2
Fe+CuSO4
==
Cu+FeSO4
NaOH+HCl==NaCl+H2O
分解
置换
复分解
+1+5
-2
+1
-1
0
0
+2
+6-2
0
+2
+6-2
+2
-2
+1
-2
+2
-2
+1
+2
+4
-2
+2
-2
+4
-
2
+1
-2
+1
+1
-1
+1
-1
+1
-
2
1.
2.
3.
4.
5.
6.
7.
8.
0
0
+1
-1
Cl2
+
H2O
=
HCl
+
HClO
0
+1
-2
+1
-1
+1
+1
-2
+3
-2
+2
-2
0
+4
-2
判断下列反应属于哪种基本反应类型?标出各元素的化合价,判断是否属于氧化还原反应?思考一下:四种基本类型反应与氧化还原反应有什么关系?
化学反应
氧化还原反应
非氧化还原反应
0
0
+1
-1
讨论:离子所带电荷与电子转移有何关系?
钠在氯气中燃烧
失去电子,化合价升高
0
0
+1
-1
钠在氯气中燃烧
得到电子,化合价降低
失电子
Na元素化合价升高
得电子
Cl元素化合价降低
氧化反应
还原反应
H
Cl
+1
-1
HCl
化合价的升降的原因:
H2
+Cl2
=
2HCl
0
共用电子对的偏移
化合价变化本质原因的分析:以HCl为例
化合价升高
化合价降低
0
电子对偏向
发生还原反应
电子对偏离
发生氧化反应
3、从电子转移的角度定义氧化还原反应
—————————————————
是氧化反应
———————————是还原反应
——————————
是氧化还原反应
失去电子(或电子对偏离)的反应
得到电子(或电子对偏向)的反应
(☆)有电子转移(得失或偏移)的反应
(本质)
失电子
化合价升高
被氧化
得电子
化合价降低
被还原
(本质判据)
(
特征判据)
氧化反应
还原反应
升
失
氧;降
得
还
氧化还原反应
即:氧化还原反应的本质是电子的转移
据反应物和生成物的
类别及多少
反应中是否有化合价的变化(或电子转移)
氧化还原反应
非氧化还原反应
小结:化学反应分类
特征:化合价发生改变。
本质:电子转移。
升
失
氧
;降
得
还
据有无离子参加或生成
离子反应
非离子反应
氧化剂和还原剂
得到电子或者电子队偏向、所含元素的化合价降低的反应物
失去电子或者电子队偏离、所含元素的化合价升高的反应物
Cu
+
Cl2
==
CuCl2
Zn
+
H2SO4
==
ZnSO4
+
H2↑
CaCO3+
2HCl
==
CaCl2+H2O+CO2↑
Cl2
+
H2O==
HCl
+
HClO
练习1:下列反应中,什么是氧化剂?什么是还原剂?
氧化剂
还原剂
氧化剂
还原剂
既是氧化剂又是还原剂
非氧化还原反应
探究一下:从电子转移的观点说明氧化剂、还原剂的实质是什么?
失电子的反应物
→
所含元素化合价升高→
发生氧化反应
→是还原剂→具有还原性
得e-的反应物
→
所含元素化合价降低→
发生还原反应
→是氧化剂→具有氧化性
使氧化剂发生还原反应的性质
使还原剂发生氧化反应的性质
步骤:1、找变价,
2、连双线,
3、标得失,
(原子数乘每个原子得失电子数)
4、下定义。
1、双线桥法:
2Na+Cl2
==
2Na
Cl
得2e-,化合价降低,被还原
失2e-,化合价升高,被氧化
怎样表示氧化还原反应中电子的转移?
氧化剂
还原剂
练习2:用双线桥法分析下列反应并标明氧化剂和还原剂。
规律:1.电子得失的总数相等
2.电子得失总数与化合价升
降总数相等
2、单线桥法:
方法:
1.找变价,
2.连单线,
3.标总数。
MnO2
+
4HCl
MnCl2
+
Cl2↑+2H2O
+4
-1
+2
0
2e-
注意:得电子数=失电子数=转移的电子数
(原子数乘每个原子得失电子数)
练习3:用单线桥法分析下列反应,标明氧化剂和还原剂,并且指出什么物质发生氧化反应,什么物质发生还原反应。
试判断下列元素所处价态的氧化性、还原性:
探究一下:元素价态与氧化性还原性的关系
元素处于最低价:只有还原性,无氧化性
元素处于最高价:只有氧化性,无还原性
元素处于中间价态:既有氧化性,又有还原性
高价氧化、低价还、中间价态两边转
活泼的非金属单质:O2,Cl2等
高价态的含氧酸:HNO3,浓H2SO4等
含高价态元素的盐:KMnO4
,FeCl3等
常见的氧化剂和还原剂:
氧化剂
活泼的金属单质:Fe,Na,Zn
非金属单质:H2,C
低价态的氧化物和盐:CO,
亚硫酸钠(Na2SO3),
SO2
硫酸亚铁(FeSO4)
还原剂
广泛存在的氧化还原反应
生铁冶炼
呼吸作用
各种电池
光合作用
本课小结:
1、双线桥法和单线桥法分析氧化还原反应。
(1)双线桥法:找变价、连双线、标得失、下定义。
(2)单线桥法:找变价,连单线,标总数。
2、氧化剂和还原剂的判断。
化合价降低的元素所在的反应物就是氧化剂;
化合价升高的元素所在的反应物就是还原剂。
