2-1 化学反应速率 课件
图片预览






文档简介
(共19张PPT)
第一节 化学反应速率
人教版选修4 · 化学反应原理
第二章 化学反应速率与化学平衡
快慢差别很大的化学反应
浓度常用mol.L-1,时间常用s,min。
化学反应的速率单位为:
mol·L-1·min-1 或 mol·L-1·s-1
数学表达式为:
表示方法:用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)
(单位由浓度和时间的单位决定)
ν(B ) =
c(B)
△t
化学反应速率及其表示方法
练习: 某物质B其反应时的初始浓度为2mol/L,经过2秒后,其最终浓度为1.6mol/L,则在这两秒内B的化学反应速率是多少?
1.化学反应速率为正值。
2.化学反应速率是平均速率,不是瞬时速率。
3.化学反应速率不能用固体或纯液体表示。
注意
A (g) + 2 B(g) = 3C(g)
起始浓度(mol·L-1) 1.0 1.2 0
变化浓度(mol·L-1)
2min时浓度(mol·L-1) 0.8
例:在一体积固定为2L的密闭容器中,加入2mol的A与2.4mol的B,发生了A(g) + 2B(g) == 3C(g)的反应,2分钟后A剩余了1.6mol.
(1)求2分钟后B、C的浓度。(2)ν(A) ,ν(B) ,ν(C)
0.2
0.4 0.6
0.8 0.6
v(A) = 0.2mol·L-1/2min =0.1mol ·(L·min)-1
v(B) = 0.4mol·L-1/2min =0.2mol ·(L·min)-1
v(C) = 0.6mol·L-1/2min =0.3mol ·(L·min)-1
v(A): v(B): v(C)= 1:2:3
各物质的速率之比等于系数之比
即:对于反应 aA+bB==cC+dD
△C(A):△C(B):△C(C):△C(D)= a︰b︰c︰d
v(A)︰v(B)︰v(C)︰v(D)=a︰b︰c︰d
4.同一反应的反应速率用不同物质的浓度变化来表示;其数值可能相同,也可能不同,但其意义相同;其数值之比等于化学方程式的系数比。
注意
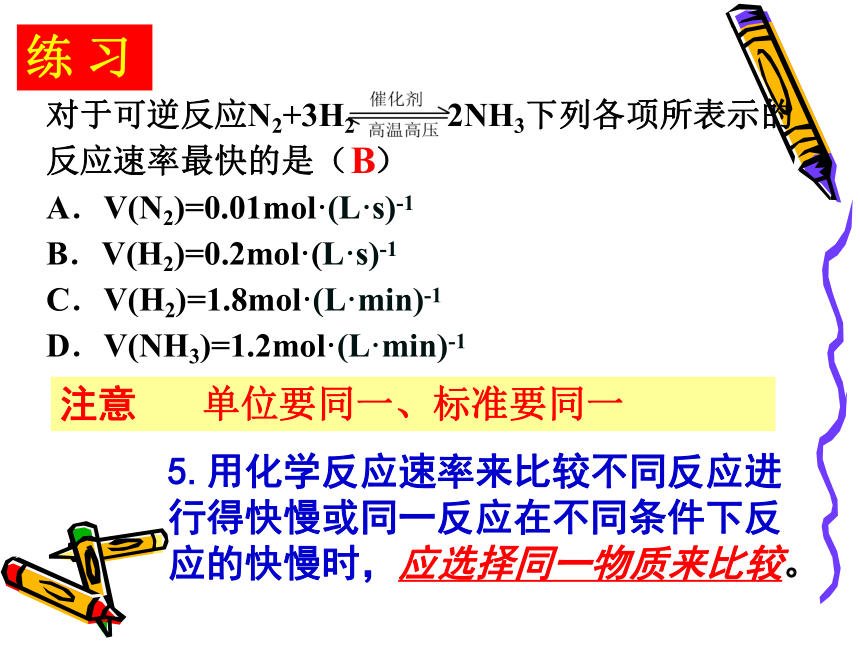
对于可逆反应N2+3H2 2NH3下列各项所表示的反应速率最快的是( )
A.V(N2)=0.01mol·(L·s)-1
B.V(H2)=0.2mol·(L·s)-1
C.V(H2)=1.8mol·(L·min)-1
D.V(NH3)=1.2mol·(L·min)-1
练 习
B
单位要同一、标准要同一
5.用化学反应速率来比较不同反应进行得快慢或同一反应在不同条件下反应的快慢时,应选择同一物质来比较。
注意
测定方法有∶
1、直接观察某些性质(如气体的体积和压强);
2、科学仪器测定(如导电能力等);
3、溶液中,常利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应速率。
测定分为两个阶段,
一是测定物质浓度和时间;二是利用 求结果。
如何测定化学反应速率
对于锌和不同浓度的稀硫酸的实验,你准备如何比较反应速率的快慢?
实验2一1
①观察产生气泡的快、慢;
②观察试管中剩余锌粒的质量的多、少;
③用手触摸试管,感受试管外壁温度的
高、低
实验现象来判断反应的快慢
定性描述
①测定氢气的体积或氢气的质量的变化
②测量体系的压强的变化
③测定锌粒的质量的变化
④测定H+的浓度或Zn2+的浓度变化
⑤测定体系的温度或测定反应的热量变化⑥测量溶液的导电能力的变化
实验测量来判断反应的快慢
定量描述——化学反应速率
如何通过用注射器测量氢气的体积的方法来判断锌和不同浓度的稀硫酸反应的速率快慢?
①确定变量
②找出某种易于测量的某种物理量或 性质的变化
③控制不变的因素
——稀硫酸的浓度不同
——锌粒的表面积、温度
——时间或氢气的体积
——测量氢气的体积或时间
实验2一1步骤:
1、连接实验装置
2、检查装置的气密性
3、先向锥形瓶中加入锌粒,然后再向分液漏斗中加入稀硫酸
4、使稀硫酸滴入锥形瓶与锌粒反应
5、观察收集10mLH2所用的时间或1分钟收集到的H2的体积
定量描述
1、在一定条件下,mA + nB = pC的反应中,各物质的化学反应速率为
v(A)=amol/(L·s), v(B)=0.5amol/(L·s),
v(C)=amol/(L·s),则该反应的化学方程式为:______________________
2A+B=2C
2、反应A(g) + 3B(g)=2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol,有关反应速率正确的是( )
A、V(A)=0.005mol/(L·s)
B、V(C)=0.002mol/(L·s)
C、V(B)=V(A)/3
D、V(A)=0.001mol/(L·s)
A
随堂训练
小结
1.化学反应速率为正值。
2.化学反应速率是平均速率,不是瞬时速率。
3.化学反应速率不能用固体或纯液体表示。
4.用化学反应速率来比较不同反应进行得快慢或同一反应在不同条件下反应的快慢时,应选择同一物质来比较。
5.同一反应的反应速率用不同物质的浓度变化来表示;其数值可能相同,也可能不同,但其意义相同;其数值之比等于化学方程式的系数比。
第一节 化学反应速率
人教版选修4 · 化学反应原理
第二章 化学反应速率与化学平衡
快慢差别很大的化学反应
浓度常用mol.L-1,时间常用s,min。
化学反应的速率单位为:
mol·L-1·min-1 或 mol·L-1·s-1
数学表达式为:
表示方法:用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)
(单位由浓度和时间的单位决定)
ν(B ) =
c(B)
△t
化学反应速率及其表示方法
练习: 某物质B其反应时的初始浓度为2mol/L,经过2秒后,其最终浓度为1.6mol/L,则在这两秒内B的化学反应速率是多少?
1.化学反应速率为正值。
2.化学反应速率是平均速率,不是瞬时速率。
3.化学反应速率不能用固体或纯液体表示。
注意
A (g) + 2 B(g) = 3C(g)
起始浓度(mol·L-1) 1.0 1.2 0
变化浓度(mol·L-1)
2min时浓度(mol·L-1) 0.8
例:在一体积固定为2L的密闭容器中,加入2mol的A与2.4mol的B,发生了A(g) + 2B(g) == 3C(g)的反应,2分钟后A剩余了1.6mol.
(1)求2分钟后B、C的浓度。(2)ν(A) ,ν(B) ,ν(C)
0.2
0.4 0.6
0.8 0.6
v(A) = 0.2mol·L-1/2min =0.1mol ·(L·min)-1
v(B) = 0.4mol·L-1/2min =0.2mol ·(L·min)-1
v(C) = 0.6mol·L-1/2min =0.3mol ·(L·min)-1
v(A): v(B): v(C)= 1:2:3
各物质的速率之比等于系数之比
即:对于反应 aA+bB==cC+dD
△C(A):△C(B):△C(C):△C(D)= a︰b︰c︰d
v(A)︰v(B)︰v(C)︰v(D)=a︰b︰c︰d
4.同一反应的反应速率用不同物质的浓度变化来表示;其数值可能相同,也可能不同,但其意义相同;其数值之比等于化学方程式的系数比。
注意
对于可逆反应N2+3H2 2NH3下列各项所表示的反应速率最快的是( )
A.V(N2)=0.01mol·(L·s)-1
B.V(H2)=0.2mol·(L·s)-1
C.V(H2)=1.8mol·(L·min)-1
D.V(NH3)=1.2mol·(L·min)-1
练 习
B
单位要同一、标准要同一
5.用化学反应速率来比较不同反应进行得快慢或同一反应在不同条件下反应的快慢时,应选择同一物质来比较。
注意
测定方法有∶
1、直接观察某些性质(如气体的体积和压强);
2、科学仪器测定(如导电能力等);
3、溶液中,常利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应速率。
测定分为两个阶段,
一是测定物质浓度和时间;二是利用 求结果。
如何测定化学反应速率
对于锌和不同浓度的稀硫酸的实验,你准备如何比较反应速率的快慢?
实验2一1
①观察产生气泡的快、慢;
②观察试管中剩余锌粒的质量的多、少;
③用手触摸试管,感受试管外壁温度的
高、低
实验现象来判断反应的快慢
定性描述
①测定氢气的体积或氢气的质量的变化
②测量体系的压强的变化
③测定锌粒的质量的变化
④测定H+的浓度或Zn2+的浓度变化
⑤测定体系的温度或测定反应的热量变化⑥测量溶液的导电能力的变化
实验测量来判断反应的快慢
定量描述——化学反应速率
如何通过用注射器测量氢气的体积的方法来判断锌和不同浓度的稀硫酸反应的速率快慢?
①确定变量
②找出某种易于测量的某种物理量或 性质的变化
③控制不变的因素
——稀硫酸的浓度不同
——锌粒的表面积、温度
——时间或氢气的体积
——测量氢气的体积或时间
实验2一1步骤:
1、连接实验装置
2、检查装置的气密性
3、先向锥形瓶中加入锌粒,然后再向分液漏斗中加入稀硫酸
4、使稀硫酸滴入锥形瓶与锌粒反应
5、观察收集10mLH2所用的时间或1分钟收集到的H2的体积
定量描述
1、在一定条件下,mA + nB = pC的反应中,各物质的化学反应速率为
v(A)=amol/(L·s), v(B)=0.5amol/(L·s),
v(C)=amol/(L·s),则该反应的化学方程式为:______________________
2A+B=2C
2、反应A(g) + 3B(g)=2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol,有关反应速率正确的是( )
A、V(A)=0.005mol/(L·s)
B、V(C)=0.002mol/(L·s)
C、V(B)=V(A)/3
D、V(A)=0.001mol/(L·s)
A
随堂训练
小结
1.化学反应速率为正值。
2.化学反应速率是平均速率,不是瞬时速率。
3.化学反应速率不能用固体或纯液体表示。
4.用化学反应速率来比较不同反应进行得快慢或同一反应在不同条件下反应的快慢时,应选择同一物质来比较。
5.同一反应的反应速率用不同物质的浓度变化来表示;其数值可能相同,也可能不同,但其意义相同;其数值之比等于化学方程式的系数比。
