高中化学鲁科版 选修五 2.3 醛和酮 乙醛(共23张PPT)
文档属性
| 名称 | 高中化学鲁科版 选修五 2.3 醛和酮 乙醛(共23张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-10 00:00:00 | ||
图片预览



文档简介
(共23张PPT)
第二章
烃的衍生物
醛和酮
糖类
第一课时
乙醛
1、了解乙醛的物理和化学性质
2、能利用醛与银氨溶液、新制氢氧化铜悬浊液的反应
来鉴定有机物分子中是否含有醛基,并能正确书写
相应的化学方程式。
3、能举例说明醛、酮催化加氢还原为醇的反应,并能
正确书写相应的化学方程式。
4、能举例说明从醛、酮到羧酸、醇等物质的转化。
学
习
目
标
复习
乙醇在加热和Cu或Ag做催化剂的条件下,能发生催化氧化。
常见的醛
1.
醛的定义
(1)醛分子中,羰基(
)碳原子与氢原子和烃基(或氢原子)相连而构成的有机化合物,
通式为:
官能团是醛基:
H
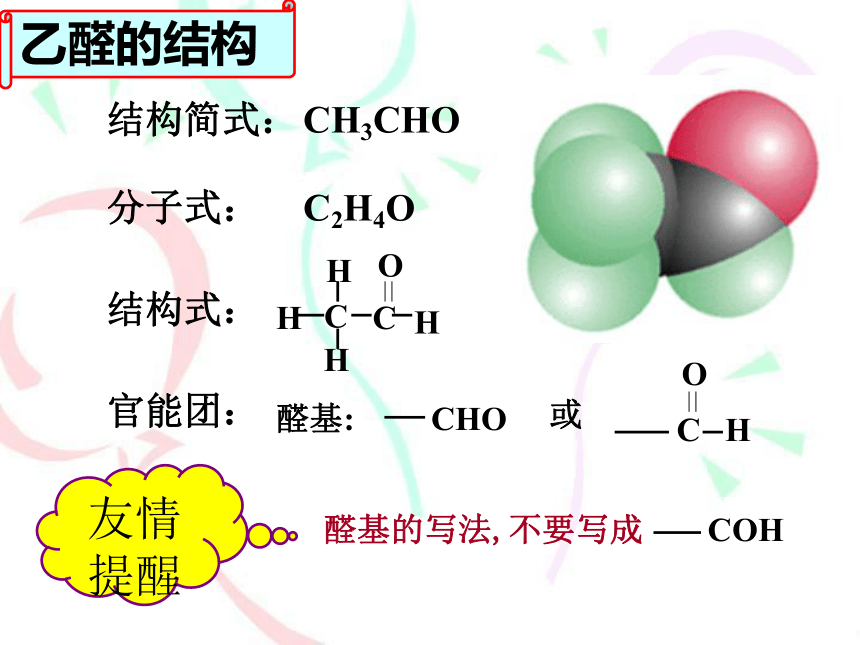
乙醛的结构
结构式:
分子式:
结构简式:
C2H4O
CH3CHO
官能团:
友情
提醒
乙醛是一种____色,有刺激性气味
的____体,密度比水____,易挥发、
易燃烧、易溶于水及乙醇、乙醚、
氯仿等溶剂。
乙醛
无
液
小
【物理性质】
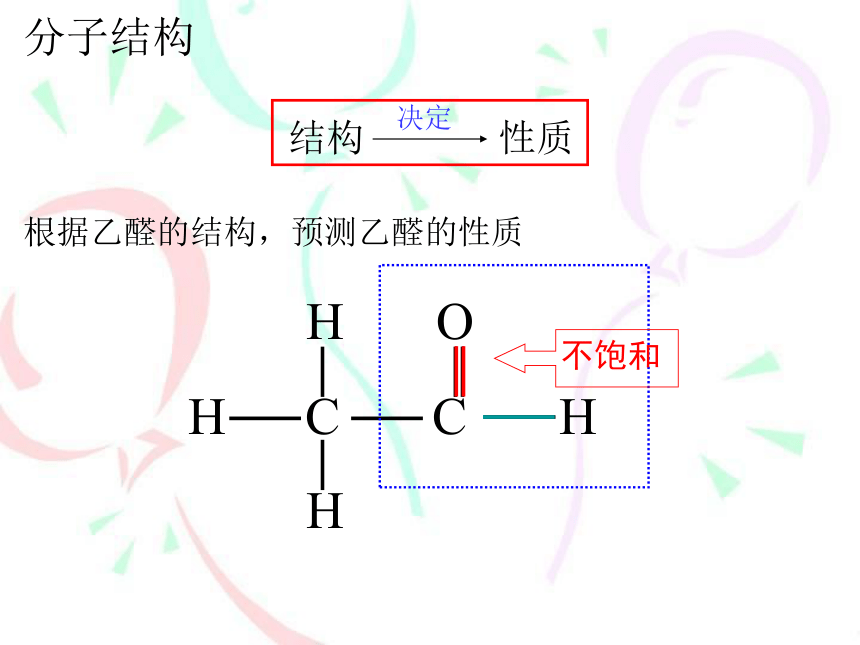
H
O
H
C
C
H
H
根据乙醛的结构,预测乙醛的性质
分子结构
乙醛的化学性质
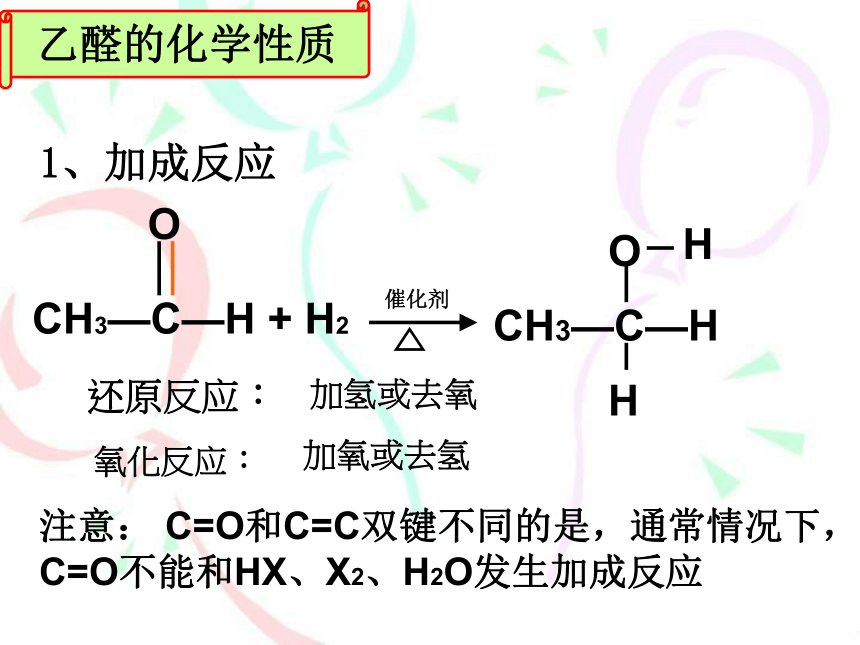
CH3—C—H
+
H2
O
催化剂
O
H
H
1、加成反应
CH3—C—H
注意:
C=O和C=C双键不同的是,通常情况下,C=O不能和HX、X2、H2O发生加成反应
还原反应:
加氢或去氧
氧化反应:
加氧或去氢
乙醛与其它试剂的加成反应
C
H
3
O
H
C
H
CN
H
乙醛可以被还原成乙醇,
那么乙醛能否被氧化呢?
思
考
(2)乙醛的氧化反应
(I)催化氧化
工业制乙酸
2、化学性质
羧基
(或—COOH)
官能团:
2、化学性质
(2)乙醛的氧化反应
(II)燃烧
银氨溶液、新制Cu(OH)2悬浊液
2
5
4
4
2、化学性质
(ⅰ)银镜反应
①制备银氨溶液
AgNO3
+
NH3·H2O
=
AgOH↓+
NH4NO3
AgOH
+
2NH3·H2O
=
Ag(NH3)2OH
+
2H2O
(氢氧化二氨合银)
乙醛的银镜反应.flv
2、化学性质
现象:
试管内壁出现一层光亮的银
②实验过程
2、化学性质
③作用
a、检验醛基的存在
b、定量测定醛基的个数
1mol–CHO被氧化,就应有2molAg被还原
④注意事项
(1)试管内壁必须洁净;
(2)银氨溶液要现配现用;
(3)碱性环境,水浴加热;
(4)加热过程中不能摇动试管;
(5)用稀HNO3清洗试管内壁的银镜。
2、化学性质
(ⅱ)与新制Cu(OH)2悬浊液反应
①新制Cu(OH)2悬浊液的配制
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
在试管里加入10%的NaOH溶液2mL,滴入2%的CuSO4溶液4~6滴。
2、化学性质
②实验过程
现象:
试管内有砖红色沉淀产生
△
△
2、化学性质
注意事项
(1)
Cu(OH)2悬浊液必须是新制的;
(2)碱性环境,直接加热。
两个反应的共同点:
1、均在碱性环境中进行。
2、可用于鉴定-CHO的存在。
3、-CHO与Ag(NH3)2OH或
Cu(OH)2均以
物质的量比1:2反应(醛基的特征反应)。
【归纳】
乙醛能被弱氧化剂(银氨溶液等)氧化,
能否使溴水、
酸性KMnO4溶液、
重铬酸钾溶液褪色?
能
小结
CH3-C-O-H
CH3CH2OH
O
【巩固练习】
1.洗涤做过银镜反应的试管可以选用的试剂是(
)
A.氨水
B.NaOH溶液
C.稀硝酸
D.酒精
2.关于丙烯醛(CH2=CH-CHO)的叙述不正确的是(
)
A.可使溴水和KMnO4溶液褪色
B.与足量的H2加成生成丙醛
C.能发生银镜反应
D.在一定条件下可氧化成酸
C
B
第二章
烃的衍生物
醛和酮
糖类
第一课时
乙醛
1、了解乙醛的物理和化学性质
2、能利用醛与银氨溶液、新制氢氧化铜悬浊液的反应
来鉴定有机物分子中是否含有醛基,并能正确书写
相应的化学方程式。
3、能举例说明醛、酮催化加氢还原为醇的反应,并能
正确书写相应的化学方程式。
4、能举例说明从醛、酮到羧酸、醇等物质的转化。
学
习
目
标
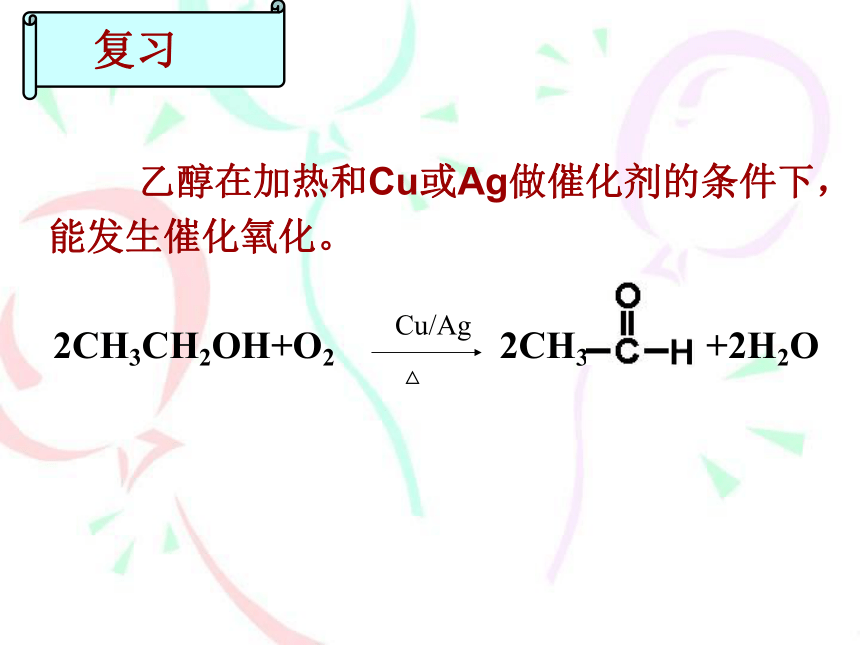
复习
乙醇在加热和Cu或Ag做催化剂的条件下,能发生催化氧化。
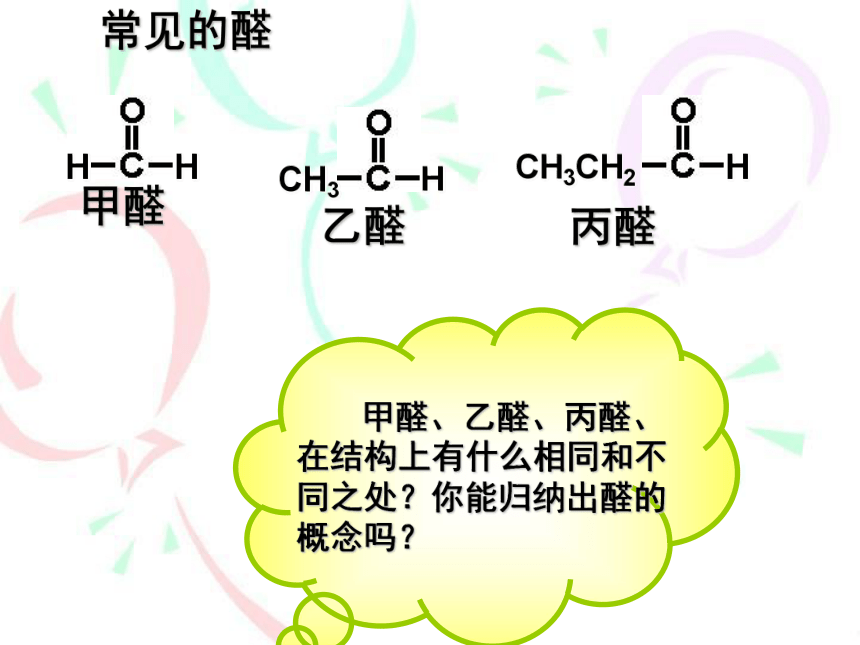
常见的醛
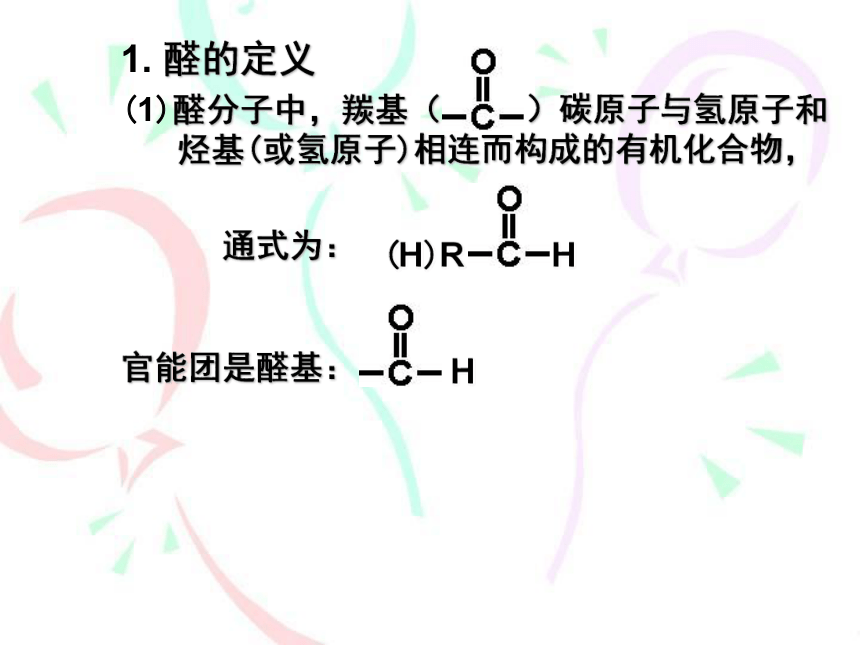
1.
醛的定义
(1)醛分子中,羰基(
)碳原子与氢原子和烃基(或氢原子)相连而构成的有机化合物,
通式为:
官能团是醛基:
H
乙醛的结构
结构式:
分子式:
结构简式:
C2H4O
CH3CHO
官能团:
友情
提醒
乙醛是一种____色,有刺激性气味
的____体,密度比水____,易挥发、
易燃烧、易溶于水及乙醇、乙醚、
氯仿等溶剂。
乙醛
无
液
小
【物理性质】
H
O
H
C
C
H
H
根据乙醛的结构,预测乙醛的性质
分子结构
乙醛的化学性质
CH3—C—H
+
H2
O
催化剂
O
H
H
1、加成反应
CH3—C—H
注意:
C=O和C=C双键不同的是,通常情况下,C=O不能和HX、X2、H2O发生加成反应
还原反应:
加氢或去氧
氧化反应:
加氧或去氢
乙醛与其它试剂的加成反应
C
H
3
O
H
C
H
CN
H
乙醛可以被还原成乙醇,
那么乙醛能否被氧化呢?
思
考
(2)乙醛的氧化反应
(I)催化氧化
工业制乙酸
2、化学性质
羧基
(或—COOH)
官能团:
2、化学性质
(2)乙醛的氧化反应
(II)燃烧
银氨溶液、新制Cu(OH)2悬浊液
2
5
4
4
2、化学性质
(ⅰ)银镜反应
①制备银氨溶液
AgNO3
+
NH3·H2O
=
AgOH↓+
NH4NO3
AgOH
+
2NH3·H2O
=
Ag(NH3)2OH
+
2H2O
(氢氧化二氨合银)
乙醛的银镜反应.flv
2、化学性质
现象:
试管内壁出现一层光亮的银
②实验过程
2、化学性质
③作用
a、检验醛基的存在
b、定量测定醛基的个数
1mol–CHO被氧化,就应有2molAg被还原
④注意事项
(1)试管内壁必须洁净;
(2)银氨溶液要现配现用;
(3)碱性环境,水浴加热;
(4)加热过程中不能摇动试管;
(5)用稀HNO3清洗试管内壁的银镜。
2、化学性质
(ⅱ)与新制Cu(OH)2悬浊液反应
①新制Cu(OH)2悬浊液的配制
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
在试管里加入10%的NaOH溶液2mL,滴入2%的CuSO4溶液4~6滴。
2、化学性质
②实验过程
现象:
试管内有砖红色沉淀产生
△
△
2、化学性质
注意事项
(1)
Cu(OH)2悬浊液必须是新制的;
(2)碱性环境,直接加热。
两个反应的共同点:
1、均在碱性环境中进行。
2、可用于鉴定-CHO的存在。
3、-CHO与Ag(NH3)2OH或
Cu(OH)2均以
物质的量比1:2反应(醛基的特征反应)。
【归纳】
乙醛能被弱氧化剂(银氨溶液等)氧化,
能否使溴水、
酸性KMnO4溶液、
重铬酸钾溶液褪色?
能
小结
CH3-C-O-H
CH3CH2OH
O
【巩固练习】
1.洗涤做过银镜反应的试管可以选用的试剂是(
)
A.氨水
B.NaOH溶液
C.稀硝酸
D.酒精
2.关于丙烯醛(CH2=CH-CHO)的叙述不正确的是(
)
A.可使溴水和KMnO4溶液褪色
B.与足量的H2加成生成丙醛
C.能发生银镜反应
D.在一定条件下可氧化成酸
C
B
