高中化学人教版选修4第一节-弱电解质的电离-人教版(22张PPT)
文档属性
| 名称 | 高中化学人教版选修4第一节-弱电解质的电离-人教版(22张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-12 00:00:00 | ||
图片预览






文档简介
(共22张PPT)
第三章:水溶液中的离子平衡
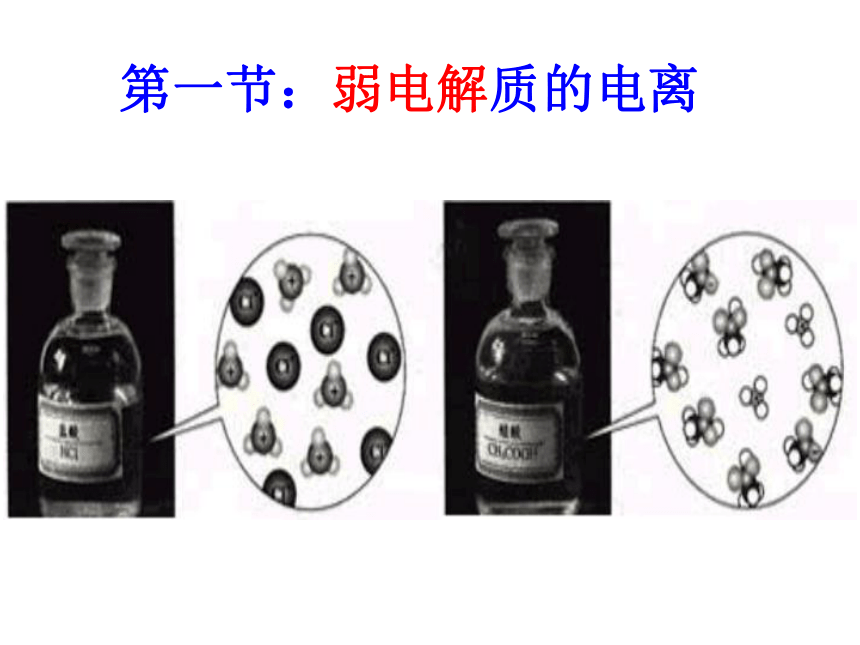
第一节:弱电解质的电离
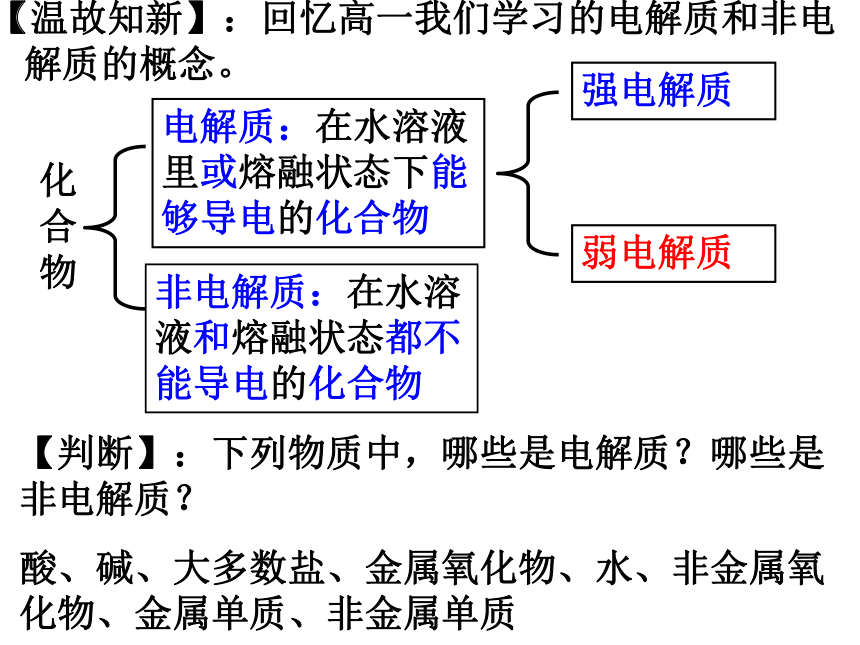
【温故知新】:回忆高一我们学习的电解质和非电解质的概念。
化合物
电解质:在水溶液里或熔融状态下能够导电的化合物
非电解质:在水溶液和熔融状态都不能导电的化合物
【判断】:下列物质中,哪些是电解质?哪些是非电解质?
酸、碱、大多数盐、金属氧化物、水、非金属氧化物、金属单质、非金属单质
强电解质
弱电解质
想一想
1、醋酸和盐酸都属于电解质,醋酸是弱酸、盐酸是强酸。为什么?他们有何不同?
2、书写离子方程式时,盐酸要拆分成离子的形式,而醋酸不能拆分,可能什么原因?
3、课本实验:3-1,同浓度盐酸和醋酸分别与同样镁条反应,分别测定PH。
剧烈:产生气泡速率较快,试管外壁温度明显升高,镁片逐渐减少。
缓慢:产生气泡较慢,试管外壁温度变化不明显。镁片逐渐减少。
0
~
1
2~3
分析:产生以上实验现象差异的根本原因是什么?
HCl是强酸,完全电离;CH3COOH是弱酸部分电离。
1mol/L
HCl
1
mol/L
CH3COOH
与镁反应现象
溶液pH
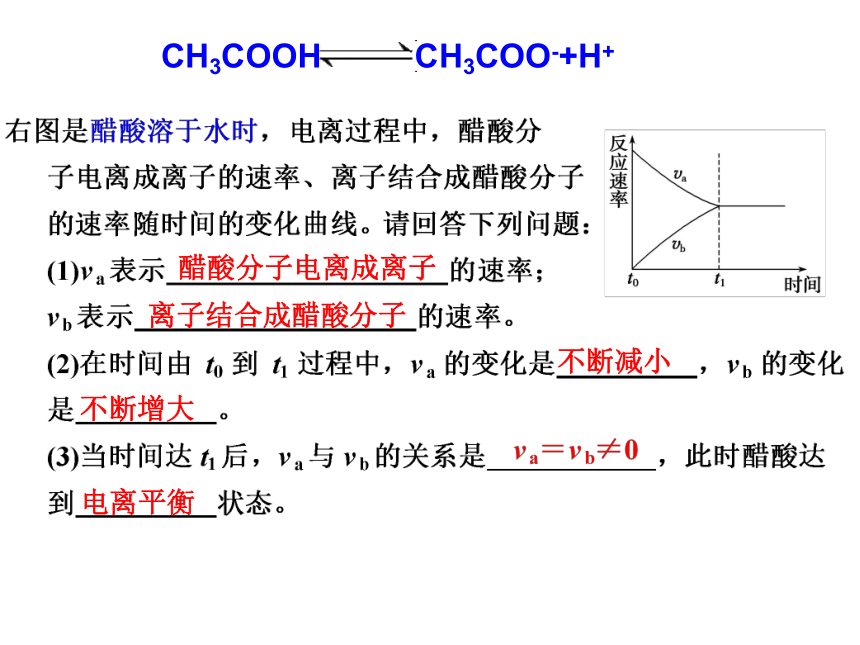
醋酸分子电离成离子
离子结合成醋酸分子
不断减小
不断增大
电离平衡
CH3COOH
CH3COO-+H+
课本P40:图片
HCl电离示意图
CH3COOH电离示意图
HCl===H++Cl-
CH3COOH
CH3COO-+H+
课本P41:【思考与交流】
1、完成课本第42页表格1,根据表格中各种微粒浓度的变化情况,绘制微粒浓度—随时间变化的关系图。
结合速率-时间图P41页,观察两者之间的关系。
HA电离的速率—时间图、浓度—时间图
强电解质和弱电解质
强电解质:能够全部电离的电解质称为强电解质,包括强酸、强碱和绝大部分盐;
弱电解质:部分电离的电解质称为弱电解质,包括弱酸、弱碱、水。
请思考:弱电解质的水溶液中存在的微粒有哪些?(以乙酸溶液)为例进行说明。
H2O、CH3COOH、H+、CH3COO-
练习
下列物质中,属于强电解质的是(
),属于弱电解质的是(
),属于非电解质的是(
)
A、碘化钾
B、乙醇
C、氨气
D、蔗糖
E、氢硫酸
F、硫酸氢钠
G、氨水
H、液氧
I、氢氧化钠溶液
J、过氧化钠
K、氢氧化钡
L、二氧化碳
M、硫酸钡
N、冰醋酸
练习
写出NH3·H2O、
CsOH
、Fe(OH)3、
CH3COOH、
H2SO4、Na2SO4、NaHCO3、NaHSO4的电离方程式。
注意:弱酸的电离为可逆反应需注意可逆符号!
强酸的电离是完全的,不需要写可逆符号!
探究作业
思考:哪些外界条件的改变可以使醋酸的电离平衡:
CH3COOH
CH3COO-+H+发生移动?(尽可能多)
向右移动
增大
增大
减小
减小
向右移动
向右移动
向左移动
向左移动
增大
减小
减小
减小
增大
增大
第一节:弱电解质的电离
-----电离平衡常数
【温故知新】:
1、化学平衡常数的大小表达的含义是什么?
2、化学平衡常数与哪些因素有关,与哪些因素无关?
【阅读】课本P42-43页“科学视野”回答以下问题。
1、电离平衡常数与化学平衡常数有什么关系?
2、电离平衡常数的大小表达什么具体含义?
3、弱酸分多步电离,请从平衡移动和物质结构两个角度分析为什么第一步电离比第二步电离的程度要大很多?
4、从表格3-1中给出的几种酸分步电离平衡常数的数值,分析对于多元酸的电离,只考虑一步电离是否合理?
实验3-2:酸性强弱的比较方法:
思考:1、通过该实验,我们可以得到什么结论?
2、如何设计实验比较HA、HB两种酸的酸性强弱?
《步步高》P120:11
11.已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2===HCN+NaNO2 NaCN+HF===HCN+NaF NaNO2+HF===HNO2+NaF。
由此可判断下列叙述中不正确的是
( )
A.K(HF)=7.2×10-4
B.K(HNO2)=4.9×10-10
C.根据两个反应即可得出一元弱酸的强弱顺序为HF>HNO2>HCN
D.K(HCN)小结:影响弱酸电离程度(电离度)的因素
一种弱电解质电离程度大小,与酸的种类、温度、浓度是否有关?有何关系?
同浓度同体积的盐酸和醋酸相比较
大
小
小
大
相同
相同
大
小
大
小
c(H+)
pH
中和NaOH的物质的量
与过量活泼金属反应产生H2的量
开始与金属反应的速率
稀释相同倍数后c(H+)的变化
HCl
HAc
同pH同体积的盐酸和醋酸相比较
相同
小
大
小
大
小
大
相同
大
小
c(H+)
c(酸)
中和NaOH的物质的量
与过量活泼金属反应产生H2的量
开始与金属反应的速率
稀释相同倍数后c(H+)的变化
HCl
HAc
思考
1、某物质是否导电由什么决定?
2、溶液导电能力的强弱由什么决定?
3、强电解质的水溶液是否导电能力一定强?
4、强电解质水溶液导电性一定比弱电解质水溶液导电性强吗?
5、NH3的水溶液能导电吗?NH3是否为电解质?
6、熔融的NaCl是否导电?熔融的HCl呢?NaCl水溶液呢?HCl水溶液呢?
第三章:水溶液中的离子平衡
第一节:弱电解质的电离
【温故知新】:回忆高一我们学习的电解质和非电解质的概念。
化合物
电解质:在水溶液里或熔融状态下能够导电的化合物
非电解质:在水溶液和熔融状态都不能导电的化合物
【判断】:下列物质中,哪些是电解质?哪些是非电解质?
酸、碱、大多数盐、金属氧化物、水、非金属氧化物、金属单质、非金属单质
强电解质
弱电解质
想一想
1、醋酸和盐酸都属于电解质,醋酸是弱酸、盐酸是强酸。为什么?他们有何不同?
2、书写离子方程式时,盐酸要拆分成离子的形式,而醋酸不能拆分,可能什么原因?
3、课本实验:3-1,同浓度盐酸和醋酸分别与同样镁条反应,分别测定PH。
剧烈:产生气泡速率较快,试管外壁温度明显升高,镁片逐渐减少。
缓慢:产生气泡较慢,试管外壁温度变化不明显。镁片逐渐减少。
0
~
1
2~3
分析:产生以上实验现象差异的根本原因是什么?
HCl是强酸,完全电离;CH3COOH是弱酸部分电离。
1mol/L
HCl
1
mol/L
CH3COOH
与镁反应现象
溶液pH
醋酸分子电离成离子
离子结合成醋酸分子
不断减小
不断增大
电离平衡
CH3COOH
CH3COO-+H+
课本P40:图片
HCl电离示意图
CH3COOH电离示意图
HCl===H++Cl-
CH3COOH
CH3COO-+H+
课本P41:【思考与交流】
1、完成课本第42页表格1,根据表格中各种微粒浓度的变化情况,绘制微粒浓度—随时间变化的关系图。
结合速率-时间图P41页,观察两者之间的关系。
HA电离的速率—时间图、浓度—时间图
强电解质和弱电解质
强电解质:能够全部电离的电解质称为强电解质,包括强酸、强碱和绝大部分盐;
弱电解质:部分电离的电解质称为弱电解质,包括弱酸、弱碱、水。
请思考:弱电解质的水溶液中存在的微粒有哪些?(以乙酸溶液)为例进行说明。
H2O、CH3COOH、H+、CH3COO-
练习
下列物质中,属于强电解质的是(
),属于弱电解质的是(
),属于非电解质的是(
)
A、碘化钾
B、乙醇
C、氨气
D、蔗糖
E、氢硫酸
F、硫酸氢钠
G、氨水
H、液氧
I、氢氧化钠溶液
J、过氧化钠
K、氢氧化钡
L、二氧化碳
M、硫酸钡
N、冰醋酸
练习
写出NH3·H2O、
CsOH
、Fe(OH)3、
CH3COOH、
H2SO4、Na2SO4、NaHCO3、NaHSO4的电离方程式。
注意:弱酸的电离为可逆反应需注意可逆符号!
强酸的电离是完全的,不需要写可逆符号!
探究作业
思考:哪些外界条件的改变可以使醋酸的电离平衡:
CH3COOH
CH3COO-+H+发生移动?(尽可能多)
向右移动
增大
增大
减小
减小
向右移动
向右移动
向左移动
向左移动
增大
减小
减小
减小
增大
增大
第一节:弱电解质的电离
-----电离平衡常数
【温故知新】:
1、化学平衡常数的大小表达的含义是什么?
2、化学平衡常数与哪些因素有关,与哪些因素无关?
【阅读】课本P42-43页“科学视野”回答以下问题。
1、电离平衡常数与化学平衡常数有什么关系?
2、电离平衡常数的大小表达什么具体含义?
3、弱酸分多步电离,请从平衡移动和物质结构两个角度分析为什么第一步电离比第二步电离的程度要大很多?
4、从表格3-1中给出的几种酸分步电离平衡常数的数值,分析对于多元酸的电离,只考虑一步电离是否合理?
实验3-2:酸性强弱的比较方法:
思考:1、通过该实验,我们可以得到什么结论?
2、如何设计实验比较HA、HB两种酸的酸性强弱?
《步步高》P120:11
11.已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2===HCN+NaNO2 NaCN+HF===HCN+NaF NaNO2+HF===HNO2+NaF。
由此可判断下列叙述中不正确的是
( )
A.K(HF)=7.2×10-4
B.K(HNO2)=4.9×10-10
C.根据两个反应即可得出一元弱酸的强弱顺序为HF>HNO2>HCN
D.K(HCN)
一种弱电解质电离程度大小,与酸的种类、温度、浓度是否有关?有何关系?
同浓度同体积的盐酸和醋酸相比较
大
小
小
大
相同
相同
大
小
大
小
c(H+)
pH
中和NaOH的物质的量
与过量活泼金属反应产生H2的量
开始与金属反应的速率
稀释相同倍数后c(H+)的变化
HCl
HAc
同pH同体积的盐酸和醋酸相比较
相同
小
大
小
大
小
大
相同
大
小
c(H+)
c(酸)
中和NaOH的物质的量
与过量活泼金属反应产生H2的量
开始与金属反应的速率
稀释相同倍数后c(H+)的变化
HCl
HAc
思考
1、某物质是否导电由什么决定?
2、溶液导电能力的强弱由什么决定?
3、强电解质的水溶液是否导电能力一定强?
4、强电解质水溶液导电性一定比弱电解质水溶液导电性强吗?
5、NH3的水溶液能导电吗?NH3是否为电解质?
6、熔融的NaCl是否导电?熔融的HCl呢?NaCl水溶液呢?HCl水溶液呢?
