选修四1.2 燃烧热 能源(课件26页)
文档属性
| 名称 | 选修四1.2 燃烧热 能源(课件26页) |  | |
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-13 11:53:42 | ||
图片预览







文档简介
(共26张PPT)
第一章
化学反应与能量
第二节
燃烧热
能源
学习目标
宏观辨识与变化观念:
理解燃烧热的定义及燃烧热的化学方程式的书写;
科学态度与社会责任:
知道能源是人类生存和社会发展的重要基础,知道使用化石燃料的利弊和新能源的开发。
1
2
新知导入
另一种形式的反应热:燃烧热
新知讲解
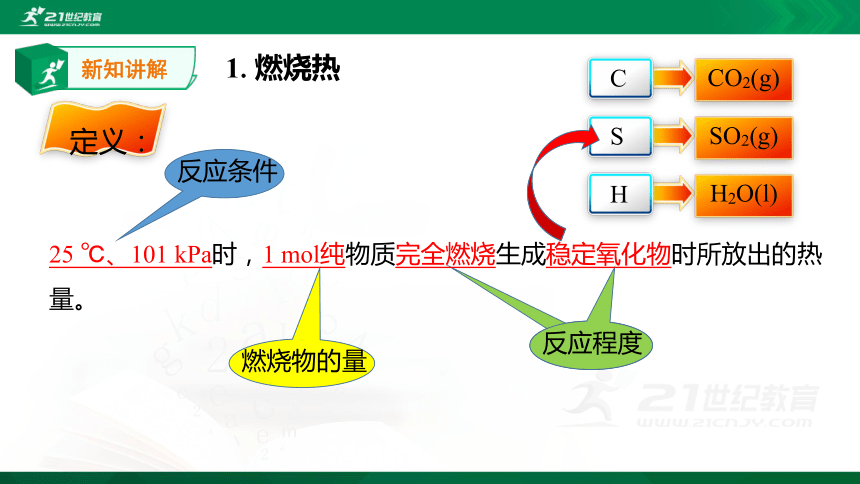
1.燃烧热
25
℃、101
kPa时,1
mol纯物质完全燃烧生成稳定氧化物时所放出的热量。
定义:
反应条件
燃烧物的量
反应程度
C
S
H
新知讲解
1.燃烧热
ΔH为
?
或ΔH
<
0
kJ·mol?1
符号
意义
单位
25
℃、101
kPa时甲烷的燃烧热ΔH=-890.31
kJ·mol?1,热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.31
kJ·mol-1。
说明:1
mol
甲烷完全燃烧生成CO2(g)和H2O(l)时放出890.31
kJ的热量。
新知讲解
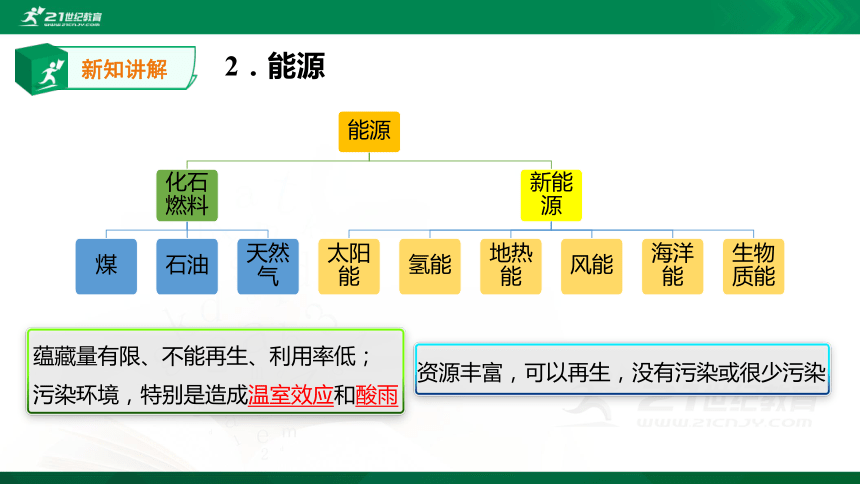
2.能源
定义:能提供能量的资源
化石燃料
阳光
风力
水力
潮汐
柴草
新知讲解
2.能源
能源
化石燃料
煤
石油
天然气
新能源
太阳能
氢能
地热能
风能
海洋能
生物质能
蕴藏量有限、不能再生、利用率低;
污染环境,特别是造成温室效应和酸雨
资源丰富,可以再生,没有污染或很少污染
课堂练习
1.判断正误(正确的打“√”,错误的打“×”)
(1)1
mol碳在常温常压下燃烧所放出的热量为碳的燃烧热。
( )
(2)1
mol
H2完全燃烧生成1
mol气态水所放出的热量称为氢气的燃烧热。
( )
(3)化石燃料主要包括石油、煤和天然气,它们蕴藏无限,可以再生。
( )
(4)太阳能是一级能源、新能源、可再生能源。
( )
×
√
×
×
课堂练习
2.已知热化学方程式
①CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=–890
kJ·mol-1
②2H2(g)+O2(g)===2H2O(l) ΔH=–571.6
kJ·mol-1
③2CO(g)+O2(g)===2CO2(g) ΔH=–566
kJ·mol-1
则CH4、H2、CO的燃烧热分别为_____________、____________、_______________。
890
kJ·mol-1
285.8
kJ·mol-1
283
kJ·mol-1
课堂练习
3.形成节约能源和保护生态环境的产业结构是人类与自然和谐发展的重要保证,你认为下列行为中有悖于这一保证的是( )
A.开发太阳能、生物质能、风能等新能源,减少使用煤、石油等化石燃料
B.研究采煤、采油新技术,提高产量以满足工业生产的快速发展
C.在农村推广使用沼气
D.减少资源消耗、增加资源的重复使用和资源的循环再生
B
课堂练习
解析:开发太阳能、生物质能、风能等新能源,减少了煤、石油等化石燃料的使用,减少污染,保护环境,故A正确;
研究采煤、采油新技术,提高产量以满足工业生产的快速发展,化石燃料在地球上的含量是有限的,加大开采,必然带来能源的匮乏和污染物的增多,故B错误;
在农村推广使用沼气,沼气是由植物秸秆等发酵制得的,属于可再生资源,故C正确;
减少资源消耗、增加资源的重复使用和资源的循环再生,符合节约能源和保护生态环境的要求,D正确。
课堂练习
4.“能源分类相关图”如图所示,以下能源中符合图中的阴影部分的有_____________。
①煤炭 ②石油 ③潮汐能 ④生物质能 ⑤天然气 ⑥太阳能 ⑦风能 ⑧沼气 ⑨地热能 ⑩核能
④⑥⑦⑧
课堂练习
5.以下几个热化学方程式中能表示燃烧热的热化学方程式的是( )
A.C(s)+O2(g)===CO(g) ΔH=–110.5
kJ·mol–1
B.C8H18(l)+O2(g)===8CO2(g)+9H2O(l) ΔH=–5
518
kJ·mol–1
C.2H2(g)+O2(g)===2H2O(l) ΔH=–571.6
kJ·mol–1
D.H2(g)+O2(g)===H2O(g) ΔH=–241.8
kJ·mol–1
B
课堂练习
解析:
A项,C(s)燃烧未生成稳定氧化物CO2(g),故其反应热不能叫燃烧热;
B项,符合燃烧热的定义;
C项,H2虽然转变成了稳定的氧化物H2O(l),但由于其反应热表示的是2
mol
H2完全燃烧时的热量变化,故不是燃烧热;
D项,参加燃烧的H2虽然是1
mol,但其生成H2O(g),而不是H2O(l),故它的反应热也不是H2的燃烧热。
核心突破
可燃物的化学计量数是否为1
碳元素完全燃烧生成的氧化物是否为CO2(g)
氢元素完全燃烧生成的氧化物是否为H2O(l)
ΔH是否为“—”及单位是否正确
表示燃烧热的热化学方程式的“四点”要求:
素养养成
?
燃烧热
中和热
相同点
能量变化
放热反应
ΔH及其单位
ΔH<0,单位均为kJ·mol-1
不
同
点
反应物的量
1
mol
不一定为1
mol
生成物的量
不确定
生成水的量为1
mol
表示方法
燃烧热为a
kJ·mol-1或ΔH=-a
kJ·mol-1
中和热为57.3
kJ·mol-1或
ΔH=-57.3
kJ·mol-1
课堂总结
作业布置
1.有专家指出,如果对燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合,从而能够实现如图所示转化,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为( )
A.热能
B.化学能
C.生物质能
D.电能
作业布置
2.已知:2CO(g)+O2(g)===2CO2(g) ΔH=–566
kJ·mol–1,下列说法正确的是
( )
A.CO的燃烧热为–283
kJ·mol–1
B.CO的燃烧热为566
kJ·mol–1
C.CO的燃烧热ΔH=–283
kJ·mol–1
D.如图可表示由CO生成CO2的反应过程和能量关系
作业布置
3.对于2C4H10(g)+13O2(g)===8CO2(g)+10H2O(l);ΔH=-5
800
kJ·mol-1的叙述中不正确的是( )
A.该反应的反应热为ΔH=-5
800
kJ·mol-1,是放热反应
B.该反应的ΔH与各物质的状态有关,与化学计量数也有关
C.该式的含义为:25
℃、101
kPa下,2
mol
C4H10气体完全燃烧生成CO2和液态水时放出热量5
800
kJ
D.该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5
800
kJ·mol-1
作业布置
4.下列选项中说明乙醇作为燃料的优点的是( )
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境 ③乙醇是一种再生能源 ④燃烧时放出大量的热
A.①②③
B.①②④
C.①③④
D.②③④
作业布置
5.(1)液化石油气的主要成分是丙烷,其燃烧的热化学方程式为:C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-2
219.9
kJ·mol-1
已知CO气体燃烧的热化学方程式为:
CO(g)+1/2O2(g)===CO2(g) ΔH=-283
kJ·mol-1
试比较同物质的量的C3H8和CO燃烧,产生的热量比值约为_____。
(2)已知氢气燃烧的热化学方程式为:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6
kJ·mol-1
比较同质量的氢气和丙烷燃烧,产生的热量比值约为________。
作业解答
1.题中关键信息是利用太阳能使CO2、H2O、N2重新组合,由图可知组合成燃料,燃料燃烧后转化为燃烧产物并放出热量,燃烧产物又结合太阳能转化为燃料,如此循环太阳能最终转化为热能。答案:A
2.CO的燃烧热为283
kJ·mol-1,D图中的量标示错误。答案:C
3.D项考查燃烧热的概念,必须为1
mol物质完全燃烧,生成稳定氧化物放出的热量。答案:D
作业解答
4.燃料的燃烧都是氧化还原反应,乙醇作为燃料的优点是充分燃烧的产物不污染环境,乙醇是一种再生能源,燃烧时放出大量的热。答案:D
5.(1)同物质的量的C3H8和CO燃烧,产生的热量比值为:
(2)等质量的氢气和丙烷燃烧,产生的热量比值为:
答案:(1)7.84
(2)2.83
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
第一章
化学反应与能量
第二节
燃烧热
能源
学习目标
宏观辨识与变化观念:
理解燃烧热的定义及燃烧热的化学方程式的书写;
科学态度与社会责任:
知道能源是人类生存和社会发展的重要基础,知道使用化石燃料的利弊和新能源的开发。
1
2
新知导入
另一种形式的反应热:燃烧热
新知讲解
1.燃烧热
25
℃、101
kPa时,1
mol纯物质完全燃烧生成稳定氧化物时所放出的热量。
定义:
反应条件
燃烧物的量
反应程度
C
S
H
新知讲解
1.燃烧热
ΔH为
?
或ΔH
<
0
kJ·mol?1
符号
意义
单位
25
℃、101
kPa时甲烷的燃烧热ΔH=-890.31
kJ·mol?1,热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.31
kJ·mol-1。
说明:1
mol
甲烷完全燃烧生成CO2(g)和H2O(l)时放出890.31
kJ的热量。
新知讲解
2.能源
定义:能提供能量的资源
化石燃料
阳光
风力
水力
潮汐
柴草
新知讲解
2.能源
能源
化石燃料
煤
石油
天然气
新能源
太阳能
氢能
地热能
风能
海洋能
生物质能
蕴藏量有限、不能再生、利用率低;
污染环境,特别是造成温室效应和酸雨
资源丰富,可以再生,没有污染或很少污染
课堂练习
1.判断正误(正确的打“√”,错误的打“×”)
(1)1
mol碳在常温常压下燃烧所放出的热量为碳的燃烧热。
( )
(2)1
mol
H2完全燃烧生成1
mol气态水所放出的热量称为氢气的燃烧热。
( )
(3)化石燃料主要包括石油、煤和天然气,它们蕴藏无限,可以再生。
( )
(4)太阳能是一级能源、新能源、可再生能源。
( )
×
√
×
×
课堂练习
2.已知热化学方程式
①CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=–890
kJ·mol-1
②2H2(g)+O2(g)===2H2O(l) ΔH=–571.6
kJ·mol-1
③2CO(g)+O2(g)===2CO2(g) ΔH=–566
kJ·mol-1
则CH4、H2、CO的燃烧热分别为_____________、____________、_______________。
890
kJ·mol-1
285.8
kJ·mol-1
283
kJ·mol-1
课堂练习
3.形成节约能源和保护生态环境的产业结构是人类与自然和谐发展的重要保证,你认为下列行为中有悖于这一保证的是( )
A.开发太阳能、生物质能、风能等新能源,减少使用煤、石油等化石燃料
B.研究采煤、采油新技术,提高产量以满足工业生产的快速发展
C.在农村推广使用沼气
D.减少资源消耗、增加资源的重复使用和资源的循环再生
B
课堂练习
解析:开发太阳能、生物质能、风能等新能源,减少了煤、石油等化石燃料的使用,减少污染,保护环境,故A正确;
研究采煤、采油新技术,提高产量以满足工业生产的快速发展,化石燃料在地球上的含量是有限的,加大开采,必然带来能源的匮乏和污染物的增多,故B错误;
在农村推广使用沼气,沼气是由植物秸秆等发酵制得的,属于可再生资源,故C正确;
减少资源消耗、增加资源的重复使用和资源的循环再生,符合节约能源和保护生态环境的要求,D正确。
课堂练习
4.“能源分类相关图”如图所示,以下能源中符合图中的阴影部分的有_____________。
①煤炭 ②石油 ③潮汐能 ④生物质能 ⑤天然气 ⑥太阳能 ⑦风能 ⑧沼气 ⑨地热能 ⑩核能
④⑥⑦⑧
课堂练习
5.以下几个热化学方程式中能表示燃烧热的热化学方程式的是( )
A.C(s)+O2(g)===CO(g) ΔH=–110.5
kJ·mol–1
B.C8H18(l)+O2(g)===8CO2(g)+9H2O(l) ΔH=–5
518
kJ·mol–1
C.2H2(g)+O2(g)===2H2O(l) ΔH=–571.6
kJ·mol–1
D.H2(g)+O2(g)===H2O(g) ΔH=–241.8
kJ·mol–1
B
课堂练习
解析:
A项,C(s)燃烧未生成稳定氧化物CO2(g),故其反应热不能叫燃烧热;
B项,符合燃烧热的定义;
C项,H2虽然转变成了稳定的氧化物H2O(l),但由于其反应热表示的是2
mol
H2完全燃烧时的热量变化,故不是燃烧热;
D项,参加燃烧的H2虽然是1
mol,但其生成H2O(g),而不是H2O(l),故它的反应热也不是H2的燃烧热。
核心突破
可燃物的化学计量数是否为1
碳元素完全燃烧生成的氧化物是否为CO2(g)
氢元素完全燃烧生成的氧化物是否为H2O(l)
ΔH是否为“—”及单位是否正确
表示燃烧热的热化学方程式的“四点”要求:
素养养成
?
燃烧热
中和热
相同点
能量变化
放热反应
ΔH及其单位
ΔH<0,单位均为kJ·mol-1
不
同
点
反应物的量
1
mol
不一定为1
mol
生成物的量
不确定
生成水的量为1
mol
表示方法
燃烧热为a
kJ·mol-1或ΔH=-a
kJ·mol-1
中和热为57.3
kJ·mol-1或
ΔH=-57.3
kJ·mol-1
课堂总结
作业布置
1.有专家指出,如果对燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合,从而能够实现如图所示转化,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为( )
A.热能
B.化学能
C.生物质能
D.电能
作业布置
2.已知:2CO(g)+O2(g)===2CO2(g) ΔH=–566
kJ·mol–1,下列说法正确的是
( )
A.CO的燃烧热为–283
kJ·mol–1
B.CO的燃烧热为566
kJ·mol–1
C.CO的燃烧热ΔH=–283
kJ·mol–1
D.如图可表示由CO生成CO2的反应过程和能量关系
作业布置
3.对于2C4H10(g)+13O2(g)===8CO2(g)+10H2O(l);ΔH=-5
800
kJ·mol-1的叙述中不正确的是( )
A.该反应的反应热为ΔH=-5
800
kJ·mol-1,是放热反应
B.该反应的ΔH与各物质的状态有关,与化学计量数也有关
C.该式的含义为:25
℃、101
kPa下,2
mol
C4H10气体完全燃烧生成CO2和液态水时放出热量5
800
kJ
D.该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5
800
kJ·mol-1
作业布置
4.下列选项中说明乙醇作为燃料的优点的是( )
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境 ③乙醇是一种再生能源 ④燃烧时放出大量的热
A.①②③
B.①②④
C.①③④
D.②③④
作业布置
5.(1)液化石油气的主要成分是丙烷,其燃烧的热化学方程式为:C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-2
219.9
kJ·mol-1
已知CO气体燃烧的热化学方程式为:
CO(g)+1/2O2(g)===CO2(g) ΔH=-283
kJ·mol-1
试比较同物质的量的C3H8和CO燃烧,产生的热量比值约为_____。
(2)已知氢气燃烧的热化学方程式为:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6
kJ·mol-1
比较同质量的氢气和丙烷燃烧,产生的热量比值约为________。
作业解答
1.题中关键信息是利用太阳能使CO2、H2O、N2重新组合,由图可知组合成燃料,燃料燃烧后转化为燃烧产物并放出热量,燃烧产物又结合太阳能转化为燃料,如此循环太阳能最终转化为热能。答案:A
2.CO的燃烧热为283
kJ·mol-1,D图中的量标示错误。答案:C
3.D项考查燃烧热的概念,必须为1
mol物质完全燃烧,生成稳定氧化物放出的热量。答案:D
作业解答
4.燃料的燃烧都是氧化还原反应,乙醇作为燃料的优点是充分燃烧的产物不污染环境,乙醇是一种再生能源,燃烧时放出大量的热。答案:D
5.(1)同物质的量的C3H8和CO燃烧,产生的热量比值为:
(2)等质量的氢气和丙烷燃烧,产生的热量比值为:
答案:(1)7.84
(2)2.83
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
