碳的多样性
图片预览








文档简介
(共27张PPT)
美丽的珊瑚
溶洞中的 石花、石笋、钟乳
金刚石晶体
石墨
C60分子
金刚石晶体结构模型
石墨晶体结构模型
C60分子模型
一、多种多样的碳单质
(一)、同素异形体
1、概念:由同一种元素组成的性质不同的几种单质,叫做该元素的同素异形体。
2、常见的同素异形体:
碳:金刚石、石墨、C60;
氧:氧气、臭氧(O3)。
3、化学性质相似,物理性质差别很大。
(一)、同素异形体
1、概念:由同一种元素组成的性质不同的几种单质,叫做该元素的同素异形体。
2、常见的同素异形体:
碳:金刚石、石墨、C60;
氧:氧气、臭氧(O3)。
3、化学性质相似,物理性质差别很大。
(二)、金刚石、石墨、C60
1、结构
①金刚石:每个碳原子与另外4个碳原子以一种较强的相互作用相连接,形成正四面体结构,向空间伸展形成空间网状结构。
②石墨:石墨晶体是层状结构。在同一层内,碳原子排列成正六边形(碳原子位于正六边形的顶点上),一个个正六边形排列成平面网状结构,每一个碳原子都跟其他3个碳原子相连。在同一层内,相邻的碳原子以较强的相互作用相结合,但层与层之间以一种较弱的相互作用相结合。
③C60:C60分子是由60个碳原子构成的,它的形状像足球,
由12个正五边形和20个正六边形组成。分子内部,碳原子间以较强的相互作用结合,但分子间的相互作用较弱。
2、性质
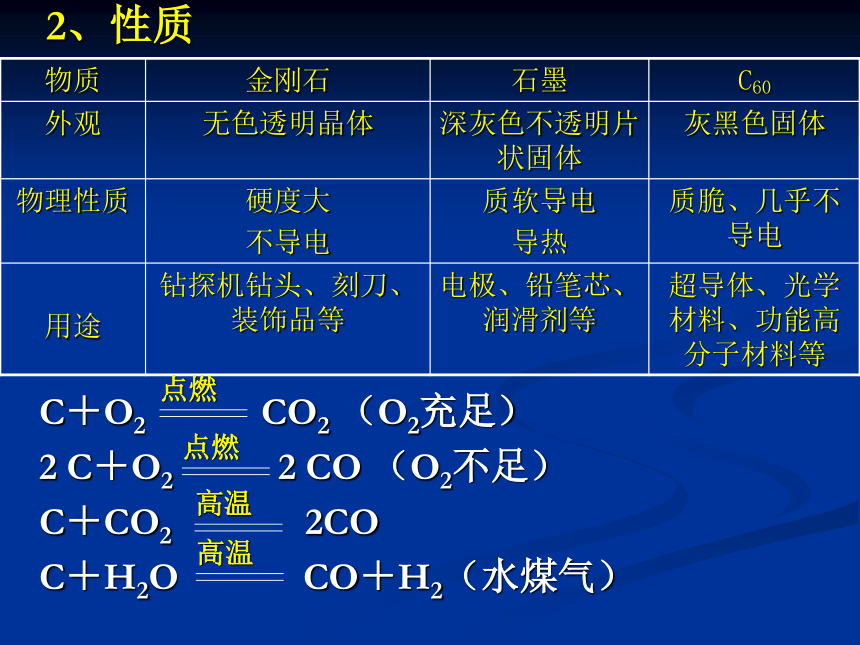
C+O2 CO2 (O2充足)
2 C+O2 2 CO (O2不足)
C+CO2 2CO
C+H2O CO+H2(水煤气)
物质 金刚石 石墨 C60
外观 无色透明晶体 深灰色不透明片状固体 灰黑色固体
物理性质 硬度大
不导电 质软导电
导热 质脆、几乎不导电
用途 钻探机钻头、刻刀、装饰品等 电极、铅笔芯、润滑剂等 超导体、光学材料、功能高分子材料等
点燃
点燃
高温
高温
思考?
如何证明石墨、金刚石都是由碳元素组成?
1797年英国化学家钱南为了测出金刚石的成分,做了一个非常昂贵的实验。他将金刚石放在密闭的、充满氧气的箱子里进行燃烧(箱子是纯金制的),结果却令人非常意外—箱子里的气体成分竟然是CO2 。
大理石
方解石
白云石
菱锌矿
菱镁矿
菱铁矿
二、广泛存在的含碳化合物
二、广泛存在的含碳化合物
(一)、氧化物:CO、CO2
CO:主要表现为还原性:
CO2:1、常用作灭火剂;
2、也可作氧化剂:
2Mg+CO2 2MgO+C(生成黑色和白色两种固体)
3、酸性氧化物,可与碱或碱性氧化物反应
CO2+CaO CaCO3
CO2+2NaOH Na2CO3+H2O (CO2少量)
CO2+ NaOH NaHCO3 (CO2过量)
3CO+Fe2O3 3 CO2+ 2 Fe
△
点燃
名 称 碳酸钠 碳酸氢钠
俗 名
色 态
水溶性
白色粉末
苏 打
小苏打
都易溶于水 但溶解度S碳酸钠>S碳酸氢钠
白色晶体
研究Na2CO3和NaHCO3的性质
第一步:观察Na2CO3和NaHCO3的外观性质
二、广泛存在的含碳化合物
(二)、碳酸钠和碳酸氢钠
第二步
预测Na2CO3和NaHCO3的性质
盐的性质:
1、盐与金属的反应 2、盐与酸的反应
3、盐与碱的反应 4、盐与盐的反应
思考:碳酸钠与碳酸氢钠分别属于哪类物质?预测它们可能与哪些物质反应?
第三步
实验和观察
讨论并设计实验方案:
实验药品:碳酸钠、碳酸氢钠、盐酸、Ba(OH)2溶液、CaCl2溶液、NaOH溶液。
碳酸钠、碳酸氢钠的热稳定性
碳酸钠、碳酸氢钠与盐酸反应
碳酸钠
(纯碱、苏打)Na2CO3
碳酸氢钠
(小苏打)NaHCO3
物 理
性 质
与 酸
反 应
与 碱
反 应
与CaCl2反应
与CO2、H2O反应
热 稳
定 性
白色粉末
白色细小晶体
Ca2++CO32-=CaCO3↓
不反应
CO32-+H2O+CO2=2HCO3-
不反应
H++HCO3- =H2O+CO2↑
2H++CO32- =H2O+CO2 ↑
OH-+HCO3-=H2O+CO32-
Ba2++OH-+HCO3=BaCO3↓+H2O
与OH-不反应
第四步:解释及结论
稳定
2NaHCO3==Na2CO3+H2O+CO2↑
△
1、如何鉴别Na2CO3与NaHCO3 ?
2、如何除去Na2CO3中少量的NaHCO3?
3、如何除去NaHCO3中少量的Na2CO3?
溶液:加CaCl2溶液;固体:加热
溶液:加适量NaOH溶液;固体:加热
通入过量的CO2气体
思考?
H+、CO2+H2O
OH-、△
碳酸盐
碳酸氢盐
Na2CO3与NaHCO3的相互转变
⒈ Na2CO3转变成 NaHCO3
⒉ NaHCO3转变成Na2CO3
Na2CO3+CO2+H2O = 2NaHCO3
NaHCO3+NaOH = Na2CO3+H2O
2NaHCO3==Na2CO3+CO2↑+H2O
△
思考?
三、碳及其化合物间的转化
(一)、自然界中碳及其化合物的转化
三、碳及其化合物间的转化
(一)、自然界中碳及其化合物的转化
自然界在永不停息的进行着碳的转化,这种转化形式多种多样,速度也有快有慢,总体上处于平衡状态。但是,由于现代化工业社会过多燃烧煤炭、石油和天然气,这些燃料燃烧后放出大量的二氧化碳气体进入大气,破坏了这种平衡,造成了“温室效应”。
三、碳及其化合物间的转化
(二)、生产和生活中碳及其化合物间的转化
1、高炉炼铁
原料:焦炭、铁矿石;
高炉煤气的主要成分:CO、CO2、Fe2O3、N2等;
CO的生成: C+O2 CO2; C+ CO2 2CO
还原铁的氧化物:Fe2O3 +3CO2 Fe +3CO2
点燃
高温
高温
三、碳及其化合物间的转化
(二)、生产和生活中碳及其化合物间的转化
2、木炭燃烧:
3、水垢的形成:
Ca(HCO3)2 CaCO3 ↓+CO2↑+H2O
思考:如何除去水壶中的水垢?加入醋酸,可以将CaCO3物质等溶解。
4、无机化合物与有机化合物间的转化
1828年,德国化学家维勒用无机物氰酸铵合成出有机化合物——尿素,打破了无机物和有机物之间的界限。碳及其化合物的转化,对人的生活、生产来说意义重大。
概
*
括
整
合
碳的化合物的多样性
碳单质的多样性
碳元素转化的多样性
碳的多样性
金刚石、石墨、C60
碳酸钠、碳酸氢钠的性质及转化
碳单质、一氧化碳、二氧化碳、碳酸盐、碳酸氢盐之间的转化
1、金刚石、石墨、C60性质有所不同,是由于
A.构成原子不同 B.原子的各自排列方式不同
C.硬度不同 D.具有不同的几何外形
2、现有25mL 2mol/L的Na2CO3 溶液和75mL 1mol/L的稀盐酸,①将Na2CO3溶液缓缓滴加到盐酸中
②将稀盐酸缓缓滴加到Na2CO3溶液中,在标准状况下产生的气体情况是
A. 均为0.84L B. 均为0.56L C. ①>② D. ①<②
3、向碳酸钠的浓溶液中逐滴加入稀盐酸直到不再产生二氧化碳气体为止,则在此过程中,溶液的碳酸氢根离子浓度变化趋势可能是:
A.逐渐减小 B.逐渐增大
C.先逐渐增大,而后减小 D.先逐渐减小而后增大
例题与练习
4、将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系正确的是
5、若将标准状况下2.24 L二氧化碳通入400 mL 0.3 mol·L-1的氢氧化钾溶液中,生成何种物质?其物质的量分别是多少??
6、从某悬浊液开始,可以发生如下框图所示的一系列变化
回答下面问题:
(1)操作①的名称是__________。在操作①中所使用的玻璃仪器的名称是__________。
(2)写出反应②和反应③的化学方程式:反应②:_________。反应③:_____________。
(3)在实验室中,如果获得干燥纯净的气体A,可以将它通过如下图中的装置,其中瓶Ⅰ中盛放的试剂是__________。瓶Ⅱ中盛放的试剂是______。收集干燥气体A的方法是_________。
美丽的珊瑚
溶洞中的 石花、石笋、钟乳
金刚石晶体
石墨
C60分子
金刚石晶体结构模型
石墨晶体结构模型
C60分子模型
一、多种多样的碳单质
(一)、同素异形体
1、概念:由同一种元素组成的性质不同的几种单质,叫做该元素的同素异形体。
2、常见的同素异形体:
碳:金刚石、石墨、C60;
氧:氧气、臭氧(O3)。
3、化学性质相似,物理性质差别很大。
(一)、同素异形体
1、概念:由同一种元素组成的性质不同的几种单质,叫做该元素的同素异形体。
2、常见的同素异形体:
碳:金刚石、石墨、C60;
氧:氧气、臭氧(O3)。
3、化学性质相似,物理性质差别很大。
(二)、金刚石、石墨、C60
1、结构
①金刚石:每个碳原子与另外4个碳原子以一种较强的相互作用相连接,形成正四面体结构,向空间伸展形成空间网状结构。
②石墨:石墨晶体是层状结构。在同一层内,碳原子排列成正六边形(碳原子位于正六边形的顶点上),一个个正六边形排列成平面网状结构,每一个碳原子都跟其他3个碳原子相连。在同一层内,相邻的碳原子以较强的相互作用相结合,但层与层之间以一种较弱的相互作用相结合。
③C60:C60分子是由60个碳原子构成的,它的形状像足球,
由12个正五边形和20个正六边形组成。分子内部,碳原子间以较强的相互作用结合,但分子间的相互作用较弱。
2、性质
C+O2 CO2 (O2充足)
2 C+O2 2 CO (O2不足)
C+CO2 2CO
C+H2O CO+H2(水煤气)
物质 金刚石 石墨 C60
外观 无色透明晶体 深灰色不透明片状固体 灰黑色固体
物理性质 硬度大
不导电 质软导电
导热 质脆、几乎不导电
用途 钻探机钻头、刻刀、装饰品等 电极、铅笔芯、润滑剂等 超导体、光学材料、功能高分子材料等
点燃
点燃
高温
高温
思考?
如何证明石墨、金刚石都是由碳元素组成?
1797年英国化学家钱南为了测出金刚石的成分,做了一个非常昂贵的实验。他将金刚石放在密闭的、充满氧气的箱子里进行燃烧(箱子是纯金制的),结果却令人非常意外—箱子里的气体成分竟然是CO2 。
大理石
方解石
白云石
菱锌矿
菱镁矿
菱铁矿
二、广泛存在的含碳化合物
二、广泛存在的含碳化合物
(一)、氧化物:CO、CO2
CO:主要表现为还原性:
CO2:1、常用作灭火剂;
2、也可作氧化剂:
2Mg+CO2 2MgO+C(生成黑色和白色两种固体)
3、酸性氧化物,可与碱或碱性氧化物反应
CO2+CaO CaCO3
CO2+2NaOH Na2CO3+H2O (CO2少量)
CO2+ NaOH NaHCO3 (CO2过量)
3CO+Fe2O3 3 CO2+ 2 Fe
△
点燃
名 称 碳酸钠 碳酸氢钠
俗 名
色 态
水溶性
白色粉末
苏 打
小苏打
都易溶于水 但溶解度S碳酸钠>S碳酸氢钠
白色晶体
研究Na2CO3和NaHCO3的性质
第一步:观察Na2CO3和NaHCO3的外观性质
二、广泛存在的含碳化合物
(二)、碳酸钠和碳酸氢钠
第二步
预测Na2CO3和NaHCO3的性质
盐的性质:
1、盐与金属的反应 2、盐与酸的反应
3、盐与碱的反应 4、盐与盐的反应
思考:碳酸钠与碳酸氢钠分别属于哪类物质?预测它们可能与哪些物质反应?
第三步
实验和观察
讨论并设计实验方案:
实验药品:碳酸钠、碳酸氢钠、盐酸、Ba(OH)2溶液、CaCl2溶液、NaOH溶液。
碳酸钠、碳酸氢钠的热稳定性
碳酸钠、碳酸氢钠与盐酸反应
碳酸钠
(纯碱、苏打)Na2CO3
碳酸氢钠
(小苏打)NaHCO3
物 理
性 质
与 酸
反 应
与 碱
反 应
与CaCl2反应
与CO2、H2O反应
热 稳
定 性
白色粉末
白色细小晶体
Ca2++CO32-=CaCO3↓
不反应
CO32-+H2O+CO2=2HCO3-
不反应
H++HCO3- =H2O+CO2↑
2H++CO32- =H2O+CO2 ↑
OH-+HCO3-=H2O+CO32-
Ba2++OH-+HCO3=BaCO3↓+H2O
与OH-不反应
第四步:解释及结论
稳定
2NaHCO3==Na2CO3+H2O+CO2↑
△
1、如何鉴别Na2CO3与NaHCO3 ?
2、如何除去Na2CO3中少量的NaHCO3?
3、如何除去NaHCO3中少量的Na2CO3?
溶液:加CaCl2溶液;固体:加热
溶液:加适量NaOH溶液;固体:加热
通入过量的CO2气体
思考?
H+、CO2+H2O
OH-、△
碳酸盐
碳酸氢盐
Na2CO3与NaHCO3的相互转变
⒈ Na2CO3转变成 NaHCO3
⒉ NaHCO3转变成Na2CO3
Na2CO3+CO2+H2O = 2NaHCO3
NaHCO3+NaOH = Na2CO3+H2O
2NaHCO3==Na2CO3+CO2↑+H2O
△
思考?
三、碳及其化合物间的转化
(一)、自然界中碳及其化合物的转化
三、碳及其化合物间的转化
(一)、自然界中碳及其化合物的转化
自然界在永不停息的进行着碳的转化,这种转化形式多种多样,速度也有快有慢,总体上处于平衡状态。但是,由于现代化工业社会过多燃烧煤炭、石油和天然气,这些燃料燃烧后放出大量的二氧化碳气体进入大气,破坏了这种平衡,造成了“温室效应”。
三、碳及其化合物间的转化
(二)、生产和生活中碳及其化合物间的转化
1、高炉炼铁
原料:焦炭、铁矿石;
高炉煤气的主要成分:CO、CO2、Fe2O3、N2等;
CO的生成: C+O2 CO2; C+ CO2 2CO
还原铁的氧化物:Fe2O3 +3CO2 Fe +3CO2
点燃
高温
高温
三、碳及其化合物间的转化
(二)、生产和生活中碳及其化合物间的转化
2、木炭燃烧:
3、水垢的形成:
Ca(HCO3)2 CaCO3 ↓+CO2↑+H2O
思考:如何除去水壶中的水垢?加入醋酸,可以将CaCO3物质等溶解。
4、无机化合物与有机化合物间的转化
1828年,德国化学家维勒用无机物氰酸铵合成出有机化合物——尿素,打破了无机物和有机物之间的界限。碳及其化合物的转化,对人的生活、生产来说意义重大。
概
*
括
整
合
碳的化合物的多样性
碳单质的多样性
碳元素转化的多样性
碳的多样性
金刚石、石墨、C60
碳酸钠、碳酸氢钠的性质及转化
碳单质、一氧化碳、二氧化碳、碳酸盐、碳酸氢盐之间的转化
1、金刚石、石墨、C60性质有所不同,是由于
A.构成原子不同 B.原子的各自排列方式不同
C.硬度不同 D.具有不同的几何外形
2、现有25mL 2mol/L的Na2CO3 溶液和75mL 1mol/L的稀盐酸,①将Na2CO3溶液缓缓滴加到盐酸中
②将稀盐酸缓缓滴加到Na2CO3溶液中,在标准状况下产生的气体情况是
A. 均为0.84L B. 均为0.56L C. ①>② D. ①<②
3、向碳酸钠的浓溶液中逐滴加入稀盐酸直到不再产生二氧化碳气体为止,则在此过程中,溶液的碳酸氢根离子浓度变化趋势可能是:
A.逐渐减小 B.逐渐增大
C.先逐渐增大,而后减小 D.先逐渐减小而后增大
例题与练习
4、将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系正确的是
5、若将标准状况下2.24 L二氧化碳通入400 mL 0.3 mol·L-1的氢氧化钾溶液中,生成何种物质?其物质的量分别是多少??
6、从某悬浊液开始,可以发生如下框图所示的一系列变化
回答下面问题:
(1)操作①的名称是__________。在操作①中所使用的玻璃仪器的名称是__________。
(2)写出反应②和反应③的化学方程式:反应②:_________。反应③:_____________。
(3)在实验室中,如果获得干燥纯净的气体A,可以将它通过如下图中的装置,其中瓶Ⅰ中盛放的试剂是__________。瓶Ⅱ中盛放的试剂是______。收集干燥气体A的方法是_________。
