硫的转化
图片预览








文档简介
(共24张PPT)
第三章 自然界中的元素
第 3 节 硫 的 转 化
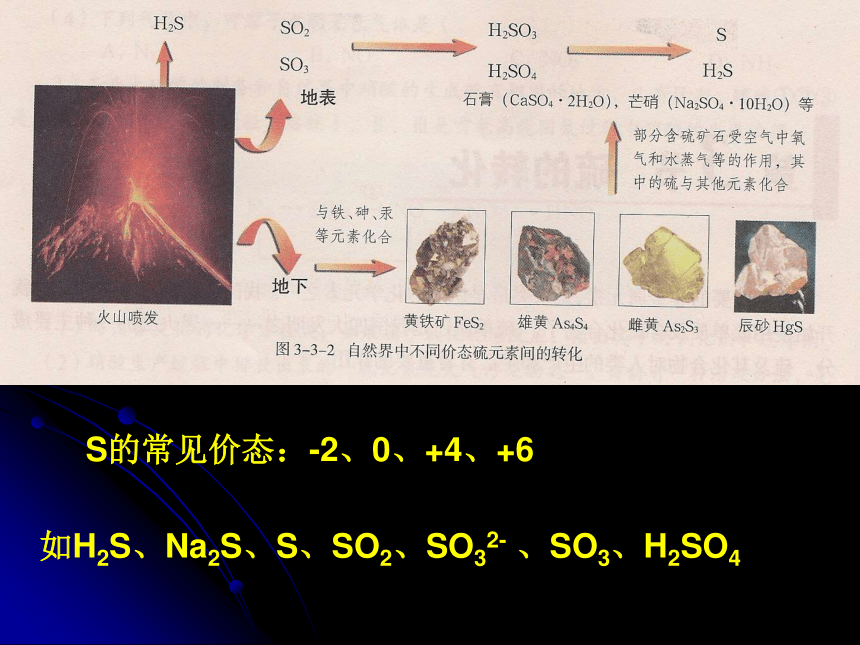
火山喷发
一、自然界中的硫:
(一)自然界中不同价态硫元素之间的转化:
1、S元素的存在:
在自然界里,硫既有游离态,又有化合态,游离态的天然硫存在于火山喷口附近或地壳的岩层里,煤中也含有少量硫。
2、硫元素的转化:(图见课本P85及P86图)
S的常见价态:-2、0、+4、+6
如H2S、Na2S、S、SO2、SO32- 、SO3、H2SO4
(二)、硫单质的性质
1、物理性质:
淡黄色或黄色固体(俗称硫黄),不溶于水,微溶于酒精,易溶于二硫化碳,熔沸点不高。
硫存在同素异形体:单斜硫、斜方硫。
2、化学性质
(1) 氧化性
Fe+S FeS (氧化性:S△
H2+S H2S
△
硫与变价金属反应,一般生成低价态金属硫化物
<练习>写出硫与铝、铜反应的化学方程式。
铁粉与S粉 的反应
(2)还原性
(3)黑火药 S+2KNO3+3C=== K2S+3CO2↑+N2↑
S+O2 SO2
点燃
(4) 3S+6NaOH === 2Na2S+Na2SO3+3H2O
3、硫黄的用途:(课本P87)
主要用于制造硫酸、化肥、火柴及杀虫剂等,还用于制造火药、烟花爆竹等。
2Ag + S = Ag2S 常温下进行,用于检验银器的真假 此外硫化汞还要用作红色颜料(朱砂),在书面上盖的印章,所用的红色印泥就是用朱砂做的。
S的特殊性质——与Hg、Ag 的反应
Hg + S = HgS 常温下进行,且Hg显高价。 用于除Hg
二、SO2:
1、物理性质: SO2是无色、有刺激性气味的有毒气体,密度比空气大,易溶于水。有毒。
2、化学性质
(1)SO2是酸性氧化物,具有酸性氧化物的一切通性:
(2)氧化性:SO2+2H2S=3S↓+2H2O
器壁出现黄色固体。(气体或溶液中均可进行)
与水反应:
SO2+H2O H2SO3
与CO2非常相似。如与NaOH、澄清石灰水的反应
(3)还原性:
能被Cl2、Br2、I2、Fe3+、KMnO4、HNO3等强氧化剂氧化生成SO42-。
例如:SO2+X2+2H2O=H2SO4+2HX (X=Cl、Br、I)
(4)漂白性:
SO2可以使品红溶液褪色(实验)
注意:SO2能使氯水、KMnO4溶液等褪色,这是因为SO2具有还原性的缘故。
2SO2+O2 2SO3
催化剂
高温
深入探讨:
1、SO2和Cl2都具有漂白性,将两者 1:1 通入品红溶液,漂白效果会如何?
2、将SO2和Cl2分别通入紫色石蕊试液中,现象会如何?
将SO2和通入紫色石蕊试液中,溶液会变红; 将Cl2通入紫色石蕊试液中,溶液先变红,后褪色。
注意:SO2具有漂白性,但不能漂白酸碱指示剂。
【辨析·比较】
氯气、二氧化硫、活性炭漂白原理的比较
1、Cl2的漂白性主要是因为它溶于水生成了HClO。HClO有很强的氧化性,可将有色物质氧化成稳定的无色物质。这种氧化作用非常迅速,由于色素的结构被破坏。 因此,Cl2的漂白作用为永久性漂白,不可复原。 Cl2可漂白棉、麻、纸张,不可漂白丝和毛。
2、SO2的漂白作用是SO2溶于水生成了亚硫酸。亚硫酸跟有色物质结合生成一种无色的不稳定的化合物。这种作用较慢,且生成物不稳定,加热时,会有SO2分解出来,溶液又会恢复成原来的颜色。 因此,SO2的漂白作用是不能持久的。 SO2可漂白棉、麻、纸张及丝和毛等。 活性炭的漂白为物理性吸附,属物理变化。
【深度拓展】
比较CO2和SO2的性质(金版新学案P46)
1、物理性质? 相同点:常温下,都是无色气体,密度都大于水。 不同点: CO2没有气味,SO2有刺激性气味; CO2无毒,SO2有毒; CO2能溶于水(1:1),SO2易溶于水(1:40); SO2易液化。
2、化学性质 相同点:都是酸性氧化物 ①都能和水反应,生成的酸H2SO3和H2CO3不稳定,只能存在于溶液中。 ②都能与碱反应,用量比不同,可以生成两种盐。 SO2、CO2气体通入澄清石灰水中,都是先生成沉淀,当SO2、CO2过量时又溶解。
2、化学性质 不同点: ①SO2常表现还原性,CO2表现氧化性: SO2能被 KMnO4、氯水、溴水、碘水等氧化剂氧化,CO2不能。 ②二氧化硫具有漂白性,能漂白某些有色物质,二氧化碳不能。 ③造成大气污染的原因不同: SO2形成酸雨,CO2引起温室效应。
3、鉴别 ①利用二氧化硫的还原性,用高锰酸钾溶液或溴水褪色鉴别。 ②利用二氧化硫的漂白性,用品红溶液鉴别。
SO2实验室制法: Na2SO3+H2SO4(浓) Na2SO4+SO2 ↑+H2O
△
用途:制硫酸、漂白剂、消毒剂和防腐剂。
三、硫酸
(一)、物理性质: 纯硫酸为无色黏稠状液体, 密度比水大,能与水互溶,溶于水时放出大量的热。浓硫酸易吸水,常用作干燥剂。
问题探讨:如何稀释浓硫酸?
(二)化学性质:
1、强酸性:
(二)化学性质:
2、特性:(重点)
(1)脱水性:将有机物中的H和O按2:1脱去形成水。(原本无水)
浓硫酸可以使蔗糖炭化
(2)浓硫酸的强氧化性:浓硫酸是强氧化性酸,可以氧化大多数金属(除Pt和Au)和其他还原性物质(H2S、Fe2+等)。
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O (氧化性)
△
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O (氧化性、酸性)
△
H2S+H2SO4(浓)=S↓+SO2↑+2H2O (氧化性,不能干燥)
注意:
1、浓硫酸表现强氧化性时,还原产物一般为SO2。
2、常温时,Al、Fe在浓硫酸中钝化。
问题探讨:
1、浓硫酸可以干燥哪些气体?不可干燥哪些气体?
可以干燥:H2、O2、HCl、Cl2、CO、CO2、SO2等。 不可干燥:NH3、H2S、HBr、HI等。
2、如何鉴别浓硫酸和稀硫酸?
3、如何检验SO42- 的存在?
取样,先加入盐酸酸化,无明显现象,再滴加BaCl2溶液,产生白色沉淀,则有SO42- 。
硫酸生产反应式
4FeS2 +11 O2 2Fe2O3 + 8SO2
高 温
SO3 + H2O H2SO4
2SO2 + O2 2SO3
催化剂
加 热
第一步:
第二步:
第三步:
(1)主要原料:硫铁矿(又称黄铁矿,主要成分是FeS2)、空气、98.3%浓硫酸。
(2) 生产原理
(三)接触法制硫酸简介
第四步:
第五步:
用98.3%的硫酸吸收三氧化硫
根据需要稀释浓硫酸
硫酸的工业生产
沸 腾 炉
接 触 室
吸 收 塔
净化
冷 却
四、酸雨及其防治
1.酸雨的形成
2.危害:酸雨危害很大,能直接破坏森林、草原和农作物。使土壤酸性增强。使湖泊酸化。还会加速建筑物、桥梁、工业设备等的腐蚀。
2SO2+O2
2SO3 SO3+H2O=H2SO4
粉尘等催化
SO2+H2O H2SO3
2H2SO3+O2=2H2SO4 (酸性增强)
3.酸雨的防治 (1)对酸性物质的排放加以控制。 (2)开发清洁能源
考 点 分 析:
1、 SO2被认为是造成大气污染的“首犯”,大气中的SO2主要来源于化石燃料(煤、石油)的燃烧。下列与SO2污染有关的是
①酸雨现象 ②伦敦“毒雾事件” ③洛杉矶“光化学烟雾”事件 ④温室效应
A.①③ B.②④ C.①② D.③④
题型一、环境保护
2、下列做法中.不会造成大气污染的是
A.燃烧含硫的煤 B.焚烧树叶
C.燃烧氢气 D.燃放烟花爆竹
3、常见的污染物分为一次污染物和二次污染物。二次污染物是排入环境中的一次污染物在物理化学因素或微生物作用下,发生变化所生成的新污染物。如反应2NO+O2=2NO2中,二氧化氮为二次污染物。下列3种气体:①硫化氢 ②二氧化硫 ③汽油,其中能生成二次污染物的是
A.①② B.②③ C.①③ D.全部都是
题型二、物质的分离提纯
4、在二氧化碳中混有少量的二氧化硫、三氧化硫、氯化氢杂质。设计一种一步只除去一种杂质,最后得到干燥纯净二氧化碳的实验方案。试回答:
(1)使气体经过各试剂(自选)的顺序为____________;
(2)写出有关的离子方程式:______________。
5、将含有amolNa2SO3的溶液跟含有bmolNa2S的溶液混合后无明显现象。若再加入稀H2SO4,则立即出现浅黄色硫沉淀。有关叙述不正确的是
A.若a∶b>1∶2,生成S和SO2
B.若a∶b=1∶2,生成S而无SO2
C.若a∶b<1∶2,生成S和H2S
D.若a∶b≤1∶3,生成S、SO2、H2S
题型三、有关硫及其化合物相互转化的计算
6、向50mL18mol/L的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量
A.等于0.9mol B.大于0.45mol、小于0.9mol
C.等于0.45mol D.小于0.45mol
7、某课外小组利用下图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________溶液;加热时溶液由红色逐渐变浅的原因是___________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________溶液,加热时溶液由无色变为红色的原因是_______________________。
题型四:综合
第三章 自然界中的元素
第 3 节 硫 的 转 化
火山喷发
一、自然界中的硫:
(一)自然界中不同价态硫元素之间的转化:
1、S元素的存在:
在自然界里,硫既有游离态,又有化合态,游离态的天然硫存在于火山喷口附近或地壳的岩层里,煤中也含有少量硫。
2、硫元素的转化:(图见课本P85及P86图)
S的常见价态:-2、0、+4、+6
如H2S、Na2S、S、SO2、SO32- 、SO3、H2SO4
(二)、硫单质的性质
1、物理性质:
淡黄色或黄色固体(俗称硫黄),不溶于水,微溶于酒精,易溶于二硫化碳,熔沸点不高。
硫存在同素异形体:单斜硫、斜方硫。
2、化学性质
(1) 氧化性
Fe+S FeS (氧化性:S
H2+S H2S
△
硫与变价金属反应,一般生成低价态金属硫化物
<练习>写出硫与铝、铜反应的化学方程式。
铁粉与S粉 的反应
(2)还原性
(3)黑火药 S+2KNO3+3C=== K2S+3CO2↑+N2↑
S+O2 SO2
点燃
(4) 3S+6NaOH === 2Na2S+Na2SO3+3H2O
3、硫黄的用途:(课本P87)
主要用于制造硫酸、化肥、火柴及杀虫剂等,还用于制造火药、烟花爆竹等。
2Ag + S = Ag2S 常温下进行,用于检验银器的真假 此外硫化汞还要用作红色颜料(朱砂),在书面上盖的印章,所用的红色印泥就是用朱砂做的。
S的特殊性质——与Hg、Ag 的反应
Hg + S = HgS 常温下进行,且Hg显高价。 用于除Hg
二、SO2:
1、物理性质: SO2是无色、有刺激性气味的有毒气体,密度比空气大,易溶于水。有毒。
2、化学性质
(1)SO2是酸性氧化物,具有酸性氧化物的一切通性:
(2)氧化性:SO2+2H2S=3S↓+2H2O
器壁出现黄色固体。(气体或溶液中均可进行)
与水反应:
SO2+H2O H2SO3
与CO2非常相似。如与NaOH、澄清石灰水的反应
(3)还原性:
能被Cl2、Br2、I2、Fe3+、KMnO4、HNO3等强氧化剂氧化生成SO42-。
例如:SO2+X2+2H2O=H2SO4+2HX (X=Cl、Br、I)
(4)漂白性:
SO2可以使品红溶液褪色(实验)
注意:SO2能使氯水、KMnO4溶液等褪色,这是因为SO2具有还原性的缘故。
2SO2+O2 2SO3
催化剂
高温
深入探讨:
1、SO2和Cl2都具有漂白性,将两者 1:1 通入品红溶液,漂白效果会如何?
2、将SO2和Cl2分别通入紫色石蕊试液中,现象会如何?
将SO2和通入紫色石蕊试液中,溶液会变红; 将Cl2通入紫色石蕊试液中,溶液先变红,后褪色。
注意:SO2具有漂白性,但不能漂白酸碱指示剂。
【辨析·比较】
氯气、二氧化硫、活性炭漂白原理的比较
1、Cl2的漂白性主要是因为它溶于水生成了HClO。HClO有很强的氧化性,可将有色物质氧化成稳定的无色物质。这种氧化作用非常迅速,由于色素的结构被破坏。 因此,Cl2的漂白作用为永久性漂白,不可复原。 Cl2可漂白棉、麻、纸张,不可漂白丝和毛。
2、SO2的漂白作用是SO2溶于水生成了亚硫酸。亚硫酸跟有色物质结合生成一种无色的不稳定的化合物。这种作用较慢,且生成物不稳定,加热时,会有SO2分解出来,溶液又会恢复成原来的颜色。 因此,SO2的漂白作用是不能持久的。 SO2可漂白棉、麻、纸张及丝和毛等。 活性炭的漂白为物理性吸附,属物理变化。
【深度拓展】
比较CO2和SO2的性质(金版新学案P46)
1、物理性质? 相同点:常温下,都是无色气体,密度都大于水。 不同点: CO2没有气味,SO2有刺激性气味; CO2无毒,SO2有毒; CO2能溶于水(1:1),SO2易溶于水(1:40); SO2易液化。
2、化学性质 相同点:都是酸性氧化物 ①都能和水反应,生成的酸H2SO3和H2CO3不稳定,只能存在于溶液中。 ②都能与碱反应,用量比不同,可以生成两种盐。 SO2、CO2气体通入澄清石灰水中,都是先生成沉淀,当SO2、CO2过量时又溶解。
2、化学性质 不同点: ①SO2常表现还原性,CO2表现氧化性: SO2能被 KMnO4、氯水、溴水、碘水等氧化剂氧化,CO2不能。 ②二氧化硫具有漂白性,能漂白某些有色物质,二氧化碳不能。 ③造成大气污染的原因不同: SO2形成酸雨,CO2引起温室效应。
3、鉴别 ①利用二氧化硫的还原性,用高锰酸钾溶液或溴水褪色鉴别。 ②利用二氧化硫的漂白性,用品红溶液鉴别。
SO2实验室制法: Na2SO3+H2SO4(浓) Na2SO4+SO2 ↑+H2O
△
用途:制硫酸、漂白剂、消毒剂和防腐剂。
三、硫酸
(一)、物理性质: 纯硫酸为无色黏稠状液体, 密度比水大,能与水互溶,溶于水时放出大量的热。浓硫酸易吸水,常用作干燥剂。
问题探讨:如何稀释浓硫酸?
(二)化学性质:
1、强酸性:
(二)化学性质:
2、特性:(重点)
(1)脱水性:将有机物中的H和O按2:1脱去形成水。(原本无水)
浓硫酸可以使蔗糖炭化
(2)浓硫酸的强氧化性:浓硫酸是强氧化性酸,可以氧化大多数金属(除Pt和Au)和其他还原性物质(H2S、Fe2+等)。
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O (氧化性)
△
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O (氧化性、酸性)
△
H2S+H2SO4(浓)=S↓+SO2↑+2H2O (氧化性,不能干燥)
注意:
1、浓硫酸表现强氧化性时,还原产物一般为SO2。
2、常温时,Al、Fe在浓硫酸中钝化。
问题探讨:
1、浓硫酸可以干燥哪些气体?不可干燥哪些气体?
可以干燥:H2、O2、HCl、Cl2、CO、CO2、SO2等。 不可干燥:NH3、H2S、HBr、HI等。
2、如何鉴别浓硫酸和稀硫酸?
3、如何检验SO42- 的存在?
取样,先加入盐酸酸化,无明显现象,再滴加BaCl2溶液,产生白色沉淀,则有SO42- 。
硫酸生产反应式
4FeS2 +11 O2 2Fe2O3 + 8SO2
高 温
SO3 + H2O H2SO4
2SO2 + O2 2SO3
催化剂
加 热
第一步:
第二步:
第三步:
(1)主要原料:硫铁矿(又称黄铁矿,主要成分是FeS2)、空气、98.3%浓硫酸。
(2) 生产原理
(三)接触法制硫酸简介
第四步:
第五步:
用98.3%的硫酸吸收三氧化硫
根据需要稀释浓硫酸
硫酸的工业生产
沸 腾 炉
接 触 室
吸 收 塔
净化
冷 却
四、酸雨及其防治
1.酸雨的形成
2.危害:酸雨危害很大,能直接破坏森林、草原和农作物。使土壤酸性增强。使湖泊酸化。还会加速建筑物、桥梁、工业设备等的腐蚀。
2SO2+O2
2SO3 SO3+H2O=H2SO4
粉尘等催化
SO2+H2O H2SO3
2H2SO3+O2=2H2SO4 (酸性增强)
3.酸雨的防治 (1)对酸性物质的排放加以控制。 (2)开发清洁能源
考 点 分 析:
1、 SO2被认为是造成大气污染的“首犯”,大气中的SO2主要来源于化石燃料(煤、石油)的燃烧。下列与SO2污染有关的是
①酸雨现象 ②伦敦“毒雾事件” ③洛杉矶“光化学烟雾”事件 ④温室效应
A.①③ B.②④ C.①② D.③④
题型一、环境保护
2、下列做法中.不会造成大气污染的是
A.燃烧含硫的煤 B.焚烧树叶
C.燃烧氢气 D.燃放烟花爆竹
3、常见的污染物分为一次污染物和二次污染物。二次污染物是排入环境中的一次污染物在物理化学因素或微生物作用下,发生变化所生成的新污染物。如反应2NO+O2=2NO2中,二氧化氮为二次污染物。下列3种气体:①硫化氢 ②二氧化硫 ③汽油,其中能生成二次污染物的是
A.①② B.②③ C.①③ D.全部都是
题型二、物质的分离提纯
4、在二氧化碳中混有少量的二氧化硫、三氧化硫、氯化氢杂质。设计一种一步只除去一种杂质,最后得到干燥纯净二氧化碳的实验方案。试回答:
(1)使气体经过各试剂(自选)的顺序为____________;
(2)写出有关的离子方程式:______________。
5、将含有amolNa2SO3的溶液跟含有bmolNa2S的溶液混合后无明显现象。若再加入稀H2SO4,则立即出现浅黄色硫沉淀。有关叙述不正确的是
A.若a∶b>1∶2,生成S和SO2
B.若a∶b=1∶2,生成S而无SO2
C.若a∶b<1∶2,生成S和H2S
D.若a∶b≤1∶3,生成S、SO2、H2S
题型三、有关硫及其化合物相互转化的计算
6、向50mL18mol/L的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量
A.等于0.9mol B.大于0.45mol、小于0.9mol
C.等于0.45mol D.小于0.45mol
7、某课外小组利用下图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________溶液;加热时溶液由红色逐渐变浅的原因是___________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________溶液,加热时溶液由无色变为红色的原因是_______________________。
题型四:综合
