氮的循环
图片预览








文档简介
(共36张PPT)
第三章 自然界中的元素
第二节 氮的循环
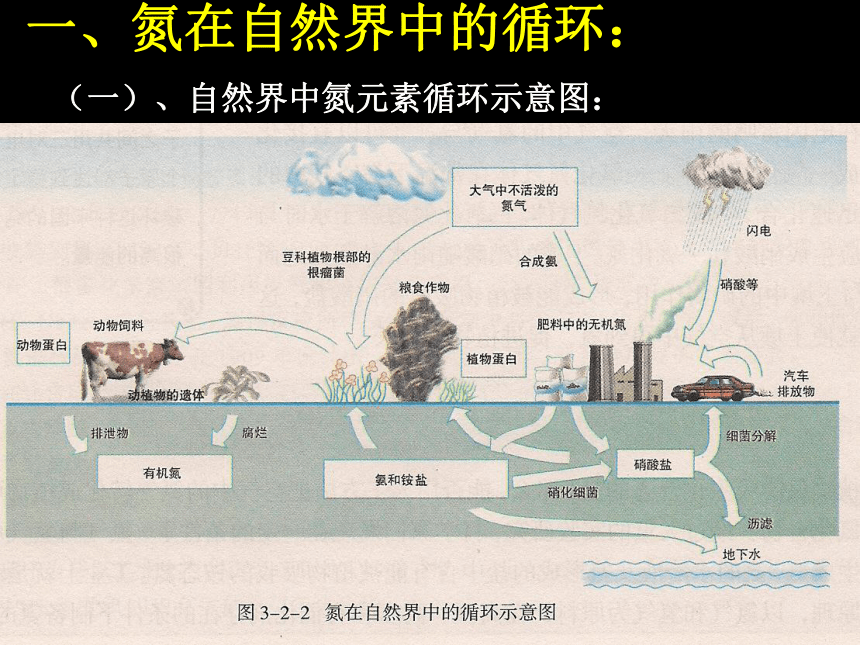
一、氮在自然界中的循环:
(一)、自然界中氮元素循环示意图:
(二)、主要形式(P74)
(1)游离态→化合态
①是豆科植物根部的根瘤菌,把N2转变为硝酸盐等含氮化合物;
②放电条件下,与O2结合为氮氧化合物,并随降水进入水体中;
③合成氨工厂、汽车发动机都可以将一部分氮气转化成化合态。
(2)化合态→游离态:硝酸盐在某些细菌作用下转化成N2。
(3)化合态→化合态:化石燃料燃烧、森林和农作物枝叶燃烧所产生的氮氧化合物通过大气进入陆地和海洋,进入氮循环。
二、氮循环中的重要物质及氮的固定:
(一)、N2
1、物理性质: 无色无味无嗅的气体,氮气占大气总量的78%(体积分数)。微溶于水。
2、化学性质:
(1)还原性:
N2+O2 2NO (有毒、无色、难溶于水)
放电
N2分子中两个氮原子共用三对电子,相互作用力强,在通常情况下,结构特别稳定,化学性质不活泼
(2)氧化性:
3Mg+N2 Mg3N2
点燃
N2+3H2 2NH3
说明: a 该反应是工业上合成氨的反应原理,具有非常重要的现实意义。N2表现出氧化性。 b 在N2跟H2反应生成氨的同时,NH3也在分解生成N2和H2。
催化剂
高温高压
在同一条件下,同时向正反两个方向进行的反应称为可逆反应。 ①同一条件 ② 在可逆反应的化学方程式中用“ ”代替“=== ”。
3、氮的固定:
使空气中游离态的氮转化为化合态的氮的方法叫做氮的固定。
氮的固定
自然固氮
人工固氮
高能固氮(闪电,约占10%)
生物固氮(约占90%)
合成氨
仿生固氮
(二)氮的氧化物:
有六种:N2O、NO、N2O3、NO2、N2O4、N2O5
1、NO、NO2
物质 NO NO2
颜色 无色 红棕色
气味 无味 刺激性气味
溶解性 不溶解 与水反应
毒性 剧毒 剧毒
转化 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
第二课时
(1) NO2或NO2与N2(非O2)的混合气体溶于水时可依据:3NO2+H2O = 2HNO3+NO利用气体体积变化差值进行计算。
(2) NO2 和 O2 的混合气体溶于水时, 由 4 NO2+ O2 +2H2O =4HNO3可知,当体积比
V(NO2):V(O2)
= 4︰1,恰好完全反应
> 4︰1,NO2过量剩余气体为NO
<4︰1, O2过量,剩余气体为O2
2、氮的氧化物溶于水的计算:
V(NO):V(O2)
=4︰3,恰好完全反应
> 4︰3,NO过量剩余气体为NO
<4︰3, O2过量,剩余气体为O2
(3)NO和O2同时通入水中,其反应是:4NO+3O2+2H2O = 4HNO3,当体积比
小结: 4NO2+O2和4NO+ 3 O2从组成上均相当于2N2O5的组成。即(2)、(3)两种情况中的总反应式都与
N2O5+ H2O === 2HNO3 等效。这不仅是记忆(2)(3)二式的方法,也为上述问题的解决提供了新的思路。即利用混合气体中N、O原子个数比进行分析判断:
N︰O
<2︰5 O2剩余
=2︰5 完全反应
>2︰5 NO剩余
2.将充满NO2和N2共45mL的试管,倒立于水槽中,过一段时间气体的体积变为35mL,则原混合气体中N2和NO2的体积比为 ( )
A、7:2 B、2:7 C、1:2 D、2:1
1、将10 mL充满NO2和O2的混合气体的试管,倒置在水槽中,反应停止后试管内剩余2mL无色气体,求原混合中NO2和O2各多少mL? (金版P40)
3、同温同压下,将NO NO2 和O2按一定体积比混合充满容器,再倒置于盛满水的水槽,片刻,液体充满容器,则反应前NO、NO2 、O2体积比可能为( )
A、1:1:1 B、8:4:7
C、4:8:5 D、任意比
D
A、B、C
6、标况下,将盛满NO、NO2、O2混合气体的集气瓶,倒置于水中,完全溶解,无气体剩余,设其产物不扩散,则所得溶液的物质的量浓度(M)的取值范围为( )
A、 0 < M < 1/22.4 B 1/39.2 < M < 1/28
C、1/28 < M < 1/22.4 D 1/39.2 < M < 1/22.4
5. 标准状况下,将盛有等体积的NO2与O2的试管,倒立于水槽中,反应后,试管内液体上升的高度大约是试管体积的几分之几?得到溶液的物质的量浓度为多少?
4. NO2装满一烧瓶,倒置于水槽中,所得溶液的物质的量浓度是多少?
B
第三课时
三、氨和铵盐
(一)、氨 NH3:
1、物理性质: 无色;有刺激性气味的气体;比空气轻; 极易溶于水(1:700)。
2、化学性质:
(1)、与水反应:喷泉实验
NH3+H2O NH3·H2O NH4++OH- (可 逆 过 程)
NH3+H2O NH3·H2O NH4++OH-
NH3是中学化学中唯一一种碱性气体,可以使湿润的红色石蕊试纸变蓝,常用于检验NH3的存在。
氨水成分:
分子:H2O、NH3、NH3·H2O 离子:H+、OH-、NH4+
辨析·比较】 液氨和氨水
氨水是混合物。 液氨是氨气加压或降温得到的液态氨,是纯净物,即液氨由氨分子组成的液体。
(2)、与酸反应:
NH3+ HCl === NH4Cl (产生白烟)(实验)
(3)、与氧气反应:
NH3+HNO3 === NH4NO3 (产生白烟)
2NH3+H2SO4=== (NH4)2SO4
4 NH3+5O2 4NO+6H2O
催化剂
高温
工业制HNO3的的重要反应
NH3
硝酸
铵盐
纯碱
有机合成工业原料
用稀氨水治疗
蚊虫叮咬
消除
二氧化氮
的污染
吸收硫酸
生产中的
二氧化硫
致冷剂
3、氨的用途
三、氨和铵盐
(二)、铵盐:
1、概念:由NH4+和酸根组成的盐。
3、化学性质:
2、白色晶体,均易溶于水。
(1)、受热易分解: NH4HCO3 NH3 ↑ +CO2 ↑ +H2O
△
NH4Cl NH3 ↑ + HCl ↑
△
生成的NH3与HCl遇冷又会结合成NH4Cl:
NH3 + HCl NH4Cl
氯化铵 受热分解
思考:上述过程与碘的升华原理一样吗?
(2)、与碱溶液反应: (实验)
NH4+ +OH-- === NH3·H2O (不加热)
保存方法:
NH4++OH- NH3 ↑+H2O
思考:如何检验NH4+的存在?
△
密封、阴凉通风处保存。
施用注意事项:
不能与碱性物质如草木灰等混用;埋在土下以保持肥效。
四、氨气的实验室制法:
1、常用药品:氯化铵和消石灰;
2、原理: 2NH4Cl(s)+Ca(OH)2(s) CaCl2 +2H2O +2NH3↑
3、装置:固+固 气 (类例制O2)
△
4、收集方法:向下排空气法 (实验)
5、验满:
(1)湿润的红色石蕊试纸(变蓝)
(2)玻璃棒蘸浓盐酸(白烟)
6、试管口棉花团作用:防止空气对流。
收集NH3后的导管口处塞一团湿棉花或用稀H2SO4浸湿的棉花,吸收多余的NH3,以防污染空气。
7、干燥:用碱石灰或生石灰。
思考:能否用浓H2SO4干燥? 能否用CaCl2干燥?
拓展:快速制氨气法:
1、加热浓氨水法:
2、向生石灰或NaOH上滴加浓氨水。
2、氯化铵和氯化钠可用下列哪一种方法分离
A.加入氢氧化钠 B.加入AgNO3溶液
C.加热法 D.加入一种合适的酸 E.加入水
例题与练习:
1、有关氨的性质的叙述正确的是( )
A.氨能在氧气中燃烧
B.氨水呈碱性
C.氨水和酸相遇都能产生白色烟雾
D.在反应NH3+H+ =NH4+中,氨失去电子被氧化
C
A、B
五、硝酸及其应用
(一)、物理性质:
纯硝酸是无色,有刺激性气味的液体。易挥发,熔沸点低,密度比水大。98%以上的浓HNO3 又叫“发烟硝酸”。(雾)
(二)、化学性质:
1、硝酸具有酸的通性 ①使指示剂变色: 例如:稀HNO3使紫色石蕊溶液变红。 ②与碱反应: 如HNO3+NaOH=NaNO3+H2O ③与碱性氧化物反应:如2HNO3+CaO=Ca(NO3)2+2H2O ④与弱酸盐反应: 如2HNO3+Na2CO3=2NaNO3+CO2↑+H2O ⑤与金属反应: 硝酸具有强氧化性,与金属反应时一般 不产生H2。
2、特性:(重点)
硝酸越浓,越容易分解。长期存放的浓HNO3呈黄色,这是由于HNO3分解产生的NO2溶于硝酸的缘故。 一般将它保存在棕色瓶里,放置在阴凉处。
Cu + 4HNO3(浓)== Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)== 3Cu(NO3)2+2NO↑+4H2O
(1)不稳定性: 4HNO3 (浓) 2H2O+4NO2↑+O2↑
光或热
(2)强氧化性: ①与金属反应——除金、铂、钛外 (实验)
Fe + 4HNO3(稀)== Fe(NO3)3+ NO↑+ 2H2O
练习与思考:
1、将以上反应改写成离子反应方程式; 2、以上反应中,HNO3表现了什么性质? 3、 HNO3还原产物有何特点? 4、浓HNO3 和稀 HNO3哪个氧化性强?为什么?
常温下,浓硝酸可使铁、铝钝化;加热时解钝。
②与某些非金属单质(如碳、硫等)反应 C+ 4HNO3(浓) CO2↑+4NO2↑+2H2O
③与其它还原性物质的反应 如:3 Fe2+ +4 H+ + NO3-=== 3Fe3+ +NO↑ +2H2O
可见:在酸性条件下,NO3-与还原性离子如S2-、I- 不能大量共存。
规律:浓硝酸一般被还原为NO2,稀硝酸一般 被还原为NO,产物与硝酸的浓度有关。
△
3 S2- +8 H+ + 2NO3-=== 3S↓ +2NO↑ +4H2O
拓展一:
王水:浓HNO3和浓盐酸的混合物(体积比1∶3)叫王水,它的氧化能力比硝酸更强,能够使一些不溶于硝酸的金属如金、铂等溶解。
拓展二:
酸的氧化性:实质上指 H+ 的氧化性,任何酸都有。
氧化性酸:是酸根离子中心原子获得电子的能力,酸根离子获得电子后,中心原子化合价降低,形成相应的低价含氧化合物甚至是单质.
六、人类活动对自然界氮循环和环境的影响
1.人类活动对自然界氮循环的影响:
2.人类活动对环境的影响:
(1)光化学烟雾: (2)酸雨: (3)富营养化:
3.如何减少人类活动对自然界中氮循环的影响 (1)控制进入大气、陆地和海洋的有害物质的数量。 (2)增强生态系统对有害物质的吸收能力。我们应保护 森林,植树造林,促进全球氮的良性循环。
七、常见考点:
1、NOx溶于水的计算:
例1:将装有50mLNO2、NO混合气体的量筒倒立于水槽中,反应后气体体积缩小为30mL,则原混合气体中NO2和NO的体积比是 A.5∶3 B.3∶5 C.3∶2 D.2∶3
例2:如图所示的装置中,烧瓶中充满了干燥气体A将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。
2、喷泉实验计算:
A(干燥气体) b(液体)
A NO2 水
B CO2 4mol/LnaOH溶液
C Cl2 饱和NaCl溶液
D NH3 1mol/L盐酸
选项______(填A、B、C、D)为何不满足要求______
练习:在标准状况下,在三个干燥的烧瓶内分别装入干燥纯净的NH3、含一半空气的氯化氢、NO2和O2的混合气体[v(NO2)∶v(O2)=4 ∶1]。然后分别做喷泉实验,三个烧瓶中所得溶液的物质的量浓度之比为
A.2∶1∶2 B.5∶5∶4 C.1∶1∶1 D.无法确定
3、离子共存:
例3、已知溶液为棕黄色, 溶液为浅绿色,向Fe(NO3)2溶液中加入少量稀盐酸时,溶液的颜色变化应该是( ) A、变浅 B、变为红色 C、没有改变 D、变为棕黄色
练习:在酸性溶液中,下列各离子因氧化还原反应而不能大量共存的是( ) A. B. C. D.
4、有关HNO3的计算:
例4、38.4 mg Cu与适量的浓HNO3反应,铜全部作用后,共收集到22.4 mL气体(标准状况下),反应消耗的HNO3其物质的量可能是( ) A.1.0×10-3 mol B.1.6×10-3 mol C.2.2×10-3 mol D.2.4×10-3 mol
例5、在100mL某混合酸中,HNO3的物质的量浓度为0.4mol·L-1,H2SO4的物质的量浓度为0.1 mol·L-1,向其中加入1.92 g铜粉,微热,待充分反应后,求溶液中的物质的量浓度。
关于HNO3计算小结: 1、与金属单质反应时HNO3表现酸性和氧化性,表现酸性的量可由金属所形成的盐计算得出,表现氧化性的量可由所产生的气体算出,不论是NO还是NO2。 2、金属与混酸的计算必须按照离子方程式计算,因为其中的不仅仅由HNO3提供。
本节小结
一、氮在自然界中的循环:
二、氮循环中的重要物质及氮的固定:
(一)、N2
(二)氮的氧化物:
1、NO、NO2
2、氮的氧化物溶于水的计算:
三、氨和铵盐
(一)、氨 NH3:
(二)、铵盐:
四、氨气的实验室制法:
五、硝酸及其应用
在新疆和青海的交界处,有一处山谷,每当牧民和牲畜进入后,风和日丽的晴天顷刻电闪雷鸣,人、畜遭雷击而毙命,奇怪的是这里牧草茂盛、四季常青,被当地人称为魔鬼谷。
最近地质工作者揭开了谜底—该地质表层处有一巨大磁铁矿,当人畜进入后形成尖端放电。
第三章 自然界中的元素
第二节 氮的循环
一、氮在自然界中的循环:
(一)、自然界中氮元素循环示意图:
(二)、主要形式(P74)
(1)游离态→化合态
①是豆科植物根部的根瘤菌,把N2转变为硝酸盐等含氮化合物;
②放电条件下,与O2结合为氮氧化合物,并随降水进入水体中;
③合成氨工厂、汽车发动机都可以将一部分氮气转化成化合态。
(2)化合态→游离态:硝酸盐在某些细菌作用下转化成N2。
(3)化合态→化合态:化石燃料燃烧、森林和农作物枝叶燃烧所产生的氮氧化合物通过大气进入陆地和海洋,进入氮循环。
二、氮循环中的重要物质及氮的固定:
(一)、N2
1、物理性质: 无色无味无嗅的气体,氮气占大气总量的78%(体积分数)。微溶于水。
2、化学性质:
(1)还原性:
N2+O2 2NO (有毒、无色、难溶于水)
放电
N2分子中两个氮原子共用三对电子,相互作用力强,在通常情况下,结构特别稳定,化学性质不活泼
(2)氧化性:
3Mg+N2 Mg3N2
点燃
N2+3H2 2NH3
说明: a 该反应是工业上合成氨的反应原理,具有非常重要的现实意义。N2表现出氧化性。 b 在N2跟H2反应生成氨的同时,NH3也在分解生成N2和H2。
催化剂
高温高压
在同一条件下,同时向正反两个方向进行的反应称为可逆反应。 ①同一条件 ② 在可逆反应的化学方程式中用“ ”代替“=== ”。
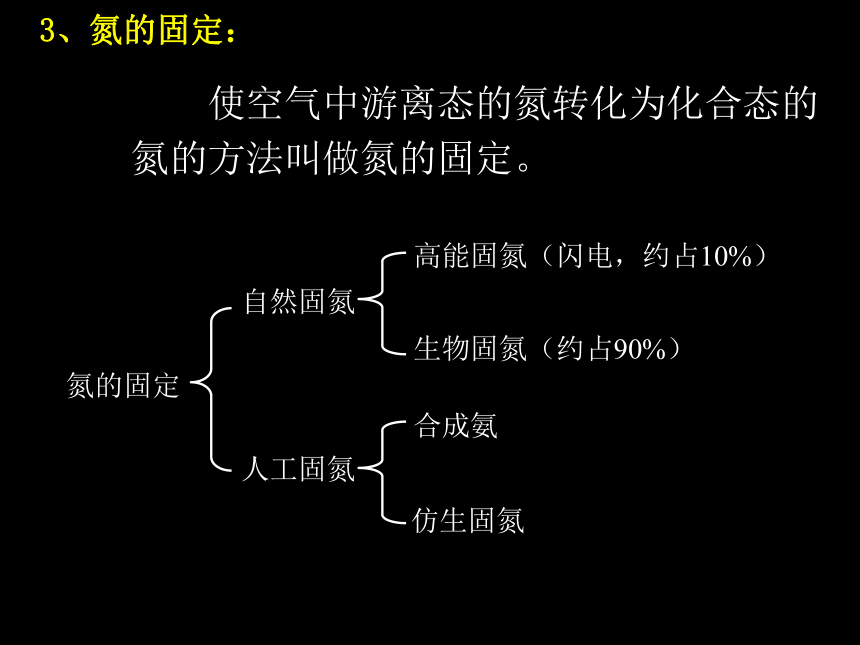
3、氮的固定:
使空气中游离态的氮转化为化合态的氮的方法叫做氮的固定。
氮的固定
自然固氮
人工固氮
高能固氮(闪电,约占10%)
生物固氮(约占90%)
合成氨
仿生固氮
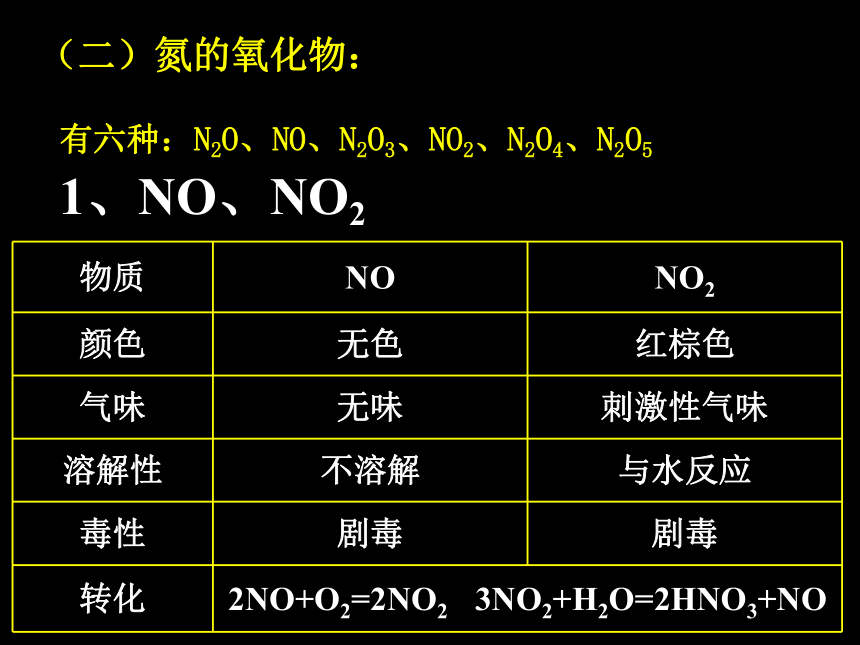
(二)氮的氧化物:
有六种:N2O、NO、N2O3、NO2、N2O4、N2O5
1、NO、NO2
物质 NO NO2
颜色 无色 红棕色
气味 无味 刺激性气味
溶解性 不溶解 与水反应
毒性 剧毒 剧毒
转化 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
第二课时
(1) NO2或NO2与N2(非O2)的混合气体溶于水时可依据:3NO2+H2O = 2HNO3+NO利用气体体积变化差值进行计算。
(2) NO2 和 O2 的混合气体溶于水时, 由 4 NO2+ O2 +2H2O =4HNO3可知,当体积比
V(NO2):V(O2)
= 4︰1,恰好完全反应
> 4︰1,NO2过量剩余气体为NO
<4︰1, O2过量,剩余气体为O2
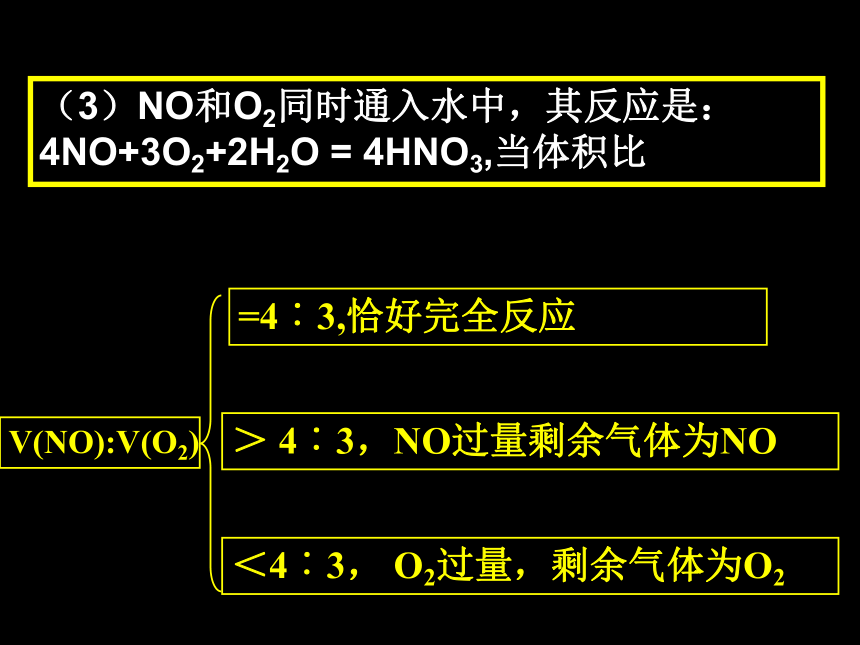
2、氮的氧化物溶于水的计算:
V(NO):V(O2)
=4︰3,恰好完全反应
> 4︰3,NO过量剩余气体为NO
<4︰3, O2过量,剩余气体为O2
(3)NO和O2同时通入水中,其反应是:4NO+3O2+2H2O = 4HNO3,当体积比
小结: 4NO2+O2和4NO+ 3 O2从组成上均相当于2N2O5的组成。即(2)、(3)两种情况中的总反应式都与
N2O5+ H2O === 2HNO3 等效。这不仅是记忆(2)(3)二式的方法,也为上述问题的解决提供了新的思路。即利用混合气体中N、O原子个数比进行分析判断:
N︰O
<2︰5 O2剩余
=2︰5 完全反应
>2︰5 NO剩余
2.将充满NO2和N2共45mL的试管,倒立于水槽中,过一段时间气体的体积变为35mL,则原混合气体中N2和NO2的体积比为 ( )
A、7:2 B、2:7 C、1:2 D、2:1
1、将10 mL充满NO2和O2的混合气体的试管,倒置在水槽中,反应停止后试管内剩余2mL无色气体,求原混合中NO2和O2各多少mL? (金版P40)
3、同温同压下,将NO NO2 和O2按一定体积比混合充满容器,再倒置于盛满水的水槽,片刻,液体充满容器,则反应前NO、NO2 、O2体积比可能为( )
A、1:1:1 B、8:4:7
C、4:8:5 D、任意比
D
A、B、C
6、标况下,将盛满NO、NO2、O2混合气体的集气瓶,倒置于水中,完全溶解,无气体剩余,设其产物不扩散,则所得溶液的物质的量浓度(M)的取值范围为( )
A、 0 < M < 1/22.4 B 1/39.2 < M < 1/28
C、1/28 < M < 1/22.4 D 1/39.2 < M < 1/22.4
5. 标准状况下,将盛有等体积的NO2与O2的试管,倒立于水槽中,反应后,试管内液体上升的高度大约是试管体积的几分之几?得到溶液的物质的量浓度为多少?
4. NO2装满一烧瓶,倒置于水槽中,所得溶液的物质的量浓度是多少?
B
第三课时
三、氨和铵盐
(一)、氨 NH3:
1、物理性质: 无色;有刺激性气味的气体;比空气轻; 极易溶于水(1:700)。
2、化学性质:
(1)、与水反应:喷泉实验
NH3+H2O NH3·H2O NH4++OH- (可 逆 过 程)
NH3+H2O NH3·H2O NH4++OH-
NH3是中学化学中唯一一种碱性气体,可以使湿润的红色石蕊试纸变蓝,常用于检验NH3的存在。
氨水成分:
分子:H2O、NH3、NH3·H2O 离子:H+、OH-、NH4+
辨析·比较】 液氨和氨水
氨水是混合物。 液氨是氨气加压或降温得到的液态氨,是纯净物,即液氨由氨分子组成的液体。
(2)、与酸反应:
NH3+ HCl === NH4Cl (产生白烟)(实验)
(3)、与氧气反应:
NH3+HNO3 === NH4NO3 (产生白烟)
2NH3+H2SO4=== (NH4)2SO4
4 NH3+5O2 4NO+6H2O
催化剂
高温
工业制HNO3的的重要反应
NH3
硝酸
铵盐
纯碱
有机合成工业原料
用稀氨水治疗
蚊虫叮咬
消除
二氧化氮
的污染
吸收硫酸
生产中的
二氧化硫
致冷剂
3、氨的用途
三、氨和铵盐
(二)、铵盐:
1、概念:由NH4+和酸根组成的盐。
3、化学性质:
2、白色晶体,均易溶于水。
(1)、受热易分解: NH4HCO3 NH3 ↑ +CO2 ↑ +H2O
△
NH4Cl NH3 ↑ + HCl ↑
△
生成的NH3与HCl遇冷又会结合成NH4Cl:
NH3 + HCl NH4Cl
氯化铵 受热分解
思考:上述过程与碘的升华原理一样吗?
(2)、与碱溶液反应: (实验)
NH4+ +OH-- === NH3·H2O (不加热)
保存方法:
NH4++OH- NH3 ↑+H2O
思考:如何检验NH4+的存在?
△
密封、阴凉通风处保存。
施用注意事项:
不能与碱性物质如草木灰等混用;埋在土下以保持肥效。
四、氨气的实验室制法:
1、常用药品:氯化铵和消石灰;
2、原理: 2NH4Cl(s)+Ca(OH)2(s) CaCl2 +2H2O +2NH3↑
3、装置:固+固 气 (类例制O2)
△
4、收集方法:向下排空气法 (实验)
5、验满:
(1)湿润的红色石蕊试纸(变蓝)
(2)玻璃棒蘸浓盐酸(白烟)
6、试管口棉花团作用:防止空气对流。
收集NH3后的导管口处塞一团湿棉花或用稀H2SO4浸湿的棉花,吸收多余的NH3,以防污染空气。
7、干燥:用碱石灰或生石灰。
思考:能否用浓H2SO4干燥? 能否用CaCl2干燥?
拓展:快速制氨气法:
1、加热浓氨水法:
2、向生石灰或NaOH上滴加浓氨水。
2、氯化铵和氯化钠可用下列哪一种方法分离
A.加入氢氧化钠 B.加入AgNO3溶液
C.加热法 D.加入一种合适的酸 E.加入水
例题与练习:
1、有关氨的性质的叙述正确的是( )
A.氨能在氧气中燃烧
B.氨水呈碱性
C.氨水和酸相遇都能产生白色烟雾
D.在反应NH3+H+ =NH4+中,氨失去电子被氧化
C
A、B
五、硝酸及其应用
(一)、物理性质:
纯硝酸是无色,有刺激性气味的液体。易挥发,熔沸点低,密度比水大。98%以上的浓HNO3 又叫“发烟硝酸”。(雾)
(二)、化学性质:
1、硝酸具有酸的通性 ①使指示剂变色: 例如:稀HNO3使紫色石蕊溶液变红。 ②与碱反应: 如HNO3+NaOH=NaNO3+H2O ③与碱性氧化物反应:如2HNO3+CaO=Ca(NO3)2+2H2O ④与弱酸盐反应: 如2HNO3+Na2CO3=2NaNO3+CO2↑+H2O ⑤与金属反应: 硝酸具有强氧化性,与金属反应时一般 不产生H2。
2、特性:(重点)
硝酸越浓,越容易分解。长期存放的浓HNO3呈黄色,这是由于HNO3分解产生的NO2溶于硝酸的缘故。 一般将它保存在棕色瓶里,放置在阴凉处。
Cu + 4HNO3(浓)== Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)== 3Cu(NO3)2+2NO↑+4H2O
(1)不稳定性: 4HNO3 (浓) 2H2O+4NO2↑+O2↑
光或热
(2)强氧化性: ①与金属反应——除金、铂、钛外 (实验)
Fe + 4HNO3(稀)== Fe(NO3)3+ NO↑+ 2H2O
练习与思考:
1、将以上反应改写成离子反应方程式; 2、以上反应中,HNO3表现了什么性质? 3、 HNO3还原产物有何特点? 4、浓HNO3 和稀 HNO3哪个氧化性强?为什么?
常温下,浓硝酸可使铁、铝钝化;加热时解钝。
②与某些非金属单质(如碳、硫等)反应 C+ 4HNO3(浓) CO2↑+4NO2↑+2H2O
③与其它还原性物质的反应 如:3 Fe2+ +4 H+ + NO3-=== 3Fe3+ +NO↑ +2H2O
可见:在酸性条件下,NO3-与还原性离子如S2-、I- 不能大量共存。
规律:浓硝酸一般被还原为NO2,稀硝酸一般 被还原为NO,产物与硝酸的浓度有关。
△
3 S2- +8 H+ + 2NO3-=== 3S↓ +2NO↑ +4H2O
拓展一:
王水:浓HNO3和浓盐酸的混合物(体积比1∶3)叫王水,它的氧化能力比硝酸更强,能够使一些不溶于硝酸的金属如金、铂等溶解。
拓展二:
酸的氧化性:实质上指 H+ 的氧化性,任何酸都有。
氧化性酸:是酸根离子中心原子获得电子的能力,酸根离子获得电子后,中心原子化合价降低,形成相应的低价含氧化合物甚至是单质.
六、人类活动对自然界氮循环和环境的影响
1.人类活动对自然界氮循环的影响:
2.人类活动对环境的影响:
(1)光化学烟雾: (2)酸雨: (3)富营养化:
3.如何减少人类活动对自然界中氮循环的影响 (1)控制进入大气、陆地和海洋的有害物质的数量。 (2)增强生态系统对有害物质的吸收能力。我们应保护 森林,植树造林,促进全球氮的良性循环。
七、常见考点:
1、NOx溶于水的计算:
例1:将装有50mLNO2、NO混合气体的量筒倒立于水槽中,反应后气体体积缩小为30mL,则原混合气体中NO2和NO的体积比是 A.5∶3 B.3∶5 C.3∶2 D.2∶3
例2:如图所示的装置中,烧瓶中充满了干燥气体A将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。
2、喷泉实验计算:
A(干燥气体) b(液体)
A NO2 水
B CO2 4mol/LnaOH溶液
C Cl2 饱和NaCl溶液
D NH3 1mol/L盐酸
选项______(填A、B、C、D)为何不满足要求______
练习:在标准状况下,在三个干燥的烧瓶内分别装入干燥纯净的NH3、含一半空气的氯化氢、NO2和O2的混合气体[v(NO2)∶v(O2)=4 ∶1]。然后分别做喷泉实验,三个烧瓶中所得溶液的物质的量浓度之比为
A.2∶1∶2 B.5∶5∶4 C.1∶1∶1 D.无法确定
3、离子共存:
例3、已知溶液为棕黄色, 溶液为浅绿色,向Fe(NO3)2溶液中加入少量稀盐酸时,溶液的颜色变化应该是( ) A、变浅 B、变为红色 C、没有改变 D、变为棕黄色
练习:在酸性溶液中,下列各离子因氧化还原反应而不能大量共存的是( ) A. B. C. D.
4、有关HNO3的计算:
例4、38.4 mg Cu与适量的浓HNO3反应,铜全部作用后,共收集到22.4 mL气体(标准状况下),反应消耗的HNO3其物质的量可能是( ) A.1.0×10-3 mol B.1.6×10-3 mol C.2.2×10-3 mol D.2.4×10-3 mol
例5、在100mL某混合酸中,HNO3的物质的量浓度为0.4mol·L-1,H2SO4的物质的量浓度为0.1 mol·L-1,向其中加入1.92 g铜粉,微热,待充分反应后,求溶液中的物质的量浓度。
关于HNO3计算小结: 1、与金属单质反应时HNO3表现酸性和氧化性,表现酸性的量可由金属所形成的盐计算得出,表现氧化性的量可由所产生的气体算出,不论是NO还是NO2。 2、金属与混酸的计算必须按照离子方程式计算,因为其中的不仅仅由HNO3提供。
本节小结
一、氮在自然界中的循环:
二、氮循环中的重要物质及氮的固定:
(一)、N2
(二)氮的氧化物:
1、NO、NO2
2、氮的氧化物溶于水的计算:
三、氨和铵盐
(一)、氨 NH3:
(二)、铵盐:
四、氨气的实验室制法:
五、硝酸及其应用
在新疆和青海的交界处,有一处山谷,每当牧民和牲畜进入后,风和日丽的晴天顷刻电闪雷鸣,人、畜遭雷击而毙命,奇怪的是这里牧草茂盛、四季常青,被当地人称为魔鬼谷。
最近地质工作者揭开了谜底—该地质表层处有一巨大磁铁矿,当人畜进入后形成尖端放电。
