选修四1.3化学反应热的计算(课件31页)
文档属性
| 名称 | 选修四1.3化学反应热的计算(课件31页) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-13 00:00:00 | ||
图片预览











文档简介
(共31张PPT)
第一章
化学反应与能量
第三节
化学反应热的计算
学习目标
变化观念与科学探究:
理解盖斯定律的内容,了解其在科学研究中的意义;
证据推理与模型认识:
能用盖斯定律进行有关反应热的简单计算。
1
2
新知导入
反应热如何测定?
从能量守恒角度理解
新知讲解
1.盖斯定律
内容
不管化学反应是一步完成或分几步完成,其反应热是相同的。
从S→L,ΔH1<0,体系放热;从L→S,ΔH2>0,体系吸热;根据能量守恒:ΔH1+ΔH2=0。
计算方法
新知讲解
1.盖斯定律
应用
有的反应进行得很慢,有些反应不直接发生,有些反应产品不纯,无法或较难通过实验测定这些反应的反应热,应用盖斯定律可间接地计算反应热。
根据盖斯定律可得:ΔH1=ΔH+ΔH2,则:ΔH=ΔH1-ΔH2
新知讲解
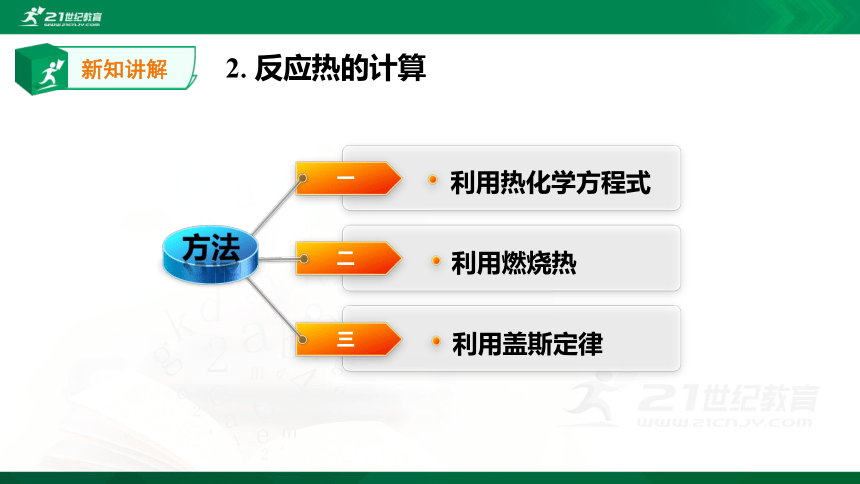
2.反应热的计算
利用热化学方程式
利用燃烧热
利用盖斯定律
新知讲解
2.反应热的计算
①利用热化学方程式计算
25
℃、101
kPa,使1.0
g
Na与足量Cl2反应,生成NaCl晶体并放出17.87
kJ热量,则生成1
mol
NaCl
的反应热为_______________。
–411.01
kJ·mol-1
新知讲解
2.反应热的计算
②利用燃烧热计算
乙醇的燃烧热为ΔH=-1
366.8
kJ·mol-1,则25
℃、101
kPa时1
kg乙醇完全燃烧放出的热量为________________。
2.971×104
kJ
新知讲解
2.反应热的计算
③利用盖斯定律计算
已知:温度过高时,WO2(s)转变为WO2(g):
①WO2(s)+2H2(g)
?
W(s)+2H2O(g) ΔH1
②WO2(g)+2H2(g)
?
W(s)+2H2O(g) ΔH2
则WO2(s)
?
WO2(g)的ΔH=__________。
ΔH1-ΔH2
课堂练习
1.判断正误(正确的打“√”,错误的打“×”)
(1)一个反应一步完成或分几步完成,两者相比,经过的步骤越多,放出的热量越多。( )
(2)化学反应的反应热与化学反应的始态有关,与终态无关。( )
(3)同一反应的反应热ΔH与化学计量数成正比。
( )
×
√
×
课堂练习
2.下列叙述不正确的是( )
A.化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关
B.盖斯定律遵守能量守恒定律
C.利用盖斯定律可间接计算难以通过实验测定的反应的反应热
D.利用盖斯定律可以计算有副反应发生的反应的反应热
A
课堂练习
3.已知:
2H2(g)+O2(g)===2H2O(g) ΔH1=a
kJ·mol–1
H2(g)+O2(g)===H2O(l) ΔH2=b
kJ·mol?1
则H2O(l)===H2O(g) ΔH=________________。
课堂练习
课堂练习
课堂练习
课堂练习
核心突破
盖斯定律应用计算的两方法:
①虚拟路径法:
②加合法:
素养养成
证据推理与模型认知:盖斯定律应用计算模型
课堂总结
盖斯定律:
作业布置
1.下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理:
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为
___________________、
____________________,
制得等量H2所需能量较少
的是________。
作业布置
作业布置
作业布置
作业布置
作业解答
1.根据盖斯定律,将①+②+③可得,系统(Ⅰ)中的热化学方程式:
H2O(l)===H2(g)+1/2O2(g) ΔH=ΔH1+ΔH2+ΔH3=327
kJ·mol-1-151
kJ·mol-1+110
kJ·mol-1=286
kJ·mol-1
同理,将②+③+④可得,系统(Ⅱ)中的热化学方程式:
H2S(g)===H2(g)+S(s) ΔH=ΔH2+ΔH3+ΔH4=-151
kJ·mol-1+110
kJ·mol-1+61
kJ·mol-1=20
kJ·mol-1
由所得两热化学方程式可知,制得等量H2所需能量较少的是系统(Ⅱ)。
答案:
作业解答
作业解答
作业解答
作业解答
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
第一章
化学反应与能量
第三节
化学反应热的计算
学习目标
变化观念与科学探究:
理解盖斯定律的内容,了解其在科学研究中的意义;
证据推理与模型认识:
能用盖斯定律进行有关反应热的简单计算。
1
2
新知导入
反应热如何测定?
从能量守恒角度理解
新知讲解
1.盖斯定律
内容
不管化学反应是一步完成或分几步完成,其反应热是相同的。
从S→L,ΔH1<0,体系放热;从L→S,ΔH2>0,体系吸热;根据能量守恒:ΔH1+ΔH2=0。
计算方法
新知讲解
1.盖斯定律
应用
有的反应进行得很慢,有些反应不直接发生,有些反应产品不纯,无法或较难通过实验测定这些反应的反应热,应用盖斯定律可间接地计算反应热。
根据盖斯定律可得:ΔH1=ΔH+ΔH2,则:ΔH=ΔH1-ΔH2
新知讲解
2.反应热的计算
利用热化学方程式
利用燃烧热
利用盖斯定律
新知讲解
2.反应热的计算
①利用热化学方程式计算
25
℃、101
kPa,使1.0
g
Na与足量Cl2反应,生成NaCl晶体并放出17.87
kJ热量,则生成1
mol
NaCl
的反应热为_______________。
–411.01
kJ·mol-1
新知讲解
2.反应热的计算
②利用燃烧热计算
乙醇的燃烧热为ΔH=-1
366.8
kJ·mol-1,则25
℃、101
kPa时1
kg乙醇完全燃烧放出的热量为________________。
2.971×104
kJ
新知讲解
2.反应热的计算
③利用盖斯定律计算
已知:温度过高时,WO2(s)转变为WO2(g):
①WO2(s)+2H2(g)
?
W(s)+2H2O(g) ΔH1
②WO2(g)+2H2(g)
?
W(s)+2H2O(g) ΔH2
则WO2(s)
?
WO2(g)的ΔH=__________。
ΔH1-ΔH2
课堂练习
1.判断正误(正确的打“√”,错误的打“×”)
(1)一个反应一步完成或分几步完成,两者相比,经过的步骤越多,放出的热量越多。( )
(2)化学反应的反应热与化学反应的始态有关,与终态无关。( )
(3)同一反应的反应热ΔH与化学计量数成正比。
( )
×
√
×
课堂练习
2.下列叙述不正确的是( )
A.化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关
B.盖斯定律遵守能量守恒定律
C.利用盖斯定律可间接计算难以通过实验测定的反应的反应热
D.利用盖斯定律可以计算有副反应发生的反应的反应热
A
课堂练习
3.已知:
2H2(g)+O2(g)===2H2O(g) ΔH1=a
kJ·mol–1
H2(g)+O2(g)===H2O(l) ΔH2=b
kJ·mol?1
则H2O(l)===H2O(g) ΔH=________________。
课堂练习
课堂练习
课堂练习
课堂练习
核心突破
盖斯定律应用计算的两方法:
①虚拟路径法:
②加合法:
素养养成
证据推理与模型认知:盖斯定律应用计算模型
课堂总结
盖斯定律:
作业布置
1.下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理:
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为
___________________、
____________________,
制得等量H2所需能量较少
的是________。
作业布置
作业布置
作业布置
作业布置
作业解答
1.根据盖斯定律,将①+②+③可得,系统(Ⅰ)中的热化学方程式:
H2O(l)===H2(g)+1/2O2(g) ΔH=ΔH1+ΔH2+ΔH3=327
kJ·mol-1-151
kJ·mol-1+110
kJ·mol-1=286
kJ·mol-1
同理,将②+③+④可得,系统(Ⅱ)中的热化学方程式:
H2S(g)===H2(g)+S(s) ΔH=ΔH2+ΔH3+ΔH4=-151
kJ·mol-1+110
kJ·mol-1+61
kJ·mol-1=20
kJ·mol-1
由所得两热化学方程式可知,制得等量H2所需能量较少的是系统(Ⅱ)。
答案:
作业解答
作业解答
作业解答
作业解答
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
