山东省德州市2019-2020学年高二下学期期末考试化学试题 Word版含答案
文档属性
| 名称 | 山东省德州市2019-2020学年高二下学期期末考试化学试题 Word版含答案 |  | |
| 格式 | docx | ||
| 文件大小 | 261.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-13 17:29:30 | ||
图片预览



文档简介
德州市2019-2020学年高二下学期期末考试1220470010172700
化学试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间90分钟。
注意事项:
1.每小题选出答案后,用2B铅笔把答题卡上对应题目答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号,不能将答案直接答在试卷上。
2.考试结束后,请将答题卡一并交回。
可能用到的相对原子质量:Zn65 S32 H1 C12 N14 O16 Na23.
第Ⅰ卷(选择题共40分)
一、单项选择题:本题包括10个小题,每小题2分,共20分,每小题只有1个选项符合题意。
1.化学与生活密切相关,下列说法正确的是
A.淀粉、纤维素、蛋白质均属于天然高分子化合物,摄入后均能为人体提供能量
B.将浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱中,其作用是催熟水果
C.苯酚有毒,但低浓度时可用作杀菌消毒剂.因此常用来制造有消毒作用的酚皂
D.防控新冠病毒常用75%的酒精或“84”消毒液,二者可混用以增强消毒效果
2.下列关于有机物的描述正确的是
A.丙烯分子的比例模型:
B.甲基的电子式:false
c. 系统命名法命名:3-甲基--2-丁烯
D.聚丙烯的结构简式:
3.下列说法正确的是
A.油脂发生皂化反应的产物是高级脂肪酸和甘油
B.苯与甲苯互为同系物,均能使酸性高锰酸钾溶液褪色
C.false浓溶液和false溶液都可使蛋白质沉淀析出
D.可由乙烯与溴水加成制得溴乙烷
4.下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是
A. K和Ar B. C60和晶体硅
C. CO2和SiO2 D. NaCl和CaO
5.下列各组物质性质的比较,结论不正确的是
A.分子的极性:异戊烷>新戊烷
B.沸点:
C.碳碳键的键长:false
D.在H2O中的溶解度:CHsCH2Br6.下列说法中正确的是
A.在多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.电子在3PX与3PZ轨道上的运动状态不相同
C.N原子的电子排布违背了泡利不相容原理
D.B原子由false时,由基态转化为激发态,形成发射光谱
7.下列由实验得出的结论正确的是
实验
结论
A.
某有机物完全燃烧,只生成CO2和H2O
该有机物属于烃类物质
B.
乙醇和水都可与金属钠反应产生可燃性气体
乙醇分子中羟基上的氢与水分子中的氢具有相同的活性
C.
向苯酚溶液中滴加几滴浓溴水,无白色沉淀生成
苯酚与浓溴水不反应
D.
将铜丝在酒精灯外焰上加热,变黑后再移至内焰,变黑的铜丝恢复红色
酒精灯内焰有挥发出的乙醇蒸气,将变黑的铜丝还原
8.下列说法正确的是
A.金刚石与碳化硅晶体结构相似.金刚石的硬度小于碳化硅
B.PH3和NH3分子中均含有孤电子对,且NH3提供孤电子对的能力强于PH3
C. BeO的晶格能大于MgO,可推测BeCO3的分解温度低于MgCO3
D.向false中加入足量AgNO3溶液,可以得到3mol AgCl沉淀
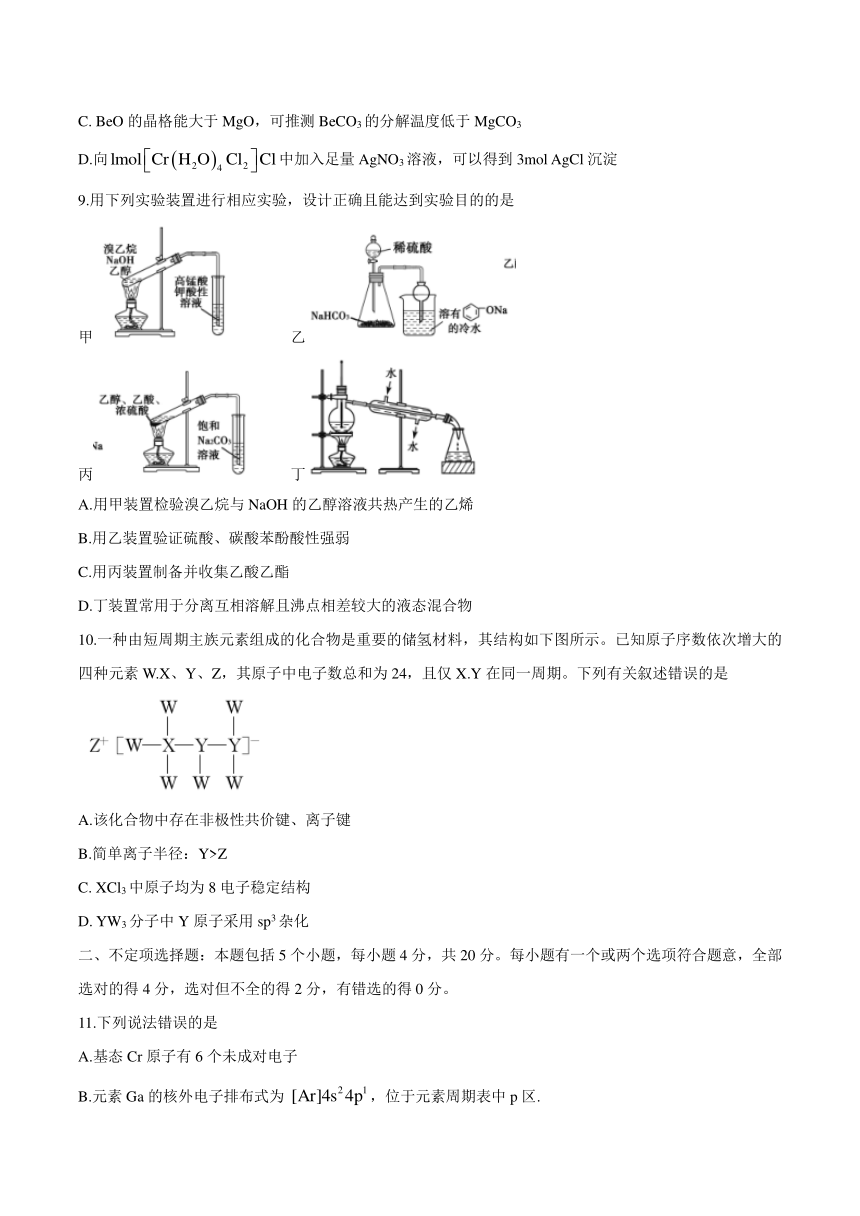
9.用下列实验装置进行相应实验,设计正确且能达到实验目的的是
甲 乙
丙 丁
A.用甲装置检验溴乙烷与NaOH的乙醇溶液共热产生的乙烯
B.用乙装置验证硫酸、碳酸苯酚酸性强弱
C.用丙装置制备并收集乙酸乙酯
D.丁装置常用于分离互相溶解且沸点相差较大的液态混合物
10.一种由短周期主族元素组成的化合物是重要的储氢材料,其结构如下图所示。已知原子序数依次增大的四种元素W.X、Y、Z,其原子中电子数总和为24,且仅X.Y在同一周期。下列有关叙述错误的是
A.该化合物中存在非极性共价键、离子键
B.简单离子半径:Y>Z
C. XCl3中原子均为8电子稳定结构
D. YW3分子中Y原子采用sp3杂化
二、不定项选择题:本题包括5个小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对的得4分,选对但不全的得2分,有错选的得0分。
11.下列说法错误的是
A.基态Cr原子有6个未成对电子
B.元素Ga的核外电子排布式为false,位于元素周期表中p区.
C. NH3中N-H键间的键角比CH中C-H键间的键角小
D. XY2分子为V形,则X原子一定为sp2杂化
12.已知某有机物A的红外光谱和1H核磁共振谱如图所示,下列说法中错误的是
未知物A的红外光谱
未知物A的1H核磁共振谱
A.由红外光谱图可知,该有机物中至少含有三种不同的化学键
B.由1H核磁共振谱可知,该有机物分子中有三种不同的氢原子且个数比为1:2:3
C.由1H核磁共振谱就可得知A分子中的氢原子总数为6
D.若A的化学式为C2H6O,则其结构简式为CH3CH2OH
13.BF3与一定量的水形成false,一定条件下false可发生如图转化,下列说法中正确的是
false
A. false熔化后得到的物质属于离子晶体
B. false分子之间存在着配位键和氢键
C. H3O+中氧原子为sp3杂化
D. BF3是仅含极性共价键的非极性分子
14.化合物Z是合成某种抗结核候选药物的重要中间体,可由下列反应制得。
下列有关化合物X.Y和Z的说法不正确的是
A.X分子中不含手性碳原子
B.Y分子中的碳原子一定处于同一平面
C.Z在浓硫酸催化下加热可发生消去反应
D.X、Z分别在过量NaOH溶液中加热,均能生成丙三醇
15.高温下,某金属氧化物的晶体结构如图所示.其中氧的化合价可看作部分为0价、部分为-2价。下列有关说法中正确的是
A.元素A可能位于元素周期表第IA族
B.该离子晶体的化学式是A2O2
C.晶体中A+等距且最近的A+有12个
D.晶体中,0价氧原子与-2价氧原子的数目比为1:1
第Ⅱ卷(非选择题共60分)
三、非选择题:本题共5小题,共60分。
16.(10分)现有下列7种与生产生活相关的有机物,请回答下列问题:
①false②③false④false⑤false
(1)有机物是含碳的化合物,基态C原子中电子占据的最高能层符号是: ;
(2)与①互为同系物的为 (填序号);
(3)②的单体结构简式为: 、 ;
(4)④中σ键和π键个数之比为 ;
(5)⑤分子中O-C-H键角 (填“大于”“等于”或“小于”)甲醛分子内的O-C-H键角。
17.(12分)己二酸在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,其制备反应为:
(1)有机反应物的名称为: ,其中所有的碳原子 处于同一平面(填“能”或“不能”)。
(2)已二酸中所含化学键的类型为 (用对应字母表示)。
a. false键 b.π键 c.极性共价键 d.非极性共价键 e.离子键 f.氢键
(3)该反应方程式中所涉及元素的电负性从大到小的顺序为 (用元素符号表示,下同),第一电离能最大的是 。
(4)反应物硝酸可脱水生成N2O5,固态N2O5由false和一种一价阳离子构成,则其中阴阳离子的空间构型依次为 、 。
18.(13分)氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取。实验室模拟制备装置加热装置如下所示:
已知:氯苯为无色液体,沸点132.2℃。回答下列问题:
(1)a中制取氯气,中空玻璃管b的作用是 ;仪器c的名称是 。
(2)把干燥的氯气通入装有干燥苯等的反应器d中,加热维持反应温度在40~60°C为宜,温度过高会生成二氯苯。
①加热d的方法是 ;
②c出口的气体成分有HCl、 ;
③d中发生反应的化学方程式: 。
(3)a、d反应器之间洗气瓶内装有的物质是 。
(4)d中反应完成后,装置内液体要进行水洗、碱洗及干燥再进行 (填操作名称),可得到氯苯。碱洗之前要水洗的主要目的是 。
19.(12分)锌是一种重要的金属,其单质和化合物被广泛应用。请回答下列问题:
(1)电镀工业中为了提高镀锌的效果,通常采用false溶液代替Zn2+溶液进行电解。
①基态Zn2+的价电子排布图为 ;
②false中存在σ键的数目为 ;
③不考虑空间构型,false的结构可用示意图表示为 。
(2)锌的某些硫化物具有独特的光电效应.被研究应用于荧光材料、电磁学等领域。右图为锌的某种硫化物的晶胞结构:
①该化合物的化学式为 ;
②C的配位数为 ;
③列式表示该晶体的密度: false(用含a、b、NA的代数式表示)。
20.(13分)2018年我国首次使用a-溴代羰基化合物合成了G,G在有机化工领域具有十分重要的价值。其合成路线如图:
回答下列问题:
(1)A的结构简式是: ;
(2)B→C反应所需试剂为: ;
(3)D→E过程中,反应①的化学方程式: ;
(4)E→F的反应类型为 ,G中的含氧官能团名称为:硝基、 ;
(5)由E发生聚合反应,生成高聚物的结构简式为: ;
(6)化合物X是H的同系物,其分子式为false,其核磁共振氢谱有3组峰,则X的结构简式可能为 (写一种即可)。
高二化学试题参考答案
一、单项选择题:本题包括10个小题,每小题2分,共20分,每小题只有1个选项符合题意。
1.C 2.B 3.C 4.D 5.B 6.B 7.D 8.C 9.B 10.C
二、选择题:本题包括5个小题,共20分。每小题有一个或两个选项符合题意,全部选对的得4分,选对但不全的得2分,有选错的得0分。.
11.BD 12.C 13.CD 14.AB 15.AC.
三.非选择题:本题共5小题,共60分。
16.(10分,除标注外每空2分)
(1)L(1分)
(2)⑤(1分)
(3)false
(4)6:1
(5)小于
17.(12分,除标注外每空2分)
(1)环已醇(1分)不能(1分)
(2)abed
(3)O>N>C>H N
(4)平面三角形直线形
18.(13分,除标注外每空2分)
(1)平衡气压 球形冷凝管(1分)
(2)①水浴加热(1分)②Cl2、苯蒸气③(3)浓硫酸(1分)
(4)蒸馏 洗去HCl、FeCl3,节省碱的用量,降低成本
19.(12分,每空2分)
(1)①②8③或
(2)①ZnS②4③false
20.(13分,除标注外每空2分)
(1)
(2)NaOH溶液
(3)false
(4)取代反应(1分) 醚键、羟基
(5)或
(6)或(写一种即可)
化学试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间90分钟。
注意事项:
1.每小题选出答案后,用2B铅笔把答题卡上对应题目答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号,不能将答案直接答在试卷上。
2.考试结束后,请将答题卡一并交回。
可能用到的相对原子质量:Zn65 S32 H1 C12 N14 O16 Na23.
第Ⅰ卷(选择题共40分)
一、单项选择题:本题包括10个小题,每小题2分,共20分,每小题只有1个选项符合题意。
1.化学与生活密切相关,下列说法正确的是
A.淀粉、纤维素、蛋白质均属于天然高分子化合物,摄入后均能为人体提供能量
B.将浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱中,其作用是催熟水果
C.苯酚有毒,但低浓度时可用作杀菌消毒剂.因此常用来制造有消毒作用的酚皂
D.防控新冠病毒常用75%的酒精或“84”消毒液,二者可混用以增强消毒效果
2.下列关于有机物的描述正确的是
A.丙烯分子的比例模型:
B.甲基的电子式:false
c. 系统命名法命名:3-甲基--2-丁烯
D.聚丙烯的结构简式:
3.下列说法正确的是
A.油脂发生皂化反应的产物是高级脂肪酸和甘油
B.苯与甲苯互为同系物,均能使酸性高锰酸钾溶液褪色
C.false浓溶液和false溶液都可使蛋白质沉淀析出
D.可由乙烯与溴水加成制得溴乙烷
4.下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是
A. K和Ar B. C60和晶体硅
C. CO2和SiO2 D. NaCl和CaO
5.下列各组物质性质的比较,结论不正确的是
A.分子的极性:异戊烷>新戊烷
B.沸点:
C.碳碳键的键长:false
D.在H2O中的溶解度:CHsCH2Br
A.在多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.电子在3PX与3PZ轨道上的运动状态不相同
C.N原子的电子排布违背了泡利不相容原理
D.B原子由false时,由基态转化为激发态,形成发射光谱
7.下列由实验得出的结论正确的是
实验
结论
A.
某有机物完全燃烧,只生成CO2和H2O
该有机物属于烃类物质
B.
乙醇和水都可与金属钠反应产生可燃性气体
乙醇分子中羟基上的氢与水分子中的氢具有相同的活性
C.
向苯酚溶液中滴加几滴浓溴水,无白色沉淀生成
苯酚与浓溴水不反应
D.
将铜丝在酒精灯外焰上加热,变黑后再移至内焰,变黑的铜丝恢复红色
酒精灯内焰有挥发出的乙醇蒸气,将变黑的铜丝还原
8.下列说法正确的是
A.金刚石与碳化硅晶体结构相似.金刚石的硬度小于碳化硅
B.PH3和NH3分子中均含有孤电子对,且NH3提供孤电子对的能力强于PH3
C. BeO的晶格能大于MgO,可推测BeCO3的分解温度低于MgCO3
D.向false中加入足量AgNO3溶液,可以得到3mol AgCl沉淀
9.用下列实验装置进行相应实验,设计正确且能达到实验目的的是
甲 乙
丙 丁
A.用甲装置检验溴乙烷与NaOH的乙醇溶液共热产生的乙烯
B.用乙装置验证硫酸、碳酸苯酚酸性强弱
C.用丙装置制备并收集乙酸乙酯
D.丁装置常用于分离互相溶解且沸点相差较大的液态混合物
10.一种由短周期主族元素组成的化合物是重要的储氢材料,其结构如下图所示。已知原子序数依次增大的四种元素W.X、Y、Z,其原子中电子数总和为24,且仅X.Y在同一周期。下列有关叙述错误的是
A.该化合物中存在非极性共价键、离子键
B.简单离子半径:Y>Z
C. XCl3中原子均为8电子稳定结构
D. YW3分子中Y原子采用sp3杂化
二、不定项选择题:本题包括5个小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对的得4分,选对但不全的得2分,有错选的得0分。
11.下列说法错误的是
A.基态Cr原子有6个未成对电子
B.元素Ga的核外电子排布式为false,位于元素周期表中p区.
C. NH3中N-H键间的键角比CH中C-H键间的键角小
D. XY2分子为V形,则X原子一定为sp2杂化
12.已知某有机物A的红外光谱和1H核磁共振谱如图所示,下列说法中错误的是
未知物A的红外光谱
未知物A的1H核磁共振谱
A.由红外光谱图可知,该有机物中至少含有三种不同的化学键
B.由1H核磁共振谱可知,该有机物分子中有三种不同的氢原子且个数比为1:2:3
C.由1H核磁共振谱就可得知A分子中的氢原子总数为6
D.若A的化学式为C2H6O,则其结构简式为CH3CH2OH
13.BF3与一定量的水形成false,一定条件下false可发生如图转化,下列说法中正确的是
false
A. false熔化后得到的物质属于离子晶体
B. false分子之间存在着配位键和氢键
C. H3O+中氧原子为sp3杂化
D. BF3是仅含极性共价键的非极性分子
14.化合物Z是合成某种抗结核候选药物的重要中间体,可由下列反应制得。
下列有关化合物X.Y和Z的说法不正确的是
A.X分子中不含手性碳原子
B.Y分子中的碳原子一定处于同一平面
C.Z在浓硫酸催化下加热可发生消去反应
D.X、Z分别在过量NaOH溶液中加热,均能生成丙三醇
15.高温下,某金属氧化物的晶体结构如图所示.其中氧的化合价可看作部分为0价、部分为-2价。下列有关说法中正确的是
A.元素A可能位于元素周期表第IA族
B.该离子晶体的化学式是A2O2
C.晶体中A+等距且最近的A+有12个
D.晶体中,0价氧原子与-2价氧原子的数目比为1:1
第Ⅱ卷(非选择题共60分)
三、非选择题:本题共5小题,共60分。
16.(10分)现有下列7种与生产生活相关的有机物,请回答下列问题:
①false②③false④false⑤false
(1)有机物是含碳的化合物,基态C原子中电子占据的最高能层符号是: ;
(2)与①互为同系物的为 (填序号);
(3)②的单体结构简式为: 、 ;
(4)④中σ键和π键个数之比为 ;
(5)⑤分子中O-C-H键角 (填“大于”“等于”或“小于”)甲醛分子内的O-C-H键角。
17.(12分)己二酸在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,其制备反应为:
(1)有机反应物的名称为: ,其中所有的碳原子 处于同一平面(填“能”或“不能”)。
(2)已二酸中所含化学键的类型为 (用对应字母表示)。
a. false键 b.π键 c.极性共价键 d.非极性共价键 e.离子键 f.氢键
(3)该反应方程式中所涉及元素的电负性从大到小的顺序为 (用元素符号表示,下同),第一电离能最大的是 。
(4)反应物硝酸可脱水生成N2O5,固态N2O5由false和一种一价阳离子构成,则其中阴阳离子的空间构型依次为 、 。
18.(13分)氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取。实验室模拟制备装置加热装置如下所示:
已知:氯苯为无色液体,沸点132.2℃。回答下列问题:
(1)a中制取氯气,中空玻璃管b的作用是 ;仪器c的名称是 。
(2)把干燥的氯气通入装有干燥苯等的反应器d中,加热维持反应温度在40~60°C为宜,温度过高会生成二氯苯。
①加热d的方法是 ;
②c出口的气体成分有HCl、 ;
③d中发生反应的化学方程式: 。
(3)a、d反应器之间洗气瓶内装有的物质是 。
(4)d中反应完成后,装置内液体要进行水洗、碱洗及干燥再进行 (填操作名称),可得到氯苯。碱洗之前要水洗的主要目的是 。
19.(12分)锌是一种重要的金属,其单质和化合物被广泛应用。请回答下列问题:
(1)电镀工业中为了提高镀锌的效果,通常采用false溶液代替Zn2+溶液进行电解。
①基态Zn2+的价电子排布图为 ;
②false中存在σ键的数目为 ;
③不考虑空间构型,false的结构可用示意图表示为 。
(2)锌的某些硫化物具有独特的光电效应.被研究应用于荧光材料、电磁学等领域。右图为锌的某种硫化物的晶胞结构:
①该化合物的化学式为 ;
②C的配位数为 ;
③列式表示该晶体的密度: false(用含a、b、NA的代数式表示)。
20.(13分)2018年我国首次使用a-溴代羰基化合物合成了G,G在有机化工领域具有十分重要的价值。其合成路线如图:
回答下列问题:
(1)A的结构简式是: ;
(2)B→C反应所需试剂为: ;
(3)D→E过程中,反应①的化学方程式: ;
(4)E→F的反应类型为 ,G中的含氧官能团名称为:硝基、 ;
(5)由E发生聚合反应,生成高聚物的结构简式为: ;
(6)化合物X是H的同系物,其分子式为false,其核磁共振氢谱有3组峰,则X的结构简式可能为 (写一种即可)。
高二化学试题参考答案
一、单项选择题:本题包括10个小题,每小题2分,共20分,每小题只有1个选项符合题意。
1.C 2.B 3.C 4.D 5.B 6.B 7.D 8.C 9.B 10.C
二、选择题:本题包括5个小题,共20分。每小题有一个或两个选项符合题意,全部选对的得4分,选对但不全的得2分,有选错的得0分。.
11.BD 12.C 13.CD 14.AB 15.AC.
三.非选择题:本题共5小题,共60分。
16.(10分,除标注外每空2分)
(1)L(1分)
(2)⑤(1分)
(3)false
(4)6:1
(5)小于
17.(12分,除标注外每空2分)
(1)环已醇(1分)不能(1分)
(2)abed
(3)O>N>C>H N
(4)平面三角形直线形
18.(13分,除标注外每空2分)
(1)平衡气压 球形冷凝管(1分)
(2)①水浴加热(1分)②Cl2、苯蒸气③(3)浓硫酸(1分)
(4)蒸馏 洗去HCl、FeCl3,节省碱的用量,降低成本
19.(12分,每空2分)
(1)①②8③或
(2)①ZnS②4③false
20.(13分,除标注外每空2分)
(1)
(2)NaOH溶液
(3)false
(4)取代反应(1分) 醚键、羟基
(5)或
(6)或(写一种即可)
同课章节目录
