人教版选修四高中化学 2.2 影响化学反应速率的因素(34张PPT)
文档属性
| 名称 | 人教版选修四高中化学 2.2 影响化学反应速率的因素(34张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-13 20:15:35 | ||
图片预览







文档简介
(共34张PPT)
第二节
影响化学反应速率的因素
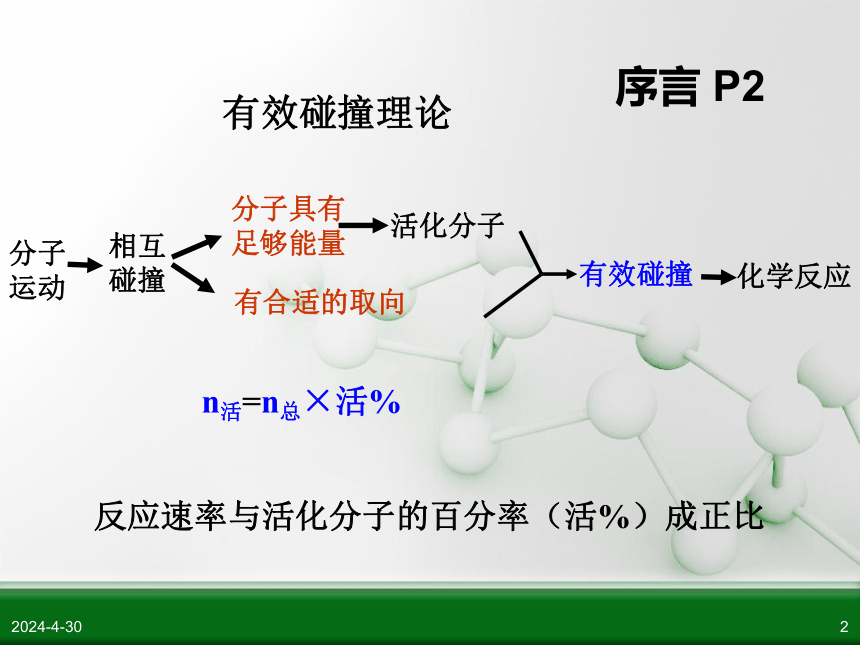
分子
运动
分子具有
足够能量
有合适的取向
n活=n总×活%
有效碰撞理论
反应速率与活化分子的百分率(活%)成正比
序言
P2
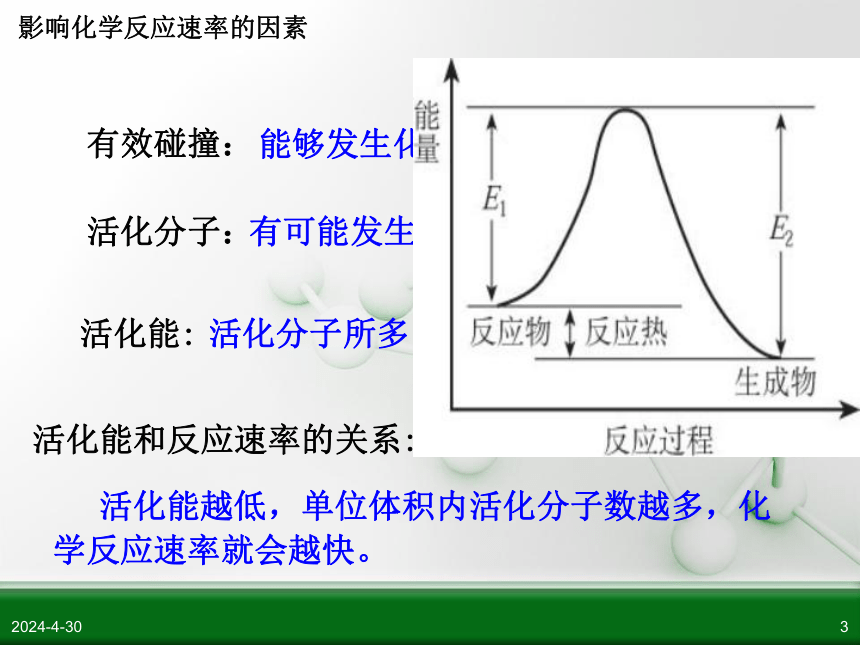
能够发生化学反应的碰撞。
有可能发生有效碰撞的分子。
活化分子所多出普通分子的那部分能量E1。
活化能越低,单位体积内活化分子数越多,化
学反应速率就会越快。
有效碰撞:
活化分子:
活化能:
活化能和反应速率的关系:
影响化学反应速率的因素
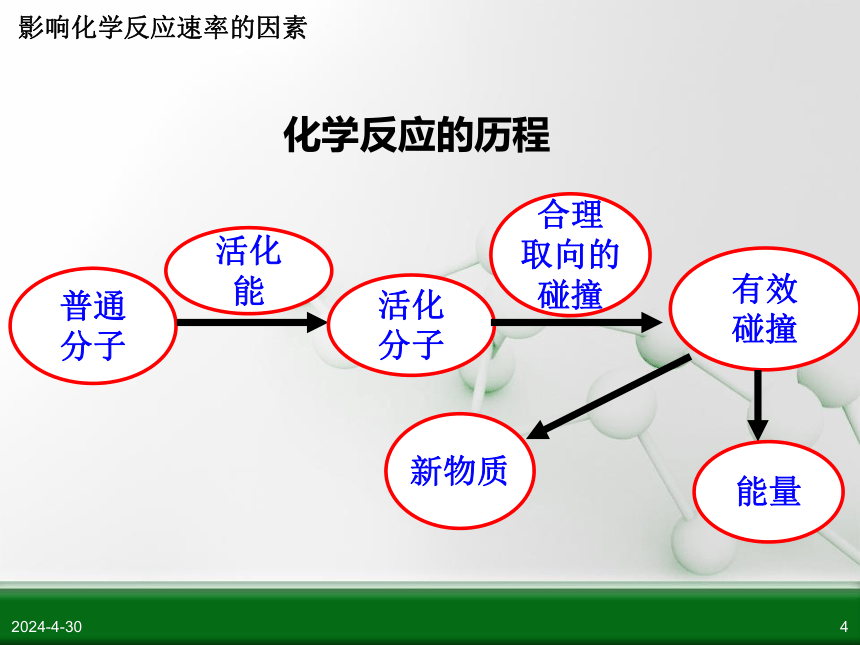
化学反应的历程
普通
分子
活化
能
活化
分子
合理
取向的
碰撞
有效
碰撞
影响化学反应速率的因素
(1)硫在纯氧中比在空气中燃烧剧烈。
(2)香蕉采摘的时候并不是完全熟的,常用乙烯作为
它的催熟剂。
(3)新鲜的水果和食物保存在冰箱里能存放得更久。
思考与交流
用化学的观点解释下列事实:
(4)煤粉比煤块更容易燃烧。
影响化学反应速率的因素
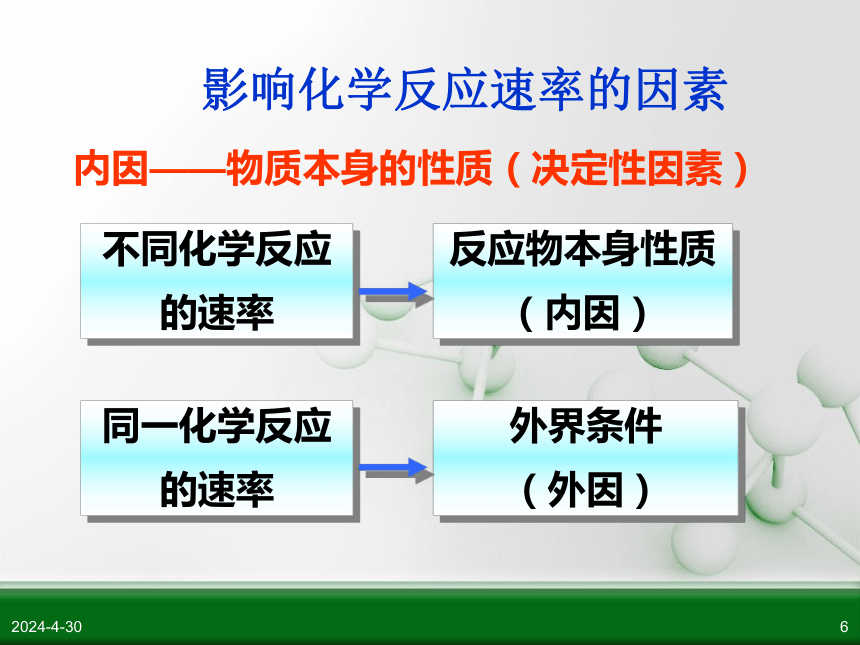
不同化学反应
的速率
反应物本身性质
(内因)
同一化学反应
的速率
外界条件
(外因)
内因——物质本身的性质(决定性因素)
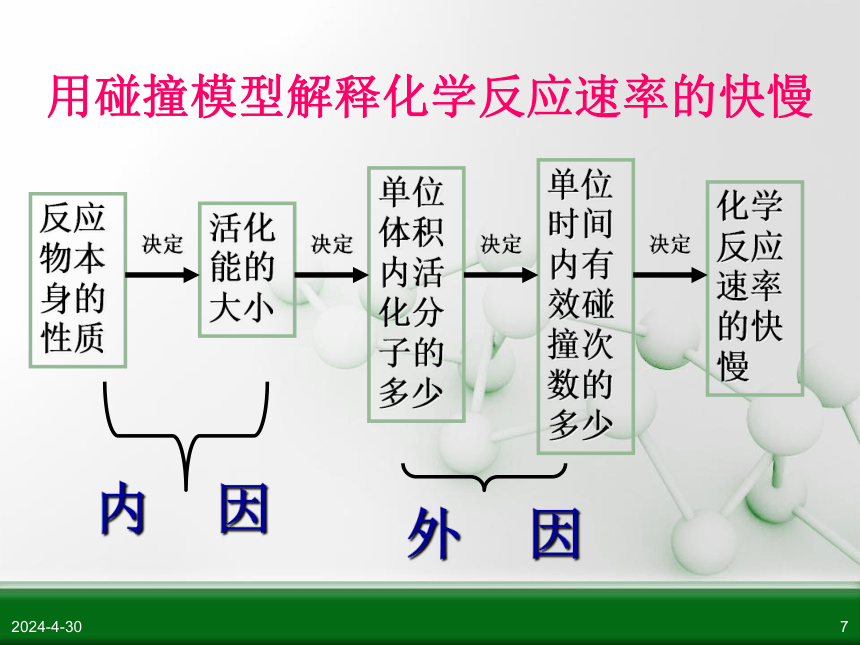
影响化学反应速率的因素
反应物本身的性质
活化能的大小
单位体积内活化分子的多少
单位时间内有效碰撞次数的多少
化学反应速率的快慢
内
因
外
因
用碰撞模型解释化学反应速率的快慢
一、浓度对化学反应速率的影响
0.01mol/L的KMnO4
溶液
0.1mol/LH2C2O4溶液
0.2mol/LH2C2O4溶液
快
慢
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2
↑+8H2O
结
论
其它条件相同时,增加
反应物的浓度,反应速
率加快;反之,降低反
应物的浓度,反应速率
减慢。
增加固体物质或纯液体的量,因其浓度
是个定值,故不影响反应速率(不考虑表
面积的影响)。
碰撞理论解释
浓度对反应速率的影响
浓度增大
→单位体积内n总↑
→单位体积内n活↑
→有效碰撞↑
一定量的盐酸跟过量的铁粉反应时,为了减慢反应速率,而不影响生成H2的总量,可向其中加入适量的
(
)
A.
Na2CO3晶体
B.
NaOH晶体
C.
水
D.
CuSO4晶体
巩固练习
C
二、压强对化学反应速率的影响
对于有气体参加的反应,当其他条件不变时,
增大压强,气体的体积减小,浓度增大,反应
速率加快。
由于压强对固体、液体的体积几乎无影响,
因此,对无气体参加的反应,压强对反应
速率的影响可忽略不计。
压强对反应速率的影响
碰撞理论解释
压强增大
→浓度增大
→单位体积内n活↑
→有效碰撞↑
影响化学反应速率的因素
注意
恒容时加入稀有气体使压强增大,反应物和生成
物的浓度都没有变化,所以化学反应速率不变。
恒压时加入稀有气体使体积增大,反应物和生成
物的浓度都减小,所以化学反应速率减小。
压强的“真变”与“假变”
压强对速率的影响是通过改变气体的浓度来改变的;若压强变化之后,气体的浓度未变,其化学反应速率不变。
在C(固)+CO2(气)=2CO(气)
的反应中。
现采取下列措施:
(1)增大压强
;(2)增加碳的量
(3)通入CO2;
(4)恒容下充入N2;
(5)恒压下充入N2
哪些措施能够使反应速率增大?为什么?
答案:(1)(3)
巩固练习
如下图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下
发生2SO2+O2
2SO3的反应。问:
③
如起始在a、c两容器中通入同量的N2,
则此时三容器起始压强为Pa
___Pb
Pc;
①
起始a、c两容器的反应速率大小关系为Va
___Vc;
②
反应一段时间后a、c中速率大小关系为Va
___Vc
;
=
<
>
=
=
>
起始反应速率关系为Va
___Vb
___Vc
巩固练习
三、温度对化学反应速率的影响
5mL0.1mol/L的H2SO4
+
5mL0.1mol/LNa2S2O3
热水
冷水
快
慢
Na2S2O3+H2SO4
=
Na2SO4
+
SO2
+S↓+
H2O
结
论
其它条件相同时,升高
温度,反应速率加快;
反之,降低温度,反应
速率减慢。
已知:4H++4I-+O2=2I2+2H2O
现有1mol/L
KI溶液、0.1mol/LH2SO4溶液和淀粉溶液,请设计实验探究溶液出现蓝色的时间与温度的关系?
【结论】
其它条件相同时,温度高,出现蓝色的时间短;温度低,出现蓝色的时间长。
一般来说,温度每升高10℃,反应速率
增大到原来的2~4倍。
温度对反应速率的影响
碰撞理论解释
升高温度,一部分非活化分子吸收能量转化为活化分子,使得活化分子百分数提高,活化分子间的有效碰撞频率变大,故反应速率增大。
温度每升高10℃,速率增加2-4倍。
四、催化剂对化学反应速率的影响
【结论】其它条件不变时,选用适当的催化剂可以改变反应速率;正催化剂使反应速率加快,负催化剂使反应速率减慢。
〖探究1〗设计实验比较在2mL
5%的H2O2中加入
FeCl3和CuSO4溶液各1mL,比较二者分解速率?
FeCl3对该反应的催化效果更好
加入试剂
0.1mol/LFeCl3
0.1mol/L
CuSO4
产生气泡快慢
结
论
〖探究2〗设计实验比较在4mL
0.01mol/L
KMnO4
和2mL
0.1mol/L
H2C2O4,加不加MnSO4对反应
速率有否影响?
MnSO4对该反应有催化作用
加入试剂
0.01mol/LKMnO4
0.1mol/LH2C2O4
0.01mol/L
KMnO4
0.1mol/LH2C2O4
MnSO4溶液
褪色时间
结
论
〖探究3〗现有5mL
淀粉溶液、碘水、2mol/L硫酸溶液。
设计实验比较唾液、稀硫酸对反应速率影响效果如何?
蓝色很快褪去
蓝色很难褪去
唾液对该反应的催化效果更好
催化剂是有选择性的
加入试剂
硫酸溶液、淀粉
溶液、碘水
唾液、淀粉溶液
碘水
反应现象
结
论
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
没加催化剂
加了催化剂
催化剂对反应速率的影响
影响化学反应速率的因素小结
增加
增加
增加
加快
增加
增加
增加
加快
不变
增加
增加
加快
不变
增加
增加
加快
影响化学反应速率的因素小结
影响
外因
单位体积内
有效碰撞频率
化学反应速率
分子总数
活化分子数
增大反应物浓度
增大压强
升高温度
正催化剂
(5)固体表面积:块装固体反应速率小于粉末状
固体反应速率。
(6)溶剂的性质、光、超声波、磁场等
增大反应物的浓度使反应速率加快的主要原因(
)
对于气体参与体系增大压强使反应速率加快的主要原因是(
)
升高温度使反应速率加快的主要原因是(
)
使用催化剂使反应速率加快的主要原因是(
)
A、活化分子百分数不变,但提高单位体积内活化分子的总数
B、
增大分子的运动速率而使有效碰撞增加
C、
升高反应物分子的能量,使活化分子的百分数增加
D、降低反应所需的能量,使活化分子百分数增加
A
A
C
D
巩固练习
巩固练习
下列条件的变化,是因为降低反应所需的能量而
增加单位体积内的反应物活化分子百分数致使反
应速率加快的是(
)
A、增大浓度
B、增大压强
C、升高温度
D、使用催化剂
D
随堂练习
1、下列说法正确的是(
)
A、一定条件下,增大反应物的量会加快化学反应速率。
B、增大压强,肯定会加快化学反应速率。
C、活化分子间所发生的碰撞为有效碰撞。
D、能够发生有效碰撞的分子叫活化分子。
D
2.在恒温恒容条件下,能使A(g)+B(g)??C(g)+D(s)正反应速率加快的是(
)
A.减少C或D的物质的量
B.增大D的物质的量
C.减少B的物质的量
D.增大A或B的物质的量
D
把下列四种X溶液分别加入四个盛有10
mL
2
mol/L盐酸的烧杯中,均加水稀释到50
mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10
℃
20
mL
3
mol/L的X溶液
B.20
℃
30
mL
2
mol/L的X溶液
C.10
℃
10
mL
4
mol/L的X溶液
D.10
℃
10
mL
2
mol/L的X溶液
B
4、在下列事实中,什么因素影响了化学反应的速率?
(1)夏天的食物易霉变,冬天就不易发生该现象。
(2)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体。
(3)工业上常将固体燃料粉碎,以提高燃烧效率。
(4)同体积同浓度的硫酸溶液和盐酸溶液与同样大小且质量相同的锌粒反应,产生气体有快有慢。
(5)集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸。
(6)浓硝酸常盛放在棕色瓶里,且放在黑暗处和温度低的地方。
温度
催化剂
接触面积
浓度
光照
光照、温度
5、将一定浓度的盐酸倒入碳酸钙中,若作如下改变的情况,其中能使最初的化学反应速率增大的是
(
)
A、盐酸的浓度不变,而使盐酸的用量一倍
B、盐酸的浓度增大一倍,而使盐酸的用量减少到原来的一半
C、盐酸的浓度和用量都不变,增加碳酸钙的量
D、盐酸和碳酸钙不变,增大压强一倍
E、加入CaCl2溶液
F、加入CaCl2固体
G、将CaCO3用CaCO3粉末代替
BG
第二节
影响化学反应速率的因素
分子
运动
分子具有
足够能量
有合适的取向
n活=n总×活%
有效碰撞理论
反应速率与活化分子的百分率(活%)成正比
序言
P2
能够发生化学反应的碰撞。
有可能发生有效碰撞的分子。
活化分子所多出普通分子的那部分能量E1。
活化能越低,单位体积内活化分子数越多,化
学反应速率就会越快。
有效碰撞:
活化分子:
活化能:
活化能和反应速率的关系:
影响化学反应速率的因素
化学反应的历程
普通
分子
活化
能
活化
分子
合理
取向的
碰撞
有效
碰撞
影响化学反应速率的因素
(1)硫在纯氧中比在空气中燃烧剧烈。
(2)香蕉采摘的时候并不是完全熟的,常用乙烯作为
它的催熟剂。
(3)新鲜的水果和食物保存在冰箱里能存放得更久。
思考与交流
用化学的观点解释下列事实:
(4)煤粉比煤块更容易燃烧。
影响化学反应速率的因素
不同化学反应
的速率
反应物本身性质
(内因)
同一化学反应
的速率
外界条件
(外因)
内因——物质本身的性质(决定性因素)
影响化学反应速率的因素
反应物本身的性质
活化能的大小
单位体积内活化分子的多少
单位时间内有效碰撞次数的多少
化学反应速率的快慢
内
因
外
因
用碰撞模型解释化学反应速率的快慢
一、浓度对化学反应速率的影响
0.01mol/L的KMnO4
溶液
0.1mol/LH2C2O4溶液
0.2mol/LH2C2O4溶液
快
慢
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2
↑+8H2O
结
论
其它条件相同时,增加
反应物的浓度,反应速
率加快;反之,降低反
应物的浓度,反应速率
减慢。
增加固体物质或纯液体的量,因其浓度
是个定值,故不影响反应速率(不考虑表
面积的影响)。
碰撞理论解释
浓度对反应速率的影响
浓度增大
→单位体积内n总↑
→单位体积内n活↑
→有效碰撞↑
一定量的盐酸跟过量的铁粉反应时,为了减慢反应速率,而不影响生成H2的总量,可向其中加入适量的
(
)
A.
Na2CO3晶体
B.
NaOH晶体
C.
水
D.
CuSO4晶体
巩固练习
C
二、压强对化学反应速率的影响
对于有气体参加的反应,当其他条件不变时,
增大压强,气体的体积减小,浓度增大,反应
速率加快。
由于压强对固体、液体的体积几乎无影响,
因此,对无气体参加的反应,压强对反应
速率的影响可忽略不计。
压强对反应速率的影响
碰撞理论解释
压强增大
→浓度增大
→单位体积内n活↑
→有效碰撞↑
影响化学反应速率的因素
注意
恒容时加入稀有气体使压强增大,反应物和生成
物的浓度都没有变化,所以化学反应速率不变。
恒压时加入稀有气体使体积增大,反应物和生成
物的浓度都减小,所以化学反应速率减小。
压强的“真变”与“假变”
压强对速率的影响是通过改变气体的浓度来改变的;若压强变化之后,气体的浓度未变,其化学反应速率不变。
在C(固)+CO2(气)=2CO(气)
的反应中。
现采取下列措施:
(1)增大压强
;(2)增加碳的量
(3)通入CO2;
(4)恒容下充入N2;
(5)恒压下充入N2
哪些措施能够使反应速率增大?为什么?
答案:(1)(3)
巩固练习
如下图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下
发生2SO2+O2
2SO3的反应。问:
③
如起始在a、c两容器中通入同量的N2,
则此时三容器起始压强为Pa
___Pb
Pc;
①
起始a、c两容器的反应速率大小关系为Va
___Vc;
②
反应一段时间后a、c中速率大小关系为Va
___Vc
;
=
<
>
=
=
>
起始反应速率关系为Va
___Vb
___Vc
巩固练习
三、温度对化学反应速率的影响
5mL0.1mol/L的H2SO4
+
5mL0.1mol/LNa2S2O3
热水
冷水
快
慢
Na2S2O3+H2SO4
=
Na2SO4
+
SO2
+S↓+
H2O
结
论
其它条件相同时,升高
温度,反应速率加快;
反之,降低温度,反应
速率减慢。
已知:4H++4I-+O2=2I2+2H2O
现有1mol/L
KI溶液、0.1mol/LH2SO4溶液和淀粉溶液,请设计实验探究溶液出现蓝色的时间与温度的关系?
【结论】
其它条件相同时,温度高,出现蓝色的时间短;温度低,出现蓝色的时间长。
一般来说,温度每升高10℃,反应速率
增大到原来的2~4倍。
温度对反应速率的影响
碰撞理论解释
升高温度,一部分非活化分子吸收能量转化为活化分子,使得活化分子百分数提高,活化分子间的有效碰撞频率变大,故反应速率增大。
温度每升高10℃,速率增加2-4倍。
四、催化剂对化学反应速率的影响
【结论】其它条件不变时,选用适当的催化剂可以改变反应速率;正催化剂使反应速率加快,负催化剂使反应速率减慢。
〖探究1〗设计实验比较在2mL
5%的H2O2中加入
FeCl3和CuSO4溶液各1mL,比较二者分解速率?
FeCl3对该反应的催化效果更好
加入试剂
0.1mol/LFeCl3
0.1mol/L
CuSO4
产生气泡快慢
结
论
〖探究2〗设计实验比较在4mL
0.01mol/L
KMnO4
和2mL
0.1mol/L
H2C2O4,加不加MnSO4对反应
速率有否影响?
MnSO4对该反应有催化作用
加入试剂
0.01mol/LKMnO4
0.1mol/LH2C2O4
0.01mol/L
KMnO4
0.1mol/LH2C2O4
MnSO4溶液
褪色时间
结
论
〖探究3〗现有5mL
淀粉溶液、碘水、2mol/L硫酸溶液。
设计实验比较唾液、稀硫酸对反应速率影响效果如何?
蓝色很快褪去
蓝色很难褪去
唾液对该反应的催化效果更好
催化剂是有选择性的
加入试剂
硫酸溶液、淀粉
溶液、碘水
唾液、淀粉溶液
碘水
反应现象
结
论
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
没加催化剂
加了催化剂
催化剂对反应速率的影响
影响化学反应速率的因素小结
增加
增加
增加
加快
增加
增加
增加
加快
不变
增加
增加
加快
不变
增加
增加
加快
影响化学反应速率的因素小结
影响
外因
单位体积内
有效碰撞频率
化学反应速率
分子总数
活化分子数
增大反应物浓度
增大压强
升高温度
正催化剂
(5)固体表面积:块装固体反应速率小于粉末状
固体反应速率。
(6)溶剂的性质、光、超声波、磁场等
增大反应物的浓度使反应速率加快的主要原因(
)
对于气体参与体系增大压强使反应速率加快的主要原因是(
)
升高温度使反应速率加快的主要原因是(
)
使用催化剂使反应速率加快的主要原因是(
)
A、活化分子百分数不变,但提高单位体积内活化分子的总数
B、
增大分子的运动速率而使有效碰撞增加
C、
升高反应物分子的能量,使活化分子的百分数增加
D、降低反应所需的能量,使活化分子百分数增加
A
A
C
D
巩固练习
巩固练习
下列条件的变化,是因为降低反应所需的能量而
增加单位体积内的反应物活化分子百分数致使反
应速率加快的是(
)
A、增大浓度
B、增大压强
C、升高温度
D、使用催化剂
D
随堂练习
1、下列说法正确的是(
)
A、一定条件下,增大反应物的量会加快化学反应速率。
B、增大压强,肯定会加快化学反应速率。
C、活化分子间所发生的碰撞为有效碰撞。
D、能够发生有效碰撞的分子叫活化分子。
D
2.在恒温恒容条件下,能使A(g)+B(g)??C(g)+D(s)正反应速率加快的是(
)
A.减少C或D的物质的量
B.增大D的物质的量
C.减少B的物质的量
D.增大A或B的物质的量
D
把下列四种X溶液分别加入四个盛有10
mL
2
mol/L盐酸的烧杯中,均加水稀释到50
mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10
℃
20
mL
3
mol/L的X溶液
B.20
℃
30
mL
2
mol/L的X溶液
C.10
℃
10
mL
4
mol/L的X溶液
D.10
℃
10
mL
2
mol/L的X溶液
B
4、在下列事实中,什么因素影响了化学反应的速率?
(1)夏天的食物易霉变,冬天就不易发生该现象。
(2)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体。
(3)工业上常将固体燃料粉碎,以提高燃烧效率。
(4)同体积同浓度的硫酸溶液和盐酸溶液与同样大小且质量相同的锌粒反应,产生气体有快有慢。
(5)集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸。
(6)浓硝酸常盛放在棕色瓶里,且放在黑暗处和温度低的地方。
温度
催化剂
接触面积
浓度
光照
光照、温度
5、将一定浓度的盐酸倒入碳酸钙中,若作如下改变的情况,其中能使最初的化学反应速率增大的是
(
)
A、盐酸的浓度不变,而使盐酸的用量一倍
B、盐酸的浓度增大一倍,而使盐酸的用量减少到原来的一半
C、盐酸的浓度和用量都不变,增加碳酸钙的量
D、盐酸和碳酸钙不变,增大压强一倍
E、加入CaCl2溶液
F、加入CaCl2固体
G、将CaCO3用CaCO3粉末代替
BG
