高中化学人教版(新课标)选修4 第一章第一节 化学反应与能量变化 练习(含解析)
文档属性
| 名称 | 高中化学人教版(新课标)选修4 第一章第一节 化学反应与能量变化 练习(含解析) |

|
|
| 格式 | doc | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-17 00:00:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
高中化学人教版(新课标)选修4 第一章第一节 化学反应与能量变化
一、单选题
1.有关化学反应中的能量变化,下列叙述正确的是(??? )
A.?酸碱中和反应是吸热反应
B.?反应过程中化学键的断裂释放能量
C.?反应过程中化学键的形成释放能量
D.?将Ba(OH)2·8H2O晶体与NH4Cl晶体的混合搅拌会放出大量热2-1-c-n-j-y
2.下列反应过程中的能量变化与图一致的是(?? )
A.?2H2O 2H2↑ + O2↑????B.?在加热条件下氢气还原氧化铜?????C.?胆矾受热分解?????D.?铝热反应
3.关于下列 的判断正确的是(??? )
?
?
?
?
A.?????????????B.??????????????C.???????????????D.?
4.已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的(??? )
A.?X的能量一定高于M???????????????????????????????????????????
B.?Y的能量一定高于N
C.?X和Y的总能量一定高于M和N的总能量????????????
D.?因该反应为放热反应,故不必加热就可发生反应
5.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-565.2 kJ·molˉ1 , 下列说法错误的是(? )
A.?CO(g)+ O2(g)=CO2(g) ΔH=-282.6 kJ·molˉ1
B.?2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ
C.?相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量
D.?拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量
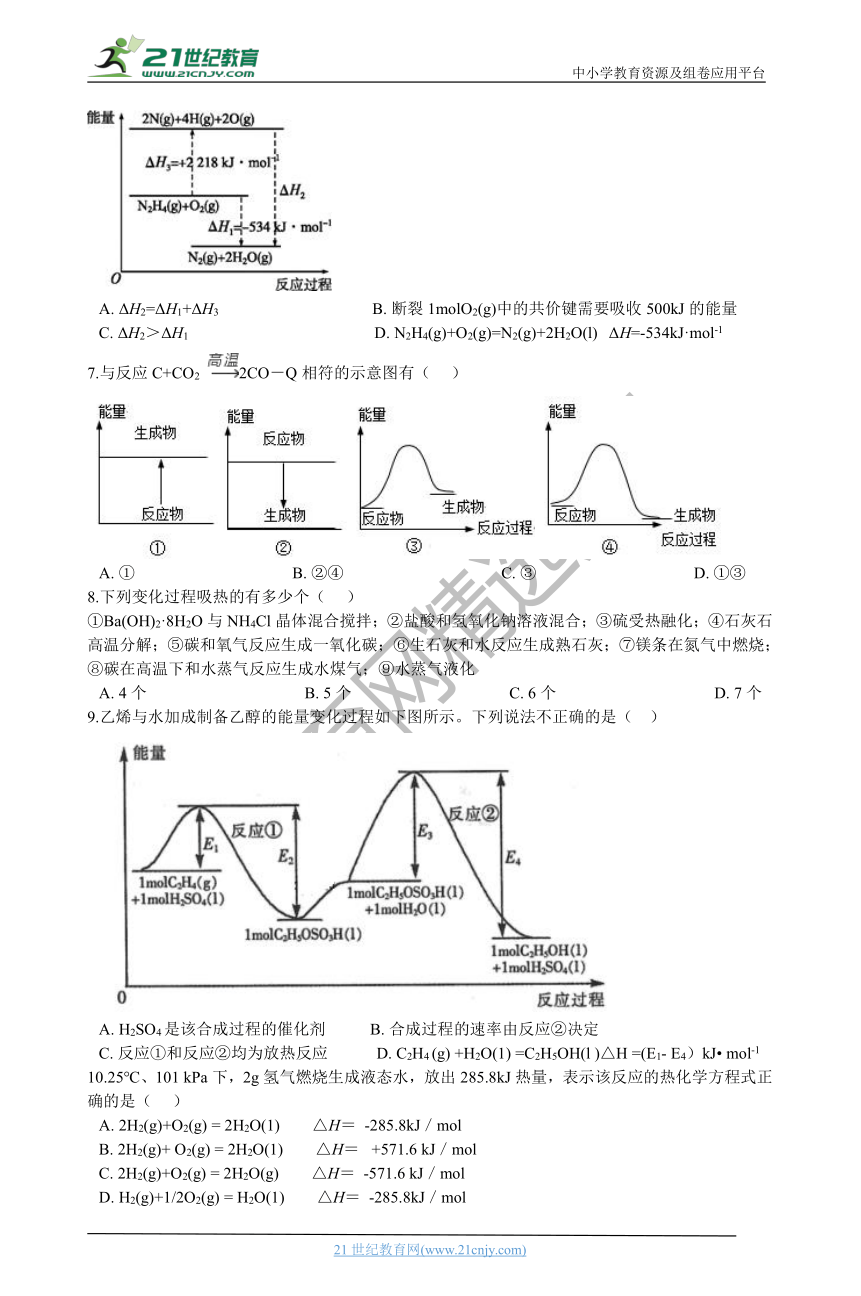
6.已知断裂1mol化学键所需的能量(kJ):N≡N键为942、N—N键为154、N—H键为391、H—O键为463。有关化学反应的能量变化如图所示。下列说法正确的是(?? )
A.?ΔH2=ΔH1+ΔH3??????????????????????????????????????B.?断裂1molO2(g)中的共价键需要吸收500kJ的能量
C.?ΔH2>ΔH1??????????????????????????????????????????????D.?N2H4(g)+O2(g)=N2(g)+2H2O(l)? ΔH=-534kJ·mol-1
7.与反应C+CO2 2CO-Q相符的示意图有(??? )
A.?①???????????????????????????????????????B.?②④???????????????????????????????????????C.?③???????????????????????????????????????D.?①③
8.下列变化过程吸热的有多少个( ???)
①Ba(OH)2·8H2O与NH4Cl晶体混合搅拌;②盐酸和氢氧化钠溶液混合;③硫受热融化;④石灰石高温分解;⑤碳和氧气反应生成一氧化碳;⑥生石灰和水反应生成熟石灰;⑦镁条在氮气中燃烧;⑧碳在高温下和水蒸气反应生成水煤气;⑨水蒸气液化
A.?4个???????????????????????????????????????B.?5个???????????????????????????????????????C.?6个???????????????????????????????????????D.?7个
9.乙烯与水加成制备乙醇的能量变化过程如下图所示。下列说法不正确的是( ??)
A.?H2SO4是该合成过程的催化剂???????????B.?合成过程的速率由反应②决定
C.?反应①和反应②均为放热反应????????????D.?C2H4 (g) +H2O(1) =C2H5OH(l )△H =(E1- E4)kJ? mol-1
10.25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是(??? )
A.?2H2(g)+O2(g) = 2H2O(1)?????? △H= -285.8kJ/mol
B.?2H2(g)+ O2(g) = 2H2O(1)?????? △H=? +571.6 kJ/mol
C.?2H2(g)+O2(g) = 2H2O(g)?????? △H= -571.6 kJ/mol
D.?H2(g)+1/2O2(g) = H2O(1)?????? △H= -285.8kJ/mol
二、综合题
11.25mL 0.5mol/L的硫酸与50mL 0.55mol/L的NaOH溶液在右图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算反应热。请回答下列问题: www-2-1-cnjy-com
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________;
由图可知该装置有不妥之处,应如何改进?________。
(2)若量取碱的时候仰视读数,则求得的中和热△H________(填“偏大”、“偏小’、“无影响”下同) 。若用相同浓度和体积的氨水代替NaOH进行上述实验,测得中和热△H________。
(3)设混合溶液的比热容为c kJ/(g.℃) .硫酸和NaOH溶液的密度认为都是1g·cm-3 , 若实验过程中,测得硫酸和NaOH溶液的起始温度的平均值为T1℃。溶液混合后的最高温度为T2℃,试写出该实验中,中和热表达式△H=________。(化成最简式) 21教育网
12.某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol/L盐酸、0.55 mol/L NaOH溶液,实验尚缺少的玻璃用品是________、________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?________(填“能”或“否”),其原因是________。
(3)他们记录的实验数据如表:
实验用品 溶液温度 中和热
t1 t2
ΔH
① 50 mL
0.55 mol/L
NaOH溶液 50 mL
0.5 mol/L
HCl溶液 20 ℃ 23.3 ℃ ________
② 50 mL
0.55 mol/L
NaOH溶液 50 mL
0.5 mol/L
HCl溶液 20 ℃ 23.5 ℃
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ/(℃·kg),各物质的密度均为1 g/cm3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:________。
(4)若用KOH代替NaOH,对测定结果________
(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果________(填“有”或“无”)影响。
三、计算题
13.溶液与 锌粉在量热计中充分反应。测得反应前温度为 ,反应后最高温度为 。
已知:反应前后,溶液的比热容均近似为 、溶液的密度均近似为 ,忽略溶液体积、质量变化和金属吸收的热量。请计算:21世纪教育网版权所有
(1)反应放出的热量 ________J。
(2)反应 的 ________ (列式计算)。
答案解析部分
一、单选题
1. C
解析:A.酸碱中和反应是典型的放热反应,A不符合题意;
B.反应过程中化学键的断裂吸收能量,B不符合题意;
C.反应过程中化学键的形成释放能量,C符合题意;
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应是典型的吸热反应,D不符合题意。
故答案为:C
分析:常见的放热反应:①可燃物的燃烧反应;②酸碱中和反应;③大多数化合反应;④金属跟酸的置换反应;⑤物质的缓慢氧化。
常见吸热反应:①大多数分解反应;②盐的水解和弱电解质的电离;③Ba(OH)2·8H2O与NH4Cl的反应;④碳和水蒸气、C和CO2的反应。⑤一般用C、 CO 和H2还原金属氧化物的反应。
2. D
解析:A、电解时,电能转化为化学能,为吸热反应,故A不选;
B、在加热条件下氢气还原氧化铜为吸热反应,故B不选;
C、胆矾受热分解为吸热反应,故C不选;
D、铝热反应为放热反应,符合图像,故D选。
故答案为:D。
分析:由图可知,反应物能量大于生成物能量,因此该反应为放热反应,常见的放热反应有:所有的燃烧反应,金属与酸或水的反应、酸碱中和反应、铝热反应、多数的化合反应等,其△H<0。常见的吸热反应:Ba(OH)2?8H2O与NH4Cl晶体混合反应、水解反应、大多数的分解反应、以C、CO、H2作为还原剂的反应等,以此解答该题。21cnjy.com
3. B
解析:碳酸氢根的电离属于吸热过程,则CO (aq)+H+(aq)=HCO (aq)为放热反应,所以△H1<0;
CO (aq)+H2O(l) HCO (aq)+OHˉ(aq)为碳酸根的水解离子方程式,CO 的水解反应为吸热反应,所以△H2>0;
OHˉ(aq)+H+(aq)=H2O(l)表示强酸和强碱的中和反应,为放热反应,所以△H3<0;
醋酸与强碱的中和反应为放热反应,所以△H4<0;
但由于醋酸是弱酸,电离过程中会吸收部分热量,所以醋酸与强碱反应过程放出的热量小于强酸和强碱反应放出的热量,则△H4>△H3;
综上所述,只有△H1<△H2符合题意,B符合题意;
故答案为:B
分析:电离过程吸热,则化合过程为放热反应;升温有利于水解,所以水解反应为吸热反应;强酸和强碱的中和反应,为放热反应;
醋酸与强碱的中和反应为放热反应,所以△H4<0;弱电解质电离过程中会吸收部分热量,所以弱酸和强碱反应中和放出的热量比强酸和强碱反应放出的热量少。21·cn·jy·com
4. C
解析:A.由分析可知,该反应中,X和Y的总能量大于M和N的总能量,而X和M的能量高低无法确定,A不符合题意; www.21-cn-jy.com
B.由分析可知,该反应中,X和Y的总能量大于M和N的总能量,而Y和N的能量高低无法确定,B不符合题意;2·1·c·n·j·y
C.由分析可知,该反应中,X和Y的总能量大于M和N的总能量,C符合题意;
D.某些放热反应需要加热才能促使反应发生,并不是所有的放热反应都不需要加热,D不符合题意;
故答案为:C
分析:该反应为放热反应,说明反应物(X和Y)的总能量大于生成物(M和N)的总能量,据此结合选项进行分析。【来源:21·世纪·教育·网】
5. B
解析:A、反应热的大小与物质的量成正比例,所以1mol一氧化碳燃烧放出的热量为:282.6 kJ,则反应热的化学方程式为CO(g)+ O2(g)═CO2(g)△H=-282.6 kJ?molˉ1 , 故A不符合题意;
B、气体变成固体要放出热量,所以2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量大于565.2 kJ,故B符合题意;21*cnjy*com
C、正反应是放热反应所以反应物的总能量高于生成物的总能量,所以2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量,故C不符合题意;
D、根据化学反应的实质,因为反应物总能量大于生成物总能量,该反应为放热反应,则拆开反应物所有键所吸收的总能量小于形成生成物所放出的总能量,故D不符合题意;
故答案为:B。
分析:A、反应热的大小与物质的量成正比;
B、气体变成固体,要放出热量;
C、正反应是放热反应,反应物的总能量高于生成物的总能量;
D、根据化学反应的实质,因为反应物总能量大于生成物总能量,该反应为放热反应,拆开反应物所有化学键所吸收的总能量小于形成化学键所放出的总能量。
6. B
解析:A.由图可知,ΔH2=ΔH1-ΔH3 , 故A不符合题意;
B.N2H4(g)+O2(g)= 2N (g)+4H(g)+2O(g) ΔH=2218kJ·mol-1 , 由图可知,断裂1molN—N键需要154 kJ的能量、断裂1molN—H键需要391 kJ的能量、断裂1molH—O键需要463 kJ的能量,故断裂1molO2(g)中的共价键需要x kJ的能量,1mol肼的分子中含有1molN—N键和4molN—H键,反应物化学键断裂时吸收的总能量-形成化学键释放的总能量=焓变,154 kJ+391 kJ×4+x=2218kJ,解得x=500 kJ,故B符合题意;
C.由图可知,ΔH2=ΔH1-ΔH3=-534 kJ/mol- 2218 kJ/mol=-2752 kJ/mol,ΔH1=-534kJ·mol-1
ΔH2<ΔH1 , 故C不符合题意;
D.根据图像可知,N2H4(g)+O2(g)=N2(g)+2H2O(g)? ΔH=-534kJ·mol-1 , 由于气态水液化继续放热,N2H4(g)+O2(g)=N2(g)+2H2O(l)? ΔH=-534kJ·mol-1 , 故D不符合题意;
故答案为:B。
分析:反应放热还是吸热,主要是比较反应物和生成物能量的相对大小,还有用断裂反应物化学键吸收的总能量减去形成化学键释放的总能量来计算,如果是放热反应,是负值,放出的热量越多,数值越小。【来源:21cnj*y.co*m】
7. D
解析:反应C+CO2 2CO-Q为吸热反应,反应物的总能量低于生成物的总能量,根据图象,①③中反应物的总能量低于生成物的总能量,属于吸热反应,②④中反应物的总能量高于生成物的总能量,属于放热反应,
故答案为:D。
分析:吸热反应的特点:生成物的能量一定高于反应物的能量,根据示意图可知①③为吸热反应。
8. A
解析:①Ba(OH)2·8H2O与NH4Cl的反应为吸热反应,①符合题意;
②盐酸和NaOH溶液的反应为酸碱中和反应,属于放热反应,②不符合题意;
③硫受热融化需要吸收能量,因此过程中吸热,③符合题意;
④石灰石高温分解为吸热反应,④符合题意;
⑤碳和氧气的反应生成CO,为燃烧反应,燃烧反应都是放热反应,⑤不符合题意;
⑥生石灰与水的反应为放热反应,⑥不符合题意;
⑦镁条在氮气中燃烧,燃烧反应属于放热反应,⑦不符合题意;
⑧碳在高温下和水蒸气反应生成水煤气,该反应为吸热反应,⑧符合题意;
⑨水蒸气液化过程放热,⑨不符合题意;
综上,上述变化过程中吸热的有①③④⑧,共4个,A符合题意;
故答案为:A
分析:根据所给反应的热效应进行分析即可得出答案。
9. D
解析:A.1molH2SO4在反应①中和乙烯发生了加成反应,在反应②中又生成了1molH2SO4 , 所以H2SO4是该合成过程的催化剂,A不符合题意;
B.反应②的活化能大于反应①,活化能越大,反应速率越慢,所以反应②速率慢,合成过程的速率由反应②决定,B不符合题意;
C.从图中可以看出,反应①和反应②的反应物的总能量都高于生成物的总能量,均为放热反应,C不符合题意;
D.从图中可以看出,总反应C2H4 (g) +H2O(l) =C2H5OH(l )的△H =( E1- E2+E3- E4)kJ? mol-1 , D符合题意;
故答案为:D。
分析:催化剂是能改变反应速率,在反应前后质量和化学性质都不变的物质。很多催化剂都参加反应,但最终会在回到最初的状态,即质量和化学性质不变。在该反应中,硫酸就是催化剂。
10. D
解析:放出热量说明反应热△H<0,2g氢气燃烧生成液态水,放出285.8kJ热量,说明消耗1molH2 , 放出285.8 kJ·mol-1 , 【版权所有:21教育】
故答案为:D
分析:热化学反应方程式的反应热与化学方程式的计量数成正比。
二、综合题
11. (1)环形玻璃搅拌棒;①小烧杯上沿紧贴硬纸板②碎泡沫塑料填充满大烧杯
(2)偏大;偏大
(3)-3000c(T2-T1)kJ/mol或3000c(T1-T2)kJ/mol 21*cnjy*com
解析:(1)从实验装置看,该实验中缺少环形玻璃搅拌棒,用于搅拌溶液,使之混合均匀;同时,装置中大小烧杯之间存在间隙,易导致热量散失,应将小烧杯上沿紧贴硬纸板,同时使用碎泡沫塑料填充满大烧杯。
(2)若量取NaOH溶液时仰视读数,则所量取NaOH溶液的体积偏大,反应过程中放出的热量增大,求得中和热ΔH偏小;
若用氨水代替NaOH,由于NH3·H2O是弱碱,其电离过程需要吸热,导致反应过程中放出的热量减小,求得中和热ΔH偏大;
(3)反应生成0.025molH2O时放出的热量为:c×(50+25)×1×(T2-T1)=75c(T2-T1)kJ,因此生成1molH2O时的反应热ΔH=。
分析:此题是对中和热测定实验的考查,解答此题时,应结合中和热的定义和实验测定过程进行分析。
12. (1)量筒;温度计
(2)否;金属易导热,热量散失多,导致误差偏大
(3)-56.8 kJ/mol;NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-56.8 kJ/mol
(4)无;有
解析:(1)由于实验过程中需要量取液体的体积和测量溶液的温度,因此所需的玻璃仪器还有量筒和温度计;
(2)金属铜的导热性较强,为防止热量的散失,不能用环形铜丝搅拌器代替环形玻璃搅拌棒;
(3)①反应过程中,温度变化为, 因此反应过程中放出的热量Q=cm(t2-t1)=4.18kJ/(℃·kg)×100×10-3kg×3.4℃=1.4212kJ,该反应过程中生成n(H2O)=0.025mol,因此可得该实验测得中和热;
②中和热是指强酸和强碱的稀溶液反应生成1molH2O(l)时放出的热量,因此该反应的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)?? ΔH=-56.8 kJ/mol;
(4)KOH和NaOH都是强碱,用KOH代替NaOH,对测定结果无影响;醋酸是弱酸,在水中存在电离平衡,为吸热过程,用醋酸代替HCl,会导致中和反应放出的热量部分被CH3COOH的电离吸收,导致测定结果出现误差;
分析:此题是对中和热测定实验的考查,结合该实验的相关知识进行分析即可。
三、计算题
13. (1)
(2)
解析:(1)100mL 0.200mol/L CuSO4溶液与1.95g锌粉发生反应的化学方程式为:CuSO4+Zn=ZnSO4+Cu,忽略溶液体积、质量变化可知,溶液的质量m= =1.00g/cm3×100mL(cm3)=100g,忽略金属吸收的热量可知,反应放出的热量Q=cm =4.18 ×100g×(30.1-20.1) = 4.18×103J,故答案为:4.18×103;(2)上述反应中硫酸铜的物质的量n(CuSO4)= 0.200mol/L×0.100L=0.020mol,锌粉的物质的量n(Zn)= =0.030mol,由此可知,锌粉过量。根据题干与第(1)问可知,转化0.020mol硫酸铜所放出的热量为4.18×103J,又因为该反应中焓变 代表反应1mol硫酸铜参加反应放出的热量,单位为kJ/mol,则可列出计算式为: ,故答案为: (答案符合要求且合理即可)。 21教育名师原创作品
分析:(1)根据中和滴定实验的原理可知,该反应放出的热量可根据Q=cm 计算;(2)结合焓变的概念及其与化学计量数之间的关系列式计算。
_21?????????è?????(www.21cnjy.com)_
高中化学人教版(新课标)选修4 第一章第一节 化学反应与能量变化
一、单选题
1.有关化学反应中的能量变化,下列叙述正确的是(??? )
A.?酸碱中和反应是吸热反应
B.?反应过程中化学键的断裂释放能量
C.?反应过程中化学键的形成释放能量
D.?将Ba(OH)2·8H2O晶体与NH4Cl晶体的混合搅拌会放出大量热2-1-c-n-j-y
2.下列反应过程中的能量变化与图一致的是(?? )
A.?2H2O 2H2↑ + O2↑????B.?在加热条件下氢气还原氧化铜?????C.?胆矾受热分解?????D.?铝热反应
3.关于下列 的判断正确的是(??? )
?
?
?
?
A.?????????????B.??????????????C.???????????????D.?
4.已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的(??? )
A.?X的能量一定高于M???????????????????????????????????????????
B.?Y的能量一定高于N
C.?X和Y的总能量一定高于M和N的总能量????????????
D.?因该反应为放热反应,故不必加热就可发生反应
5.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-565.2 kJ·molˉ1 , 下列说法错误的是(? )
A.?CO(g)+ O2(g)=CO2(g) ΔH=-282.6 kJ·molˉ1
B.?2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ
C.?相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量
D.?拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量
6.已知断裂1mol化学键所需的能量(kJ):N≡N键为942、N—N键为154、N—H键为391、H—O键为463。有关化学反应的能量变化如图所示。下列说法正确的是(?? )
A.?ΔH2=ΔH1+ΔH3??????????????????????????????????????B.?断裂1molO2(g)中的共价键需要吸收500kJ的能量
C.?ΔH2>ΔH1??????????????????????????????????????????????D.?N2H4(g)+O2(g)=N2(g)+2H2O(l)? ΔH=-534kJ·mol-1
7.与反应C+CO2 2CO-Q相符的示意图有(??? )
A.?①???????????????????????????????????????B.?②④???????????????????????????????????????C.?③???????????????????????????????????????D.?①③
8.下列变化过程吸热的有多少个( ???)
①Ba(OH)2·8H2O与NH4Cl晶体混合搅拌;②盐酸和氢氧化钠溶液混合;③硫受热融化;④石灰石高温分解;⑤碳和氧气反应生成一氧化碳;⑥生石灰和水反应生成熟石灰;⑦镁条在氮气中燃烧;⑧碳在高温下和水蒸气反应生成水煤气;⑨水蒸气液化
A.?4个???????????????????????????????????????B.?5个???????????????????????????????????????C.?6个???????????????????????????????????????D.?7个
9.乙烯与水加成制备乙醇的能量变化过程如下图所示。下列说法不正确的是( ??)
A.?H2SO4是该合成过程的催化剂???????????B.?合成过程的速率由反应②决定
C.?反应①和反应②均为放热反应????????????D.?C2H4 (g) +H2O(1) =C2H5OH(l )△H =(E1- E4)kJ? mol-1
10.25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是(??? )
A.?2H2(g)+O2(g) = 2H2O(1)?????? △H= -285.8kJ/mol
B.?2H2(g)+ O2(g) = 2H2O(1)?????? △H=? +571.6 kJ/mol
C.?2H2(g)+O2(g) = 2H2O(g)?????? △H= -571.6 kJ/mol
D.?H2(g)+1/2O2(g) = H2O(1)?????? △H= -285.8kJ/mol
二、综合题
11.25mL 0.5mol/L的硫酸与50mL 0.55mol/L的NaOH溶液在右图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算反应热。请回答下列问题: www-2-1-cnjy-com
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________;
由图可知该装置有不妥之处,应如何改进?________。
(2)若量取碱的时候仰视读数,则求得的中和热△H________(填“偏大”、“偏小’、“无影响”下同) 。若用相同浓度和体积的氨水代替NaOH进行上述实验,测得中和热△H________。
(3)设混合溶液的比热容为c kJ/(g.℃) .硫酸和NaOH溶液的密度认为都是1g·cm-3 , 若实验过程中,测得硫酸和NaOH溶液的起始温度的平均值为T1℃。溶液混合后的最高温度为T2℃,试写出该实验中,中和热表达式△H=________。(化成最简式) 21教育网
12.某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol/L盐酸、0.55 mol/L NaOH溶液,实验尚缺少的玻璃用品是________、________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?________(填“能”或“否”),其原因是________。
(3)他们记录的实验数据如表:
实验用品 溶液温度 中和热
t1 t2
ΔH
① 50 mL
0.55 mol/L
NaOH溶液 50 mL
0.5 mol/L
HCl溶液 20 ℃ 23.3 ℃ ________
② 50 mL
0.55 mol/L
NaOH溶液 50 mL
0.5 mol/L
HCl溶液 20 ℃ 23.5 ℃
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ/(℃·kg),各物质的密度均为1 g/cm3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:________。
(4)若用KOH代替NaOH,对测定结果________
(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果________(填“有”或“无”)影响。
三、计算题
13.溶液与 锌粉在量热计中充分反应。测得反应前温度为 ,反应后最高温度为 。
已知:反应前后,溶液的比热容均近似为 、溶液的密度均近似为 ,忽略溶液体积、质量变化和金属吸收的热量。请计算:21世纪教育网版权所有
(1)反应放出的热量 ________J。
(2)反应 的 ________ (列式计算)。
答案解析部分
一、单选题
1. C
解析:A.酸碱中和反应是典型的放热反应,A不符合题意;
B.反应过程中化学键的断裂吸收能量,B不符合题意;
C.反应过程中化学键的形成释放能量,C符合题意;
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应是典型的吸热反应,D不符合题意。
故答案为:C
分析:常见的放热反应:①可燃物的燃烧反应;②酸碱中和反应;③大多数化合反应;④金属跟酸的置换反应;⑤物质的缓慢氧化。
常见吸热反应:①大多数分解反应;②盐的水解和弱电解质的电离;③Ba(OH)2·8H2O与NH4Cl的反应;④碳和水蒸气、C和CO2的反应。⑤一般用C、 CO 和H2还原金属氧化物的反应。
2. D
解析:A、电解时,电能转化为化学能,为吸热反应,故A不选;
B、在加热条件下氢气还原氧化铜为吸热反应,故B不选;
C、胆矾受热分解为吸热反应,故C不选;
D、铝热反应为放热反应,符合图像,故D选。
故答案为:D。
分析:由图可知,反应物能量大于生成物能量,因此该反应为放热反应,常见的放热反应有:所有的燃烧反应,金属与酸或水的反应、酸碱中和反应、铝热反应、多数的化合反应等,其△H<0。常见的吸热反应:Ba(OH)2?8H2O与NH4Cl晶体混合反应、水解反应、大多数的分解反应、以C、CO、H2作为还原剂的反应等,以此解答该题。21cnjy.com
3. B
解析:碳酸氢根的电离属于吸热过程,则CO (aq)+H+(aq)=HCO (aq)为放热反应,所以△H1<0;
CO (aq)+H2O(l) HCO (aq)+OHˉ(aq)为碳酸根的水解离子方程式,CO 的水解反应为吸热反应,所以△H2>0;
OHˉ(aq)+H+(aq)=H2O(l)表示强酸和强碱的中和反应,为放热反应,所以△H3<0;
醋酸与强碱的中和反应为放热反应,所以△H4<0;
但由于醋酸是弱酸,电离过程中会吸收部分热量,所以醋酸与强碱反应过程放出的热量小于强酸和强碱反应放出的热量,则△H4>△H3;
综上所述,只有△H1<△H2符合题意,B符合题意;
故答案为:B
分析:电离过程吸热,则化合过程为放热反应;升温有利于水解,所以水解反应为吸热反应;强酸和强碱的中和反应,为放热反应;
醋酸与强碱的中和反应为放热反应,所以△H4<0;弱电解质电离过程中会吸收部分热量,所以弱酸和强碱反应中和放出的热量比强酸和强碱反应放出的热量少。21·cn·jy·com
4. C
解析:A.由分析可知,该反应中,X和Y的总能量大于M和N的总能量,而X和M的能量高低无法确定,A不符合题意; www.21-cn-jy.com
B.由分析可知,该反应中,X和Y的总能量大于M和N的总能量,而Y和N的能量高低无法确定,B不符合题意;2·1·c·n·j·y
C.由分析可知,该反应中,X和Y的总能量大于M和N的总能量,C符合题意;
D.某些放热反应需要加热才能促使反应发生,并不是所有的放热反应都不需要加热,D不符合题意;
故答案为:C
分析:该反应为放热反应,说明反应物(X和Y)的总能量大于生成物(M和N)的总能量,据此结合选项进行分析。【来源:21·世纪·教育·网】
5. B
解析:A、反应热的大小与物质的量成正比例,所以1mol一氧化碳燃烧放出的热量为:282.6 kJ,则反应热的化学方程式为CO(g)+ O2(g)═CO2(g)△H=-282.6 kJ?molˉ1 , 故A不符合题意;
B、气体变成固体要放出热量,所以2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量大于565.2 kJ,故B符合题意;21*cnjy*com
C、正反应是放热反应所以反应物的总能量高于生成物的总能量,所以2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量,故C不符合题意;
D、根据化学反应的实质,因为反应物总能量大于生成物总能量,该反应为放热反应,则拆开反应物所有键所吸收的总能量小于形成生成物所放出的总能量,故D不符合题意;
故答案为:B。
分析:A、反应热的大小与物质的量成正比;
B、气体变成固体,要放出热量;
C、正反应是放热反应,反应物的总能量高于生成物的总能量;
D、根据化学反应的实质,因为反应物总能量大于生成物总能量,该反应为放热反应,拆开反应物所有化学键所吸收的总能量小于形成化学键所放出的总能量。
6. B
解析:A.由图可知,ΔH2=ΔH1-ΔH3 , 故A不符合题意;
B.N2H4(g)+O2(g)= 2N (g)+4H(g)+2O(g) ΔH=2218kJ·mol-1 , 由图可知,断裂1molN—N键需要154 kJ的能量、断裂1molN—H键需要391 kJ的能量、断裂1molH—O键需要463 kJ的能量,故断裂1molO2(g)中的共价键需要x kJ的能量,1mol肼的分子中含有1molN—N键和4molN—H键,反应物化学键断裂时吸收的总能量-形成化学键释放的总能量=焓变,154 kJ+391 kJ×4+x=2218kJ,解得x=500 kJ,故B符合题意;
C.由图可知,ΔH2=ΔH1-ΔH3=-534 kJ/mol- 2218 kJ/mol=-2752 kJ/mol,ΔH1=-534kJ·mol-1
ΔH2<ΔH1 , 故C不符合题意;
D.根据图像可知,N2H4(g)+O2(g)=N2(g)+2H2O(g)? ΔH=-534kJ·mol-1 , 由于气态水液化继续放热,N2H4(g)+O2(g)=N2(g)+2H2O(l)? ΔH=-534kJ·mol-1 , 故D不符合题意;
故答案为:B。
分析:反应放热还是吸热,主要是比较反应物和生成物能量的相对大小,还有用断裂反应物化学键吸收的总能量减去形成化学键释放的总能量来计算,如果是放热反应,是负值,放出的热量越多,数值越小。【来源:21cnj*y.co*m】
7. D
解析:反应C+CO2 2CO-Q为吸热反应,反应物的总能量低于生成物的总能量,根据图象,①③中反应物的总能量低于生成物的总能量,属于吸热反应,②④中反应物的总能量高于生成物的总能量,属于放热反应,
故答案为:D。
分析:吸热反应的特点:生成物的能量一定高于反应物的能量,根据示意图可知①③为吸热反应。
8. A
解析:①Ba(OH)2·8H2O与NH4Cl的反应为吸热反应,①符合题意;
②盐酸和NaOH溶液的反应为酸碱中和反应,属于放热反应,②不符合题意;
③硫受热融化需要吸收能量,因此过程中吸热,③符合题意;
④石灰石高温分解为吸热反应,④符合题意;
⑤碳和氧气的反应生成CO,为燃烧反应,燃烧反应都是放热反应,⑤不符合题意;
⑥生石灰与水的反应为放热反应,⑥不符合题意;
⑦镁条在氮气中燃烧,燃烧反应属于放热反应,⑦不符合题意;
⑧碳在高温下和水蒸气反应生成水煤气,该反应为吸热反应,⑧符合题意;
⑨水蒸气液化过程放热,⑨不符合题意;
综上,上述变化过程中吸热的有①③④⑧,共4个,A符合题意;
故答案为:A
分析:根据所给反应的热效应进行分析即可得出答案。
9. D
解析:A.1molH2SO4在反应①中和乙烯发生了加成反应,在反应②中又生成了1molH2SO4 , 所以H2SO4是该合成过程的催化剂,A不符合题意;
B.反应②的活化能大于反应①,活化能越大,反应速率越慢,所以反应②速率慢,合成过程的速率由反应②决定,B不符合题意;
C.从图中可以看出,反应①和反应②的反应物的总能量都高于生成物的总能量,均为放热反应,C不符合题意;
D.从图中可以看出,总反应C2H4 (g) +H2O(l) =C2H5OH(l )的△H =( E1- E2+E3- E4)kJ? mol-1 , D符合题意;
故答案为:D。
分析:催化剂是能改变反应速率,在反应前后质量和化学性质都不变的物质。很多催化剂都参加反应,但最终会在回到最初的状态,即质量和化学性质不变。在该反应中,硫酸就是催化剂。
10. D
解析:放出热量说明反应热△H<0,2g氢气燃烧生成液态水,放出285.8kJ热量,说明消耗1molH2 , 放出285.8 kJ·mol-1 , 【版权所有:21教育】
故答案为:D
分析:热化学反应方程式的反应热与化学方程式的计量数成正比。
二、综合题
11. (1)环形玻璃搅拌棒;①小烧杯上沿紧贴硬纸板②碎泡沫塑料填充满大烧杯
(2)偏大;偏大
(3)-3000c(T2-T1)kJ/mol或3000c(T1-T2)kJ/mol 21*cnjy*com
解析:(1)从实验装置看,该实验中缺少环形玻璃搅拌棒,用于搅拌溶液,使之混合均匀;同时,装置中大小烧杯之间存在间隙,易导致热量散失,应将小烧杯上沿紧贴硬纸板,同时使用碎泡沫塑料填充满大烧杯。
(2)若量取NaOH溶液时仰视读数,则所量取NaOH溶液的体积偏大,反应过程中放出的热量增大,求得中和热ΔH偏小;
若用氨水代替NaOH,由于NH3·H2O是弱碱,其电离过程需要吸热,导致反应过程中放出的热量减小,求得中和热ΔH偏大;
(3)反应生成0.025molH2O时放出的热量为:c×(50+25)×1×(T2-T1)=75c(T2-T1)kJ,因此生成1molH2O时的反应热ΔH=。
分析:此题是对中和热测定实验的考查,解答此题时,应结合中和热的定义和实验测定过程进行分析。
12. (1)量筒;温度计
(2)否;金属易导热,热量散失多,导致误差偏大
(3)-56.8 kJ/mol;NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-56.8 kJ/mol
(4)无;有
解析:(1)由于实验过程中需要量取液体的体积和测量溶液的温度,因此所需的玻璃仪器还有量筒和温度计;
(2)金属铜的导热性较强,为防止热量的散失,不能用环形铜丝搅拌器代替环形玻璃搅拌棒;
(3)①反应过程中,温度变化为, 因此反应过程中放出的热量Q=cm(t2-t1)=4.18kJ/(℃·kg)×100×10-3kg×3.4℃=1.4212kJ,该反应过程中生成n(H2O)=0.025mol,因此可得该实验测得中和热;
②中和热是指强酸和强碱的稀溶液反应生成1molH2O(l)时放出的热量,因此该反应的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)?? ΔH=-56.8 kJ/mol;
(4)KOH和NaOH都是强碱,用KOH代替NaOH,对测定结果无影响;醋酸是弱酸,在水中存在电离平衡,为吸热过程,用醋酸代替HCl,会导致中和反应放出的热量部分被CH3COOH的电离吸收,导致测定结果出现误差;
分析:此题是对中和热测定实验的考查,结合该实验的相关知识进行分析即可。
三、计算题
13. (1)
(2)
解析:(1)100mL 0.200mol/L CuSO4溶液与1.95g锌粉发生反应的化学方程式为:CuSO4+Zn=ZnSO4+Cu,忽略溶液体积、质量变化可知,溶液的质量m= =1.00g/cm3×100mL(cm3)=100g,忽略金属吸收的热量可知,反应放出的热量Q=cm =4.18 ×100g×(30.1-20.1) = 4.18×103J,故答案为:4.18×103;(2)上述反应中硫酸铜的物质的量n(CuSO4)= 0.200mol/L×0.100L=0.020mol,锌粉的物质的量n(Zn)= =0.030mol,由此可知,锌粉过量。根据题干与第(1)问可知,转化0.020mol硫酸铜所放出的热量为4.18×103J,又因为该反应中焓变 代表反应1mol硫酸铜参加反应放出的热量,单位为kJ/mol,则可列出计算式为: ,故答案为: (答案符合要求且合理即可)。 21教育名师原创作品
分析:(1)根据中和滴定实验的原理可知,该反应放出的热量可根据Q=cm 计算;(2)结合焓变的概念及其与化学计量数之间的关系列式计算。
_21?????????è?????(www.21cnjy.com)_
